
Аналитика. Электрохимические методы анализа
.pdfМинистерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Пермский национальный исследовательский политехнический университет»
В.Н. Басов, А.В. Басов
АНАЛИТИКА. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Утверждено Редакционно-издательским советом университета
в качестве учебно-методического пособия
Издательство Пермского национального исследовательского
политехнического университета
2015
УДК 5.43 Б27
Рецензенты:
д-р хим. наук, профессор М.И. Дёгтев (Пермский государственный национальный исследовательский университет);
д-р техн. наук, профессор Н.Б. Ходяшев (Пермский национальный исследовательский политехнический университет)
Басов, В.Н.
Б27 Аналитика. Электрохимические методы анализа : учеб.- метод. пособие / В.Н. Басов, А.В. Басов. – Пермь : Изд-во Перм. нац. исслед. политехн. ун-та, 2015. – 79 с.
ISBN 978-5-398-01508-9
Представлена классификация электрохимических методов анализа. Рассмотрены теоретические основы методов потенциометрии, полярографии, aмперометрического титрования, кулонометрии, кондуктометрии и электрогравиметрии.
Предназначено для студентов, бакалавров и магистров, обучающихся по направлениям и специальностям: «Химическая технология и биотехнология», «Охрана окружающей природной среды», а также для аспирантов и специалистов, связанных с аналитическим контролем производства и объектов окружающей природной среды.
УДК 5.43
ISBN 978-5-398-01508-9 |
© ПНИПУ, 2015 |
ОГЛАВЛЕНИЕ |
|
ПРЕДИСЛОВИЕ.......................................................................................... |
4 |
ВВЕДЕНИЕ................................................................................................... |
5 |
Глава 1. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА................ |
10 |
1.1. Прямая потенциометрия..................................................................... |
10 |
1.2. Потенциометрическое титрование.................................................... |
24 |
Глава 2. ВОЛЬТАМПЕРОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. |
|
ПОЛЯРОГРАФИЯ..................................................................................... |
28 |
2.1. Классификация вольтамперометрических методов ........................ |
28 |
2.2. Постоянно-токовая полярография..................................................... |
29 |
2.3. Модифицированные варианты полярографии................................. |
36 |
2.4. Прямая вольтамперометрия............................................................... |
41 |
2.5. Инверсионная вольтамперометрия ................................................... |
44 |
2.6. Амперометрическое титрование ...................................................... |
46 |
Глава 3. КОНДУКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА................ |
55 |
3.1. Основные понятия и законы.............................................................. |
55 |
3.2. Прямая и косвенная кондуктометрия ............................................... |
57 |
Глава 4. КУЛОНОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА..................... |
59 |
4.1. Основные понятия и виды кулонометрического анализа............... |
59 |
4.2. Прямая потенциостатическая кулонометрия................................... |
61 |
4.3. Прямая гальваностатическая кулонометрия.................................... |
66 |
4.4. Косвенная кулонометрия (кулонометрическое титрование) ......... |
67 |
Глава 5. ЭЛЕКТРОГРАВИМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА....... |
72 |
5.1. Основы метода электрогравиметрического анализа....................... |
72 |
5.2. Разновидности электрогравиметрического анализа........................ |
74 |
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ.................................... |
78 |
3
ПРЕДИСЛОВИЕ
Втехнических учебных заведениях студенты, обучающиеся по направлениям «Химическая технология», «Биотехнология» и «Охрана окружающей природной среды», изучают курс аналитики, включающий раздел об электрохимических методах анализа.
Аналитика неразрывно связана с контролем технологических процессов, мониторингом объектов окружающей природной среды. Эти направления деятельности во многом реализуются с использованием электрохимических методов анализа.
Содержание пособия дает возможность студентам получить представление о значении электрохимических методов анализа для получения, сохранения и обработки информации по вещественному составу анализируемого объекта.
Впособии представлена классификация электрохимических методов анализа, рассмотрены теоретические основы следующих методов: прямой и косвенной потенциометрии, полярографии, амперометрического титрования, кулонометрии, кондуктометрии и электрогравиметрии. Описаны область использования методов и их основные метрологические характеристики.
Воснову пособия положен опыт многолетней работы на хи- мико-технологическом факультете Пермского национального исследовательского политехнического университета. Издание предназначено для студентов химико-технологических специальностей высших учебных заведений. Оно может быть полезно для аспирантов и специалистов, деятельность которых связана с аналитическим контролемпроизводстваиобъектовокружающейприроднойсреды.
Авторы благодарят за ценные замечания рецензентов книги: профессора М.И. Дёгтева и профессора Н.Б. Ходяшева.
Все замечания будут с благодарностью приняты авторами.
4
ВВЕДЕНИЕ
Электрохимические методы анализа основаны на использовании аналитических сигналов, возникающих в результате химических или физических воздействий на определяемое соединение; при этом используются электрохимические параметры (потенциал, ток, количество электричества, электропроводность и другие) для оценки качественных параметров и интенсивности указанных сигналов.
Первая публикация по электрохимическим методам анализа относится к 1864 г., когда увидела свет статья С. Лукова.
Он рекомендовал определять содержание меди электролитически, выделяя ее на платиновом катоде. Этот способ предназначался для Мансфельдского завода и сразу же прочно и надолго вошел в практику всех предприятий, имеющих дело с определением больших содержаний меди. Таким образом, первый же шаг электрохимического анализа принес этому методу заслуженное признание.
С тех пор постепенно накапливались все новые экспериментальные факты при измерении одной из трех основных электрохимических величин – тока, потенциала и сопротивления. Теоретические объяснения этих фактов в те времена были весьма неопределенны, многие явления не находили научного истолкования.
К началу XX в. существовало два электрохимических метода – электрогравиметрия и потенциометрия, включающая потенциометрическое титрование.
Дальнейшее развитие электрохимические методы анализа получили после открытия в 1922 г. Я. Гейровским полярографического анализа. Полярография стала по существу тем ядром, вокруг которого началивозникатьдругие электрохимическиеметоды.
5
Электрохимические методы анализа характеризуются широким интервалом определяемых веществ, селективностью, экспрессностью и возможностью легкой автоматизации процесса измерения.
Используемые в электрохимических методах анализа процессы проводят в электрохимической ячейке, включающей электролит и электроды. Электропроводность электролита обусловлена движением ионов к электродам. На границе раздела фаз металлический электрод – электролит происходит переход от ионной проводимости к электронной (или наоборот). Причиной этого процесса является протекание электрохимической реакции.
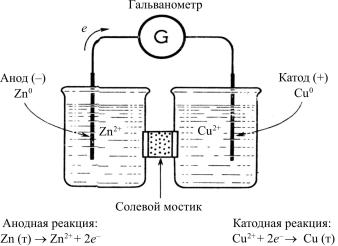
Электрохимические ячейки подразделяются на два типа. К первому типу относится гальванический элемент. Химические реакции, протекающие в гальваническом элементе, вызывают электрический ток. Гальванический элемент, схема которого приведена на рис. 1, описывают следующим образом:
Zn0 | Zn2+ || Cu2+ | Cu0
Рис. 1. Гальванический элемент
6
Электрод с более отрицательным потенциалом записывают слева, границу твердой и жидкой фазы показывают вертикальной линией, а границу между двумя жидкими фазами (жидкостное соединение или солевой мостик) – двумя линиями.
Потенциал гальванического элемента Е рассчитывают по разности стандартных потенциалов редокс-пар Е0.
Так, для рассматриваемого гальванического элемента можно записать:
Е0Zn2+|Zn0 = – 0,762 В;
Е0Cu2+|Cu0 = 0,345 В;
Е= 0,345 – (–0,762) = 1,137 В.
Другой тип ячейки – электролитическая. Химическая реакция в этом типе ячейки идет при наложении внешнего напряжения.
Как в гальванической, так и в электролитической ячейке катодом называют электрод, на котором происходит восстановление, а анодом – электрод, на котором идет окисление.
Для выполнения потенциометрических измерений используются индикаторный (рабочий) электрод и электрод сравнения. Индикаторный электрод откликается на состав анализируемого раствора. Потенциал электрода сравнения сохраняется постоянным. В качестве электродов сравнения часто используют хлоридсеребряный и каломельный (рис. 2).
Хлоридсеребряный электрод (х.-сер.э.) изготавливают, покрывая серебряную проволоку (анод) слоем хлорида серебра методом электролиза 0,1М раствора хлорида калия. Затем эту проволоку погружают в насыщенный раствор хлорида калия (3,8М раствор).
Запишем уравнение Нернста для электрода из металлического серебра:
Е = Е0 + 0,059 lgCAg+.
7
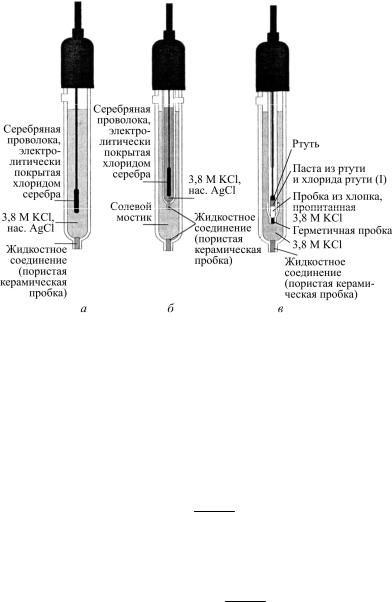
Рис. 2. Конструкции хлоридсеребряного (а, б) и насыщенного каломельного (в) электродов
Для слоя малорастворимого хлорида серебра можно записать уравнение ионизации:
AgCl ↔ Ag+ + Cl–.
Произведение растворимости
ПРAgCl = CAg+ · СCl–,
тогда
= ПРAgCl . CAg+ CCl−
Перенесем последнее выражение в ранее записанное уравнение Нернста:
E = E0 + 0,059lg ПРAgCl .
CCl−
8
В этом уравнении все члены постоянны, кроме выражения концентрации хлоридов, следовательно, потенциал электрода зависит от концентрации хлорид-ионов. При поддержании постоянной концентрации хлорида калия потенциал электрода является постоянным. Постоянство концентрации хлорида калия обеспечивается применением его насыщенного раствора. В этом случае потенциал электрода равен 0,21 В относительно нормального водородного электрода (н.в.э.).
Каломельный электрод представляет собой платиновую проволоку, погруженную в пасту из ртути и каломели – хлорида ртути (I). Внутренним раствором также служит насыщенный раствор хлорида калия.
Потенциал каломельного электрода описывается уравнением Нернста:
E = E0 − |
0,059 lgC2 |
− = E0 |
− 0,059lgC |
|
− |
|
|
2 |
Cl |
|
|
Cl |
|
|
|
|
|
|
||
Потенциал этого полуэлемента, как и в случае с хлоридсеребряным электродом, определяется концентрацией хлорида калия, служащего внутренним раствором. Постоянство концентрации хлорида калия обеспечивается использованием его насыщенного раствора.
Электрохимические методы анализа классифицируют по измеряемому параметру электрохимической ячейки. В соответствии с этим признаком различают потенциометрию, вольтамперометрию, кулонометрию, электрогравиметрию, кондуктометрию и другие.
По способу выполнения анализа выделяются:
–прямые методы (потенциометрия, кондуктометрия, вольтамперометрия, кулонометрия идр.);
–косвенные методы – титриметрия с электрохимическим способом определения конечной точки титрования (потенциометрическое, амперометрическое, кондуктометрическое титрование и др.).
9

ГЛАВА 1. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
1.1. ПРЯМАЯ ПОТЕНЦИОМЕТРИЯ
Потенциометрический метод анализа основан на измерении электродного потенциала и нахождении зависимости между его величиной и активностью (концентрацией) потенциалопределяющего компонента в растворе.
Возникновение электродного потенциала связано с электрохимическим процессом, происходящим на границе раздела металл – раствор при погружении, например, индифферентного электрода из благородного металла в раствор, содержащий ка- кую-нибудь окислительно-восстановительную систему.
При установлении динамического равновесия между окисленной (ок) и восстановленной (вос) формами, которое выражается уравнением
ок + nе ↔ вос,
электрод приобретает равновесный потенциал Еравн. Математическое выражение его связи с активностью (концентрацией) компонентов редокс-системы выражается уравнением Нернста:
Eравн = E0 + RT ln aок ,
nF aвос
где Е0 – стандартный потенциал системы при активности всех участвующих в электрохимической реакции компонентов, равной единице; R – газовая постоянная, R = 8,3144 Дж/(моль·К); T – абсолютная температура, К; n – число электронов, принимающих участие в данной электрохимической реакции; F – число Фарадея, F = 96500 Кл/моль; аок, авос – активности компонентов.
10
