
Аналитика. Электрохимические методы анализа
.pdf
Для проведения анализа необходимо располагать способом определения момента завершения химической и электрохимической реакции, а также устройством для измерения затраченного на электродную реакцию количества электричества.
4.2. ПРЯМАЯ ПОТЕНЦИОСТАТИЧЕСКАЯ КУЛОНОМЕТРИЯ
Метод основан на электропревращении определяемого вещества при постоянном потенциале рабочего электрода. Для выполнения анализа используют установку, блок-схема которой приведена на рис. 28.
Рис. 28. Установка для потенциостатической кулонометрии:
1 – потенциостат; 2 – кулонометр; 3 – ячейка; 4 – вспомогательный электрод; 5 – рабочий электрод; 6 – электрод сравнения;
7 – миллиамперметр; 8 – потенциометр
Постоянный потенциал рабочего электрода поддерживается с помощью потенциостата. Для реализации процесса анализа используют трехэлектродную ячейку, включающую рабочий
61

электрод, на котором протекает электрохимическая реакция, вспомогательный (противоэлектрод) и электрод сравнения. Относительно электрода сравнения автоматически поддерживается потенциал рабочего электрода.
Выбор потенциала рабочего электрода Ер проводят на основании вольтамперных кривых определяемого вещества. Потенциал рабочего электрода выбирают в области, отвечающей предельному току. В этих условиях скорость протекания электродной реакции максимальна.
Концентрация определяемого вещества в процессе электролиза уменьшается, поэтому в соответствии с уравнением Ильковича со временем уменьшается и величина предельного тока
(рис. 29, 30).
Рис. 29. Вольтамперная кривая процесса электролиза
Завершают процесс электролиза в момент, когда значение силы тока становится равным величине остаточного (фонового) тока.
Затраченное на электродную реакцию количество электричества можно определить различными способами. Один из них заключается в регистрации кривой изменения тока во вре-
62
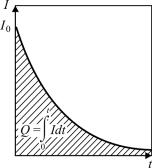
мени и измерении площади под кривой с помощью планиметра (рис. 30). Можно также вырезать и взвесить эту площадь, зарегистрированную на бумажном носителе. Указанная площадь пропорциональна количеству электричества при условии равной плотности бумаги, на которой регистрировалась кривая.
Рис. 30. Зависимость тока от времени в процессе электролиза
Для измерения количества электричества можно использовать кулонометры, включаемые последовательно с кулонометрической ячейкой. Кулонометр – это электролитическая ячейка, в которой со 100%-ным выходом по току протекает электрохимическая реакция известной стехиометрии. Если по окончании электролиза определить массу продукта анодной и катодной реакции в кулонометре, то по формуле Фарадея можно рассчитать количество электричества.
Известны кулонометры различных типов: электрогравиметрические, титриметрические, газовые и другие. Работа электрогравиметрических кулонометров основана на осаждении электролизом плотного осадка металла. Чаще других используют серебряный и медный кулонометры. В этом случае происходит выделение металлического серебра или меди на платиновом катоде. По массе выделившихся металлов, используя формулу Фарадея, вычисляют количество электричества.
63
Воснове работы титриметрического кулонометра лежит использование продуктов электродного окисления или восстановления, которые затем титруют подходящими растворами. Например, йодный кулонометр представляет собой электролитическую ячейку с двумя электродами, разделенными пористой диафрагмой. Анодную камеру заполняют раствором йодида калия. В катодную камеру помещают раствор йода в йодиде калия. В процессе электролиза на аноде протекает реакция окисления йодида до йода, а на катоде реакция восстановления йода до йодида. После окончания электролиза количество выделившегося йода определяют, используя в качестве титранта тиосульфат натрия.
Конечную точку титрования определяют с помощью индикатора (крахмала) или спектрофотометрически.
Воснове работы газового кулонометра лежит реакция электролитического разложения воды. В этом случае протекают
реакции:
–на катоде: 2 H2O + 2е– → H2 + 2 OH–,
–на аноде: 2 H2O → O2 + 4 H+ + 4е–.
Если измерить суммарный объем выделившегося водорода и кислорода, то можно рассчитать количество затраченного электричества.
Наконец, существуют кулонометры с электронным интегрированием, автоматически измеряющие количество проходящего электричества. В основу работы этого автоматического устройства положено использование зависимости между зарядом конденсатора (напряжения на конденсаторе) и затраченным на этот заряд количеством электричества. Достоинством такого интегратора является высокая точность (до 0,01 %) определения количества электричества.
Потенциостатическая кулонометрия характеризуется высокой избирательностью определения, что обеспечивается выбором рабочегоэлектродаипотенциаладляреализацииэлектроднойреакции.
64

Вкачестве рабочих электродов часто применяют ртутные
иплатиновые. Первые из них (ртутное дно) используют для процессов восстановления, а вторые – для электродного окисления.
Потенциостатический кулонометрический анализ простых по составу аналитов не вызывает затруднений. При анализе проб со сложной матрицей требуется предварительное удаление примесей, разряжающихся раньше, чем определяемое вещество.
Метод широко используется при анализе веществ высокой чистоты. Особенно привлекательна потенциостатическая кулонометрия для определения основного содержания вещества с большой точностью (0,002…0,005). Разработаны методики определения содержания металлов (медь, висмут, свинец, кобальт, никель
идругие), а также ряда органических соединений (нитропроизводные, галогенопроизводные и другие), способных к электрохимическому превращению.
Востребованным является также определение этим методом содержания кислорода в газовых смесях (рис. 31).
Рис. 31. Ячейка для определения кислорода в газе: 1 – катод (барботер) из губчатого серебра; 2 – анод из металлического кадмия; 3 – трубка для ввода анализируемого газа
65
Анализируемый газ поступает в ячейку, содержащую раствор гидроксидакалия, по трубке, в торцекоторой находитсябарботериз губчатого серебра, служащий одновременно катодом. Впорах барботерапроисходитэлектрохимическоевосстановлениекислорода:
O2 + 4е– + 2H2O ↔ 4OH–.
На аноде из металлического кадмия проходит реакция: Cd + 2OH– ↔ Cd(OH)2 + 2е–.
Источника внешнего напряжения для работы анализатора не требуется, так как процесс происходит в гальваническом элементе. Измерение затраченного количества электричества производят с помощью электронного интегратора.
Предел аналитического определения методом прямой потенциостатической кулонометрии 10–9 г/л.
4.3. ПРЯМАЯ ГАЛЬВАНОСТАТИЧЕСКАЯ КУЛОНОМЕТРИЯ
Метод предполагает проведение электролиза анализируемого объекта при постоянной силе тока и находит применение для определения веществ, находящихся на электроде. Так, метод применяют для определения толщины гальванических покрытий, оксидных или солевых пленок.
Если, например, на поверхности электрода находится металл, то анодная вольтамперная кривая будет иметь вид, показанный на рис. 32.
В соответствии с кривой 1 в начальный момент потенциал электрода Е1 (при силе тока электролиза Iэ). По мере электрохимического растворения металла происходит небольшое изменение потенциала до Е2, Е3. По окончании основного электродного процесса, описываемого уравнением Ме → Меn+ + е–, начнется протекание новой электродной реакции, что будет сопровож-
66

даться скачком потенциала до Е4. Этой реакцией может быть окисление другой твердой фазы, находящейся на электроде, или разложение воды (2H2O = O2 + 4H+ + 4е–).
Рис. 32. Вольтамперныекривыеанодного окисления металла: 1 – начальныймоментэлектролиза; 2, 3 – по истечении времениэлектролиза; 4 – кривая окисленияводы
По скачку потенциала рабочего электрода находят время окончания процесса, а затем, зная ток электролиза, вычисляют количество затраченного электричества (Q = Iэ·t). При наличии на поверхности электрода нескольких электрохимически активных фаз возможно их раздельное определение при условии, если потенциалы электропревращения отличаются не менее чем на 0,3 В.
Нижний предел аналитического определения методом прямой гальваностатической кулонометрии составляет 10–8 г/л.
4.4. КОСВЕННАЯ КУЛОНОМЕТРИЯ (КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ)
Косвенная кулонометрия основана на взаимодействии определяемого вещества с титрантом, получаемым в результате электрохимической реакции на электроде. Такой титрант называют электрогенерированным или промежуточным реа-
67

гентом, а электрод, на котором этот титрант получают, – генераторным.
Чаще всего для получения электрогенерированного титранта применяют специальный раствор, который обычно называется вспомогательным реактивом. Так, если в ячейку ввести йодид калия (вспомогательный реактив), то на генераторном платиновом аноде будет генерироваться I2, который можно использовать для титрования различных восстановителей.
Для реализации кулонометрического титрования необходимо иметь установку, содержащую гальваностат, электролитическую ячейку, индикаторную систему для обнаружения к.т.т., электротаймер для измерения времени электролиза и миллиамперметр для измерения генераторного тока. Один из возможных типов электролитическихячеекдляданногометодапоказанна рис. 33.
Рис. 33. Электролизер для кулонометрического титрования: 1 – индикаторные электроды;
2– вспомогательный электрод; 3 – генераторный электрод
68
Рабочий (генераторный) электрод– платиновая пластинка, вспомогательный электрод – платиновая проволока. Вспомогательный электрод помещен в стеклянную трубку, в торцевую часть которой для обеспечения электролитического контакта впаяна керамическаяпористаяпластина. Втрубкенаходитсяэлектролит.
Вкачестве индикаторных используют два платиновых электрода (при определении к.т.т. методом амперометрии с двумя индикаторными электродами). Если используется потенциометрическое обнаружение к.т.т., то применяют платиновый и хлоридсеребряный электроды. Наиболее простой способ измерения количества электричества, прошедшего через генераторную цепь, заключается в измерении силы тока и времени до к.т.т. (Q = I·t). Время измеряют секундомером или электротаймером, которые включают одновременносначаломгенерированиякулонометрическоготитранта.
Вкулонометрическом титровании применяют как визу-
альные, так и инструментальные методы определения к.т.т. В первых из них используют индикаторы. Из инструментальных методов определения к.т.т. применяют потенциометрический, амперометрический с одним или двумя поляризованными электродами, фотометрический и другие.
Кулонометрическое титрование можно применять для определения как электрохимически активных, так и электрохимически неактивных веществ.
В первом случае электродные реакции электрохимически активного вещества и вспомогательного реактива протекают одновременно. Таким образом, одна часть определяемого вещества превращается в конечный продукт за счет электродного процесса, а другая часть – за счет взаимодействия с титрантом. Количество затраченного электричества на оба процесса эквивалентно содержанию определяемого компонента.
При определении электрохимически неактивных веществ титрант, генерируемый из вспомогательного реактива, реагирует с определяемым веществом. Количество электричества, израсхо-
69

дованного на получение титранта, эквивалентно содержанию определяемого вещества.
В кулонометрическом титровании используются все известные типы химического взаимодействия: кислотно-основное, осаждения и комплексообразования, окисления-восстановления. Типичные примеры такого титрования приведены в табл. 12, 13.
Таблица 1 2
Кулонометрическое титрование с использованием кислотно-основных реакций,
реакций осаждения и комплексообразования
Определяемое |
Генераторная |
Вторичная |
вещество |
электроднаяреакция |
аналитическаяреакция |
Кислоты |
2Н2O + 2е– 2OН– + Н2 |
ОН– + Н+ Н2О |
Основания |
Н2O 2H++1/2O2 + 2е– |
Н+ + ОН– Н2О |
Cl–, Вr–, I– |
Ag (т) Ag+ + е– |
Ag+ + Cl– AgCl (т) ит. д. |
Меркаптаны |
Ag (т) Ag+ + е– |
Ag+ + RSH AgSR (т) + Н+ |
Cl–, Вr–, I– |
2Hg (ж) Hg22+ +2 е– |
Hg22+ + 2Cl– Hg2Cl2 (т) ит. д. |
Zn2+ |
Fe(CN)63– + е– Fe(CN)64– |
3Zn2+ + 2K+ + 2Fe(CN)64– |
|
|
K2Zn3[Fe(CN)6]2 (т) |
Са2+, Сu2+, |
HgNH3Y2– + NH4+ + 2е– |
НY3– + Ca2 CaY2– + H+ и т. д. |
Zn2+, Pb2+ |
Hg (ж) + 2NH3 + HY3– |
|
|
(гдеY — ионЭДТА) |
|
|
|
|
|
|
Таблица 1 3 |
Кулонометрическое титрование с использованием окислительно-восстановительных реакций
Реагент |
Генераторная |
Определяемое вещество |
|
электродная реакция |
|||
|
|
||
Br2 |
2 Br– Br2 + 2е– |
As (III), Sb (III), U (IV), Тl(I), |
|
|
|
I–, SCN–, NH3, N2H4, NH2OH, |
|
|
|
горчичный газ, фенол, анилин, |
|
|
|
8-оксихинолин |
|
Cl2 |
2Cl– Cl2 + 2е– |
As (III), I– |
|
I2 |
2I– I2 + 2е– |
As (III), Sb (III), S2O32–, H2S, |
70
