
Полезные материалы за все 6 курсов / Статьи из журналов, таблицы и прочее / Otvety_na_ekzamen_bio
.pdfспирали. Бреши заполняются участками цепи с нормальной последовательностью нуклеотидов уже в ходе пострешгикативной репарации при участии ДНКполимеразы. Позднее была обнаружена и темновая репарация, т. е. свойство клеток ликвидировать повреждения ДНК без участия видимого света. Темновая репарация осуществляется комплексом из пяти ферментов:
узнающего химические изменения на участке цепи ДНК;
осуществляющего вырезание поврежденного участка;
удаляющего этот участок;
синтезирующего новый участок по принципу комплементарности взамен удаленного фрагмента;
соединяющего концы старой цепи и восстановленного участка.
При световой репарации исправляются повреждения, возникшие только под воздействием ультрафиолетовых лучей, при темновой — повреждения, появившиеся под влиянием жесткой радиации, химических веществ и других факторов. Темновая репарация обнаружена как у прокариот, так и в клетках эукариот. У последних она изучается в культурах тканей. Вопрос о том, почему одни повреждения репарируются, а другие нет, остается открытым. Если репарация не наступает, то клетка либо гибнет, либо наступает мутация.
Связь мутаций с репарацией ДНК.
Спонтанные повреждения ДНК встречаются довольно часто, такие события имеют место в каждой клетке. Для устранения последствий подобных повреждений имеется специальные репарационные механизмы (например, ошибочный участок ДНК вырезается и на этом месте восстанавливается исходный). Мутации возникают лишь тогда, когда репарационный механизм по какимто причинам не работает или не справляется с устранением повреждений. Мутации, возникающие в генах, кодирующих белки, ответственные за репарацию, могут приводить к многократному повышению (мутаторный эффект) или понижению (антимутаторный эффект) частоты мутирования других генов. Так, мутации генов многих ферментов системы эксцизионной репарации приводят к резкому повышению частоты соматических мутаций у человека, а это, в свою очередь, приводит к развитию пигментной ксеродермы и злокачественных опухолей покровов.
17) Изменчивость, ее формы. Модификационная изменчивость; адаптивный характер модификаций. Норма реакции генетически детерминированных признаков. Морфозы и фенокопии. Примеры.
Изменчивость это свойство живого изменяться, выражающееся в способности приобретать новые признаки или утрачивать прежние. Причинами изменчивости являются разнообразие генотипов, условия среды, которые определяют разнообразие в проявлении признаков у организмов с одинаковыми генотипами. Формирование различных типов изменчивости является следствием взаимодействия внешней среды,
генотипа и фенотипа. Фенотипические различия, вызываемые внешними факторами,
называются модификационными.Модификационная изменчивость детерминируется генотипом. Модификации бывают сезонные, экологические.
Сезонные модификации генетически детерминированная смена признаков в результате сезонных изменений климатических условий.
Экологические модификации адаптивные изменения фенотипа в ответ на изменение условий внешней среды. Фенотипически они проявляются в степени выраженности признака. Экологические модификации затрагивают количественные (масса животных, потомство) и качественные (цвет кожи у человека под влиянием УФлучей) признаки. Приспособительный (адаптивный) характер имеют все наиболее распространенные модификации. Так повышение числа эритроцитов и содержание Hb в крови животных и
человека в горах представляют приспособление для лучшего использования кислорода. Загар кожи приспособление воздействия чрезмерной инсоляции. Установлено, что адаптивными бывают только те модификации, которые вызываются обычными изменениями природных условий. Не имеют приспособительного значения модификации, вызываемые различными химическими и физическими факторами. Экологические модификации обратимы и со сменой поколений при условии изменения внешней среды могут не проявляться. Модификации не передаются по наследству. Модификации однозначны для самых примитивных и высокоорганизованных организмов.Вариации в проявлении гена не являются беспредельными. Они ограничиваются нормой реакции организма. Норма реакции это предел модификационной изменчивости признака. Различают признаки с широкой нормой реакции (масса скота, урожайность с/х культур), узкой (процент жирности молока, содержание белков в крови у человека) и однозначной нормой (большинство качественных признаков цвет волос, глаз).
Морфоз — ненаследственное изменение фенотипа организма в онтогенезе под влиянием экстремальных факторов среды. Морфозы возникают в критические периоды онтогенеза и не носят приспособительного характера. Фенотипически морфозы сходны с мутациями и в таких случаях они называются фенокопиями. Механизмом фенокопий является нарушение реализации наследственной информации. Они возникают вследствие подавления функции определенных генов. По своему проявлению они напоминают функцию известных генов, но не наследуются.
Фенокопии— изменение признака под влиянием внешних факторов в процессе его развития, зависящего от определенного генотипа, ведущего к копированию признаков, характерных для другого генотипа или его отдельных элементов. Такие изменения вызваны факторами внешней среды, однако их фенотип напоминает (копирует) проявление наследственных синдромов.
(если вы не поняли, чем морфоз отличается от фенокопии, то можно и попроще: “Фенокопия енто когда генотип не меняется, а фенотип меняется таким образом, что полученные признаки могут быть равноценны генотипическим проявлением. Фенотип подстроился под признаки мутации.
Морфоз экстренное, очень грубое изменение фенотипа, проявление признака которого выходит за норму реакции и имеет очень даже необратимый характер, чаще гибель Итак, фенокопия прикидывается мутацией, вызванной генотипом, а морфоз просто необратимо искореженный фенотип» (с)
Возникшие фенотипические модификации не наследуются (генотип не изменяется). Примером проявления фенокопий могут служитьзаболевания, приводящие к кретинизму, которые могут обусловливаться наследственными и передовыми (в частности, отсутствием йода в рационе ребенка, независимо от его генотипа) факторами.
18) Комбинативная изменчивость, причины возникновения. Значение комбинативной изменчивости в обеспечении генетического разнообразия людей. Система браков. Проблема близкородственных браков. Медикогенетические аспекты семьи.
Комбинативной называют изменчивость, в основе которой лежит образование рекомбинаций, т. е. таких комбинаций генов, которых не было у родителей.
В основе комбинативной изменчивости лежит половое размножение организмов, вследствие которого возникает огромное разнообразие генотипов. Практически неограниченными источниками генетической изменчивости служат три процесса:
Независимое расхождение гомологичных хромосом в первом мейотическом делении. Именно независимое комбинирование хромосом при мейозе является основой третьего закона Менделя. Появление зеленых гладких и желтых морщинистых семян гороха во втором поколении от скрещивания растений с желтыми гладкими и зелеными морщинистыми семенами — пример комбинативной изменчивости;
Взаимный обмен участками гомологичных хромосом, или кроссинговер. Он создает новые группы сцепления, т. е. служит важным источником генетической рекомбинации аллелей. Рекомбинантные хромосомы, оказавшись в зиготе, способствуют появлению признаков, нетипичных для каждого из родителей;
Случайное сочетание гамет при оплодотворении.
Эти источники комбинативной изменчивости действуют независимо и одновременно, обеспечивая при этом постоянную «перетасовку» генов, что приводит к появлению организмов с другими генотипом и фенотипом (сами гены при этом не изменяются). Однако новые комбинации генов довольно легко распадаются при передаче из поколения в поколение.
Комбинативная изменчивость является важнейшим источником всего колоссального наследственного разнообразия, характерного для живых организмов. Однако перечисленные источники изменчивости не порождают существенных для выживания стабильных изменений в генотипе, которые необходимы, согласно эволюционной теории, для возникновения новых видов. Такие изменения возникают в результате мутаций.
Системы браков:
Рандомизированный брак (панмиксия) не выборочный брак;
Аутбридинг (неродственный брак) брак между особями, не находящихся в родственных связях;
Инбридинг между особями, которые являющиеся родственниками: Инцестный брак между людьми I степени родства; Родственные (кровнородственные) браки между людьми II, III степеней родства;
Асортативный брак выборочные браки: · Положительные браки между особями с одинаковыми фенотипами по определенному признаку; Отрицательные браки между особями с различными фенотипами по определенной признаку.
Близкородственные браки (инбридинг) значительно влияют на генотипический состав популяции. Такие браки чаще всего заключаются между племянницей и дядей, между двоюродными братом и сестрой. Близкородственные браки запрещены во многих странах изза высокой вероятности рождения детей с наследственной патологией. Родственники, имея общее происхождение, могут быть носителями одного и того же рецессивного патологического гена, и при браке двух здоровых гетерозигот вероятность рождения больного ребенка становится высокой.
Консультирование по поводу прогноза потомства можно разделить на две большие группы: проспективное и ретроспективное.
Проспективное консультирование это наиболее эффективный вид профилактики наследственных болезней, когда риск рождения больного ребенка определяется еще до наступления беременности или на ранних ее этапах. В этом случае супруги, направленные на консультацию, не имеют больного ребенка, но существует определенный риск рождения такого ребенка, основанный на данных генеалогического исследования, анамнеза или течении данной беременности.
Ретроспективное консультирование это консультирование относительно здоровья будущих детей после рождения в семье больного ребенка.
Задача медикогенетического консультирования:
1.Установления точного диагноза врожденного или наследственного заболевания;
2.Определение типа наследования заболевания в данной семье;
3.Расчет величины риска повторения заболевания в семье;
4.Объяснение содержания медикогенетического прогноза тем людям, которые обратились за консультацией;
5.Диспансерное наблюдение и выявление группы повышенного риска среди родственников индивида с наследственной болезнью;
6.Пропаганда медикогенетических знаний среди врачей и населения;
Показания для медико-генетического консультирования:
1.Рождения ребенка с врожденными пороками развития;
2.Установленная или подозреваемая наследственная болезнь в семье;
3.Задержка физического развития или умственная отсталость у ребенка;
4.Повторные спонтанные аборты, выкидыши, мертворождения;
5.Близкородственные браки;
6.Возраст матери старше 35 лет;
7.Неблагоприятные воздействия факторов внешней среды в ранние сроки беременности (инфекционные заболевания, особенно вирусной этиологии, массивная лекарственная терапия, рентгендиагностические процедуры, работа на вредных для здоровья предприятиях
8.Неблагоприятный ход беременности;
Этапы медико-генетического консультирования.
Консультирование должно состоять из нескольких этапов для того, чтобы врачгенетик мог дать обоснованную рекомендацию и подготовить людей к правильному восприятию советов. При этом перед врачом возникают не только генетические, но и морально этические вопросы. Медикогенетическая консультация состоит из четырех этапов: диагноз, прогноз, вывод, совет. При этом необходимо откровенное и доброжелательное общение врачагенетика с семьей больного.
Первый этап консультирования начинается с уточнения диагноза болезни. Это требует близкого контакта между генетиком и врачомспециалистом в области той патологии, что является предметом консультирования (акушер, педиатр, невропатолог и др.) Начальным моментом диагностики является клинический диагноз. В медикогенетических консультациях диагноз уточняют с помощью генетического анализа (что и отличает врачагенетика от других специалистов), широко используют генеалогический и цитогенетический методы, а также специфические методы биохимической генетики, которые специально разработаны для диагностики наследственных болезней и не часто применяются в клинической практике.
На втором этапе консультирование задача врачагенетика заключается в определении риска рождения больного ребенка. Начальным моментом является родословная обследуемой семьи. Генетический риск выражает вероятность появления определенной аномалии у обследуемого или его потомков.
Он определяется двумя способами: либо путем теоретических расчетов, основанных на генетических закономерностях, либо с помощью эмпирических данных.
На третьем этапе консультирования врачгенетик должен сделать вывод о риске возникновения болезни у обследуемых детей и дать им соответствующие рекомендации. Составляя заключение, врач учитывает тяжесть семейной патологии, величину риска рождения больного ребенка и моральноэтическую сторону вопроса.
Заключительный этап консультирования (совет врачагенетика) требует самого внимательного отношения. Как отмечают некоторые авторы, многие обследуемые не готовы к восприятию генетической информации. Все лица, обращающиеся в консультацию, хотят иметь ребенка и ждут от консультантов положительного ответа. Нередко их запросы нереальны, поскольку они не знают о возможностях консультанта генетика и ожидают от него практической помощи.
19) Мутационная изменчивость. Классификация мутаций (общие принципы). Соматические и генеративные мутации. Понятие о моногенных болезнях.
Мутация – это спонтанное изменение генетического материала. Мутации возникают под действием мутагенных факторов:
физических (радиация, температура, электромагнитное излучение);
химических (вещества, которые вызывают отравление организма: алкоголь,
никотин, колхицин, формалин);биологических (вирусы, бактерии).
Различают несколько классификаций мутаций.
Классификация 1. Мутации бывают полезные, вредные и нейтральные.
Полезные мутации: мутации, которые приводят к повышенной устойчивости организма (устойчивость тараканов к ядохимикатам).
Вредные мутации: глухота, дальтонизм.
Нейтральные мутации: мутации никак не отражаются на жизнеспособности организма (цвет глаз, группа крови).
Классификация 2. Мутации бывают соматические и генеративные.
Соматические (чаще всего они не наследуются) возникают в соматических клетках и затрагивают лишь часть тела. Они будут наследоваться следующим поколением при вегетативном размножении.
Генеративные (они наследуются, т.к. происходят в половых клетках): эти мутации происходят в половых клетках. Генеративные мутации делятся на ядерные и внеядерные (или митохондриальные).
Классификация 3. По характеру изменений в генотипе мутации подразделяются на генные, хромосомные, геномные.
Генные мутации (точковые) происходят в результате потери нуклеотида, вставки нуклеотида, замены одного нуклеотида другим. Эти мутации могут приводить к генным болезням: дальтонизм, гемофилия. Таким образом, генные мутации приводят к появлению новых признаков.
Хромосомные мутации связаны с изменением структуры хромосом. Может произойти делеция – потеря участка хромосомы, дупликация – удвоение участка хромосомы, инверсия – поворот участка хромосомы на 1800, транслокация – это перенос части или целой хромосомы на другую хромосому. Причиной этого может быть разрыв хроматид и их восстановление в новых сочетаниях.
Геномные мутации приводят к изменению числа хромосом. Различают анеуплоидию и полиплоидию. Анеуплоидия связана с изменением числа хромосом на несколько хромосом (1, 2, 3): А) моносомия общая формула 2n1 (45, Х0), болезнь – синдром ШерешевскогоТернера. Б) трисомия общая формула 2n+1 (47, ХХХ или 47, ХХУ) болезнь – синдром Клайнфельтра. В) полисомия Моногенные болезни (МБ) заболевания, в основе этиологии которых лежит единичная
генная мутация. МБ наследуются в соответствии с законами Менделя. В настоящее время описано около 5000 нозологических единиц МБ. Они выявляются у 36% новорожденных, а в структуре общей смертности детей до 5 лет на их долю приходится 1014%. МБ, гены которых картированы на хромосомах, насчитывают до 900 нозологических единиц. Для примерно 350 болезней выяснен характер генной мутации, установлена природа биохимического дефекта. Для ряда МБ физически картированы на хромосомах конкретные мутантные гены. Индивидуальный и популяционный риск возникновения МБ существенно различаются изза неравномерного распространения обусловливающих их генов. Принято считать, что МБ, встречающиеся с частотой 1:10 000 и выше, это часто встречающиеся, а с частотой менее 1:100 000 редкие заболевания.
20) Генные мутации, их классификация: делеции, дупликации, инверсии, транслокации. Причины и механизмы возникновения. Значение в развитии патологических состояний человека.
Генные (точковые) мутации это изменения числа и/или последовательности нуклеотидов в структуре ДНК (вставки, выпадения, перемещения, замещения нуклеотидов) в пределах отдельных генов, приводящие к изменению количества или качества соответствующих белковых продуктов. Причины – нарушения при удвоении (репликации) ДНК. Примеры: серповидноклеточная анемия, фенилкетонурия. Замены
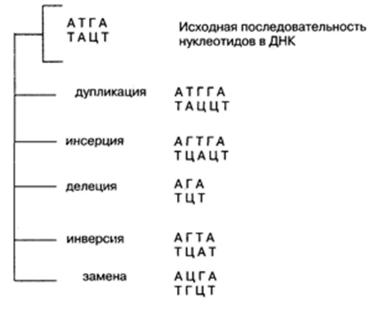
оснований приводят к появлению трех типов мутантных кодонов: с измененным смыслом (миссенсмутации), с неизмененным смыслом (нейтральные мутации) и бессмысленных, или терминирующих кодонов (нонсенсмутации).
Виды:
Генные дупликации — удвоение пары или нескольких пар нуклеотидов (удвоение пары Г—Ц).
Генные инсерции — вставка пары или нескольких нар нуклеотидов (вставка пары Г—Ц между А—Т и Т—А).
Генные делеции — выпадение нуклеотидов (выпадение комплементарной пары Т—А между А—Т и Г—Ц).
Генные инверсии — перестановка фрагмента гена (во фрагменте исходная последовательность нуклеотидов Т—А, Г—Ц заменяется на обратную Г—Ц, Т— А).
Большинство генных мутаций рецессивны по отношению к «нормальному» аллелю, который, успешно выдержав отбор на протяжении многих поколений, достиг генетического равновесия с остальным генотипом. Будучи рецессивными, мутантные аллели могут оставаться в популяции в течение многих поколений, пока им не удастся встретиться, т. е. оказаться в гомозиготном состоянии и проявиться в фенотипе. Время от времени могут возникать и доминантные мутантные аллели, которые немедленно дают фенотипический эффект.
21) Хромосомные мутации, их классификация: делеции, дупликации, транслокации, инверсии. Причины и механизмы возникновения. Значение в развитии патологических состояний человека.
Хромосомные перестройки – абберации возникают в результате разрыва хромосомы. Хромосомные перестройки могут быть внутрихромосомными и межхромосомными. Классификация:
Выпадение участков хромосом – делеции; различают терминальные (утрата концевого участка хромосомы) и интеркалярные (утрата участка на внутреннем участке хромосомы), происходят вследствие простого разрыва хромосомы с последующей утратой сегмента или неравного кроссинговера между хромосомами
или хроматидами; если после образования делеции, хромосома сохранила центромеру, то она аналогично другим хромосомам передается при делении (синдром кошечьего крика (делеция короткого плеча 5й хромосомы);
Удвоение отдельных участков хромосом – дупликации; возникает изза ионизирующих и других видов излучения, некоторых химических соединений, вирусов (синдром Палмистера (дупликация короткого плеча 2 хромосомы);
Поворот участка хромосомы на 180 – инверсии; в зависимости от того, включает ли инвертируемый участок центромеру или нет различают перицентрические и парацентрические инверсии;
Прикрепление оторвавшегося участка хромосомы к другой хромосоме – транслокации; реципрокные транслокации – 2 поврежденные негомологичные хромосомы обмениваются отделившимися от них участками;
Сбалансированные;
Несбалансированные;
Робертсоновские – 2 негомологичные хромосомы объединяются в одну или из одной хромосомы образуются две самостоятельные.
Мутационный процесс является главным источником изменений, приводящим к различным патологиям. Задачи науки на ближайшие время определяются как уменьшения генетического груза путем предотвращения или снижения вероятности мутаций и устранения возникших в ДНК изменений с помощью генной инженерии. Генная инженерия новое направление в молекулярной биологии, появившееся в последние время, которое может в будущем обратить мутации на пользу человеку, в частности, эффективно бороться с вирусами. Уже сейчас существуют вещества называемые антимутагены, которые приводят к ослаблению темпов мутирования. Успехи современной генетики находят применение в диагностики, профилактике и лечении ряда наследственных патологий.
22) Геномные мутации: классификация, причины, механизмы; роль в возникновении хромосомных синдромов. Антимутационные механизмы.
К геномным мутациям относят гаплоидию, полиплоидию и анеуплоидию. Анеуплоидией называют изменение количества отдельных хромосом отсутствие (моносомия) или наличие дополнительных (трисомия, тетрасомия, в общем случае полисомия) хромосом, т.е. несбалансированный хромосомный набор. Клетки с измененным числом хромосом появляются вследствие нарушений в процессе митоза или мейоза.
Причины мутаций:
Нарушение расхождения бивалентных гомологичных хромосом в анафазе мейоза
1;
Гаметы лишены данной хромосомы;
Гаметы имеют одну группу сцепления;
Нарушение расхождения сестринских хроматид в анафазе мейоза 2;
Нарушение расхождения хромосом при митозе;
|
Классификация: |
1) Геномные синдромы |
2) Структурные аберрации |
Причины: |
(Изменения структуры хромосомы) |
нарушение мейоза у родителей |
с.Кошачьего крика |
(нерасхождение хромосом) |
с.Орбели |
дробление зиготы |
|
Изменение числа аутосом: с.Дауна с.Патау с.Эдвардса
Изменение числа хромосом: с.ШершевскогоТернера с.Клайнфельтера с.Трисомиих
23) Человек как объект генетических исследований. Цитогенетический метод; его значение для диагностики хромосомных синдромов. Правила составления идиограмм здоровых людей. Идиограммы при хромосомных синдромах (аутосомных и гоносомных). Примеры.
Человек как объект генетических исследований представляет сложность:
Нельзя применять гибридологический метод;
Медленная смена поколения;
Малое колво потомства;
Большое число хромосом.
Цитогенетический метод сформировался в течение 2030х годов, основан на микроскопическом исследовании хромосом. Нормальный кариотип человека включает 46 хромосом(22 пары аутосом и 2 половые хромосомы). Определяют соотношение длинны короткого плеча к длине всей хромосомы. В 1960г. была разработана первая Международная классификация хромосом человека (Денверская). В основу ее были положены особенности величины хромосом и расположение первичной перетяжки. Все аутосомы человека подразделяются на 7 групп: A, B, C, D, E, F,G. все хромосомы имеют порядковые номера. Половые хромосомы крупная X и мелкая Y выделяются отдельно.
A 1.2.3 (номер) 118.3(размер, мкм) 1 и 3метацентрические, 2субметацентрические.
B |
4.5 |
7.7 |
Крупные субметацентрические |
C612 7.25.7 Средние субметацентрические
D1315 4.2 Средние акроцентрические
E1618 3.63.2Мелкие субметацентрические 18акроцентрические
F1920 2.32.8Самые мелкие метацентрические
G2122 2.3 Самые мелкие акроцентрические (см. Тетрадь №2)
Этапы исследования:
•Культивирование клеток человека
•Стимуляция митозов фитогемагглютинном (ФГА)
•Добавление колхицина (разрушает нити веретена деления) для остановки митоза на стадии метафазы
•Обработка клеток гипотоническим раствором, вследствие чего хромосомы рассыпаются и лежат свободно
•Окрашивание хромосом
•Вырезание отдельных хромосом и построение идиограммы
Его использование дает следующие возможности:
1.Изучать морфологию хромосом и кариотипы, процессы мутагенеза на уровне хромосом и кариотипа
2.Определить генетический пол
3.Диагностировать различные хромосомные болезни( болезнь Дауна у мальчика 47, XY, 21+; Синдром кошачьего крика у девочки: 46, XX, 5p)
24) Биохимический метод изучения генетики человека; его значение для диагностики наследственных болезней обмена веществ. Роль транскрипционных, посттранскрипционных и посттрансляционных модификаций в регуляции клеточного обмена. Примеры.
Биохимический метод направлен на выявление биохимического фенотипа организма. Этот метод используется для диагностики болезней обмена веществ, причиной которых является изменение активности определенных ферментов. Применяются экспрессметоды основанные на простых качественных реакциях выявления продуктов обмена в моче, крови.
Биохимическую диагностику наследственных нарушений обмена проводят в 2 этапа. На первом этапе отбирают предположительные случаи заболеваний, на втором – более сложными и точными методами уточняют диагноз заболевания. Применение биохимических исследований для диагностики заболеваний в пренатальном периоде или непосредственно после рождения позволяет своевременно выявить патологию и начать специфические медицинские мероприятия.
Наследственные дефекты обмена можно диагностировать посредством определения структуры измененного белка или его количества, выявления дефектных ферментов или обнаружения промежуточных продуктов обмена веществ во внеклеточных жидкостях организма (крови, моче, поте и т.д.). Например, анализ аминокислотных последо вательностей мутационно измененных белковых цепей гемоглобина позволил выявить несколько наследственных дефектов, лежащих в основе ряда заболеваний, — гемоглобинозов. Так, при серповидноклеточной анемии у человека аномальный гемоглобин вследствие мутации отличается от нормального заменой только одной аминокислоты (глутаминовой кислоты на валин).
В практике здравоохранения кроме выявления гомозиготных носителей мутантных генов существуют методы выявления гетерозиготных носителей некоторых рецессивных генов,что осо бенно важно при медикогенетическом консультировании. Так, у фенотипически нормальных гетерозигот по фенилкетонурии (рецессивный мутантный ген; у гомозигот нарушается обмен аминокислоты фенилаланина, что приводит к умственной отсталости) после приема фенилаланина обнаруживается повышенное его содержание в крови. При гемофилии гетерозиготное носительство мутантного гена может быть установлено с помощью определения активности фермента, измененного в результате мутации.
Пример – фенилкетонурия (ФКУ). Причина возникновения этого заболевания связана с тем, что в печени человека не вырабатывается особый фермент – фенилаланин4

гидроксилаза. Он отвечает за превращение фенилаланина в тирозин.
Общей же причиной наследственных болезней обмена веществ являются нарушения, произошедшие в процессе транскрипции, трансляции или сборки белка.
25) Генеалогический метод генетики человека. Основные правила составления и последующего анализа родословных схем (на примере собственной родословной схемы). Значение метода в изучении закономерностей наследования признаков.
Генеалогический метод: в основе лежат составление и анализ родословных. Использование этого метода возможно в том случае, когда известны прямые родственники — предки обладателя наследственного признака (пробанда) по материнской и отцовской линиям в ряду поколений или потомки пробанда также в нескольких поколениях.
При составлении родословных в генетике используется определенная система обозначений. После составления родословной проводится ее анализ с целью установления характера наследования изучаемого признака.
Условные обозначения, принятые при составлении родословных:
1 — мужчина; 2 — женщина; 3 — пол не выяснен; 4 — обладатель изучаемого признака; 5 — гетерозиготный носитель изучаемого рецессивного гена; 6 — брак; 7 — брак мужчины с двумя женщинами; 8 — родственный брак; 9 — родители, дети и порядок их рождения; 10 — дизиготные близнецы; 11 — монозиготные близнецы.
Пробанд в родословной обычно обозначается стрелочкой. Поколения обозначают римскими цифрами, индивидов в данном поколении — арабскими.
Данный метод можно считать универсальным. Клиникогенеалогический метод широко применяется при решении теоретических проблем:
при установлении наследственного характера признака;
при определении типа наследования признака или заболевания;
для оценки пенетрантности гена;
при анализе сцепления генов и картировании хромосом;
при изучении интенсивности мутационного процесса;
при расшифровке механизмов взаимодействия генов.
Составление родословной начинается со сбора сведений о семье, и прежде всего со сбора сведений о пробанде — индивиде, который является предметом интереса исследователя (врача, педагога). Чаще всего это больной или носитель изучаемого признака. Нельзя забывать, что любой человек может обращаться за медикогенетической консультацией.
Дети одной родительской пары (братья и сестры) называются сибсами. Если сибсы имеют только одного родителя, они называются полусибсами.
Различают:
единоутробных (общая мать);
единокровных (общий отец).
Обычно родословная собирается в связи с изучением одного или нескольких заболеваний
