
Полезные материалы за все 6 курсов / Учебники, методички, pdf / Биохимия
.pdf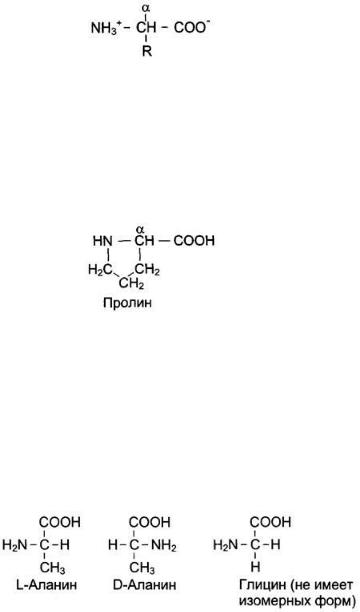
СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ БЕЛКОВ
I. Строение и свойства α-аминокислот. Пептидная связь
Белки — высокомолекулярные органические соединения, в которых мономерами служат аминокислоты. В составе белков в организме человека встречают только 20 α-аминокислот. Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке.
Общие структурные особенности аминокислот, входящих в состав белков
Общая структурная особенность аминокислот — наличие амино- и карбоксильной групп, соединённых с одним и тем же α-углеродным атомом. R — радикал аминокислот — в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
Вводных растворах при нейтральном значении pH α-аминокислоты существуют
ввиде биполярных ионов (цвиттер-ионов, амфионов).
Одна из кодируемых аминокислот— пролин — иминокислота, радикал которой связан как с α-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
Все аминокислоты, за исключением глицина (его радикал представлен атомом
водорода) содержат в α-положении асимметричный атом углерода, с которым
связаны 4 разные замещающие группы и могут находиться в двух разных
изомерных формах — L и D. В составе белков присутствуют только L-изомеры
аминокислот:
Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к α-углеродному атому.
Классификация аминокислот по растворимости их радикалов в воде
Растворимость радикалов аминокислот определяется полярностью функциональных групп, входящих в состав молекулы (полярные группы притягивают воду, неполярные её отталкивают).
Аминокислоты с неполярными радикалами
К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается.
Аминокислоты с полярными незаряженными радикалами
Радикалы этих аминокислот лучше, чем гидрофобные радикалы, растворяются в воде, так как в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят серин, треонин и тирозин, имеющие гидроксильные группы, аспарагин и глутамин, содержащие амидные группы, и цистеин с его тиольной группой.
Цистеин и тирозин содержат соответственно тиольную и гидроксильную группы, способные к диссоциации с образованием Н+, но при pH около 7,0, поддерживаемого в клетках, эти группы практически не диссоциируют.
Аминокислоты с полярными отрицательно заряженными радикалами
К этой группе относят аспарагиновую и глутаминовую аминокислоты, имеющие в радикале дополнительную карбоксильную группу, при pH около 7,0 диссоциирующую с образованием СОO- и Н+. Следовательно, радикалы данных аминокислот — анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом.
Аминокислоты с полярными положительно заряженными радикалами
Дополнительную положительно заряженную группу в радикале имеют лизин и аргинин. У лизина вторая аминогруппа, способная присоединять Н+, располагается в ε -положении алифатической цепи, а у аргинина положительный заряд приобретает гуанидиновая группа. Кроме того, гистидин содержит слабо ионизированную имидазольную группу, поэтому при физиологических колебаниях значений pH (от 6,9
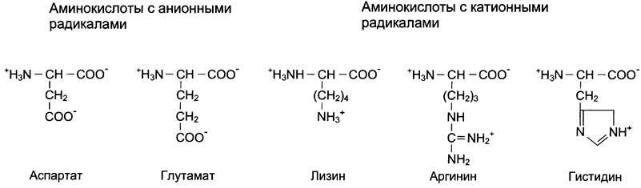
до 7,4) гистидин заряжен либо нейтрально, либо положительно. При увеличении количества протонов в среде имидазольная группа гистидина способна присоединять протон, приобретая положительный заряд, а при увеличении концентрации гидроксильных групп — отдавать протон, теряя положительный заряд радикала.
Структура полярных заряженных аминокислот в диссоциированной форме
Наибольшей растворимостью в воде обладают полярные заряженные радикалы аминокислот.
Изменение суммарного заряда аминокислот в зависимости от pH среды
При нейтральных значениях pH все кислотные (способные отдавать Н+) и все основные (способные присоединять Н+) функциональные группы находятся в диссоциированном состоянии.
Поэтому в нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд. Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд, а аминокислоты, содержащие основные функциональные группы, — положительный заряд.
Изменение pH в кислую сторону (т. е. повышение в среде концентрации Н+) приводит к подавлению диссоциации кислотных групп. В сильно кислой среде все аминокислоты приобретают положительный заряд.
Напротив, увеличение концентрации ОН- групп вызывает отщепление Н+ от основных функциональных групп, что приводит к уменьшению положительного заряда. В сильно щелочной среде все аминокислоты имеют суммарный отрицательный заряд.
Химические реакции, используемые для обнаружения аминокислот
Для обнаружения и количественного определения аминокислот, находящихся в растворе используют нингидриновую реакцию. Эта реакция основана на том, что

бесцветный нингидрин, реагируя с аминокислотой, образует пигмент краснофиолетового цвета. Так как интенсивность окраски пропорциональна количеству аминокислот в растворе, её используют для измерения концентрации α- аминокислот.
Специфические реакции на отдельные аминокислоты
Аргинин определяют с помощью качественной реакции на гуанидиновую группу (реакция Сакагучи), а цистеин выявляют реакцией Фоля, специфичной на SНгруппу данной аминокислоты. Наличие ароматических аминокислот в растворе определяют ксантопротеиновой реакцией (реакция нитрования), а наличие гидроксильной группы в ароматическом кольце тирозина — с помощью реакции
Миллона.
α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой, т. е. является амидной связью:
Характеристика пептидной связи
1. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.
2.Транс-положение заместителей
Радикалы аминокислот по отношению к оси пептидной C—N-связи находятся по "разные" стороны, в транс-положении.
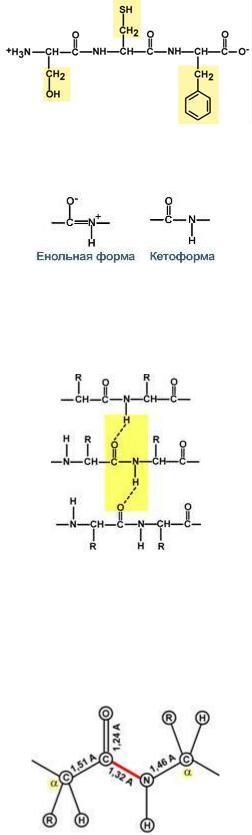
3. Две равнозначные формы Пептидная связь находится в кетоформе и енольной форме.
4. Способность к образованию водородных связей.
Атомы кислорода и водорода, входящие в пептидную группу, обладают способностью образовывать водородные связи с атомами кислорода и водорода других пептидных групп.
5. Пептидная связь имеет частично характер двойной связи.
Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).

Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной кислотой, при температуре более 105 °С, причём полный гидролиз белка до свободных аминокислот проходит примерно за сутки.
В живых организмах пептидные связи в белках разрываются с помощью специальных протеолитических ферментов (от англ. protein — белок, lysis — разрушение), называемых также протеазами, или пептидгидролазами.
Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию: при добавлении к сильно щелочному раствору белка или продукту его неполного гидролиза сульфата меди, образуются комплексные соединения меди, окрашенные в красно-фиолетовый или сине-фиолетовый цвет. Интенсивность окраски зависит от длины пептида (положительный результат для веществ, содержащих в своём составе не менее двух пептидных связей)
II. Структура белков
Первичная структура
Линейную последовательность аминокислотных остатков в полипептидной цепи называют «первичная структура белка».
Первичная структура каждого индивидуального белка закодирована в участке ДНК, называемом геном. В процессе синтеза белка информация, находящаяся в гене, сначала переписывается на мРНК, а затем, используя мРНК в качестве матрицы, на рибосоме происходит сборка первичной структуры белка
Каждый из 50 000 индивидуальных белков организма человека имеет уникальную для данного белка первичную структуру. Все молекулы данного индивидуального белка имеют одинаковое чередование аминокислотных остатков в белке, что в первую очередь отличает данный индивидуальный белок от любого другого.
Конформация белков
Линейные полипептидные цепи индивидуальных белков за счёт взаимодействия функциональных групп аминокислот приобретают определённую пространственную трёхмерную структуру, называемую «конформация».
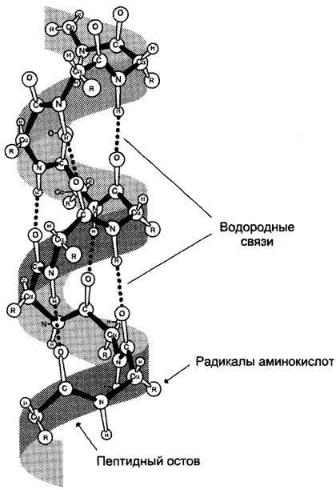
В белках различают 2 основных типа конформации полипептидных цепей: вторичную и третичную структуры.
Вторичная структура белков
Вторичная структура белков — пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: α-спираль и β-структура.
α-Спираль
В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали. На один виток α-спирали приходится 3,6 аминокислотных остатка.
В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате α-спираль «стягивается» множеством водородных связей. Несмотря на то, что данные связи относят к разряду слабых, их
количество обеспечивает максимально возможную стабильность α-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т. е. способность образовывать водородные связи с водой) α-спиралей уменьшается, а их гидрофобность увеличивается.
α-Спиральная структура — наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования α- спиралей полипептидная цепь укорачивается, но, если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится.
Радикалы аминокислот находятся на наружной стороне α-спирали и направлены от пептидного остова в стороны. Они не участвуют в образовании водородных связей, характерных для вторичной структуры, но некоторые из них могут нарушать формирование α-спирали. К ним относят:
-пролин. Его атом азота входит в состав жёсткого кольца, что исключает возможность вращения вокруг -N-СН- связи. Кроме того, у атома азота пролина, образующего пептидную связь с другой аминокислотой, нет атома водорода. В результате пролин не способен образовать водородную связь в данном месте пептидного остова, и α-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб;
-участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми возникают электростатические силы отталкивания;
-участки с близко расположенными объёмными радикалами, механически нарушающими формирование α-спирали, например, метионин, триптофан.
β-Структура
β-Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями. β-Структура образует фигуру, подобную листу, сложенному «гармошкой», — β-складчатый слой.
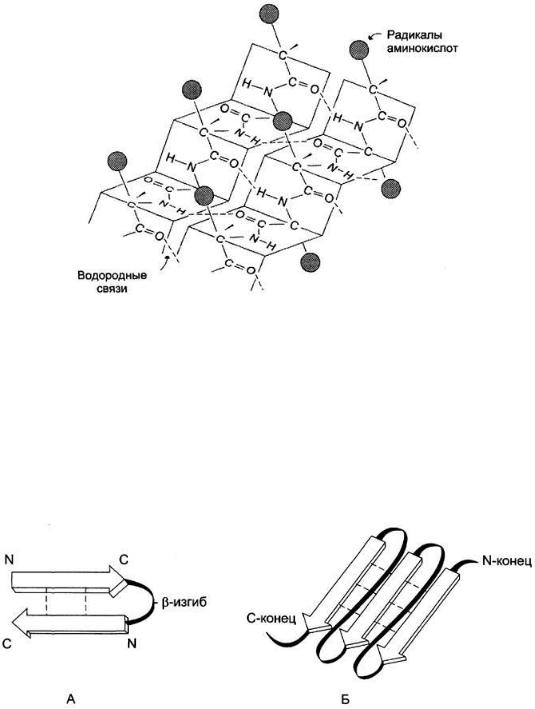
Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В β-структурах водородные связи расположены перпендикулярно полипептидной цепи.
Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная β-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного β-складчатого слоя:
В отличие от α-спиралей, разрыв водородных связей, формирующих β-структуры, не вызывает удлинения данных участков полипептидных цепей. Как α-спираль, так и β-структуры обнаружены в глобулярных и фибриллярных белках.
Нерегулярные вторичные структуры
В белках отмечают области с нерегулярной вторичной структурой, которые часто называют беспорядочными клубками. Они представлены петлеобразными и кольцеобразными структурами, имеющими меньшую регулярность укладки, чем описанные выше α-спираль и β-струкгура. Однако и они не так сильно варьируют от одной молекулы белка к другой. В каждом индивидуальном белке они имеют свою
фиксированную конформацию, определяемую аминокислотным составом данного участка цепи и окружающих его участков.
Термином «беспорядочный клубок» также часто называют денатурированный белок, образовавшийся после разрыва слабых внутримолекулярных связей и потерявший свою упорядоченную структуру.
Третичная структура белков
Третичная структура белков — трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Связи, участвующие в формировании третичной структуры белков
Гидрофобные взаимодействия
При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры растворимых в воде белков. Между ними возникают так называемые гидрофобные взаимодействия, а также силы ван дер Ваальса между близко прилегающими друг к другу атомами. В результате внутри белковой глобулы формируется гидрофобное ядро. Гидрофильные группы пептидного остова при формировании вторичной структуры образуют множество водородных связей, благодаря чему исключается связывание с ними воды и разрушение внутренней, плотной структуры белка.
Ионные и водородные связи
Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы.
Все гидрофильные группы радикалов аминокислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ионных и водородных связей. Ионные связи могут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными (катионными) группами радикалов лизина, аргинина или гистидина. Водородные связи возникают между гидрофильными незаряженными группами (такими как -ОН, -СОNН2, SН-группы) и любыми другими гидрофильными группами.
1 — ионные связи; 2 — водородные связи; 3 — гидрофобные связи; 4 — дисульфидные связи.
