
Полезные материалы за все 6 курсов / Учебники, методички, pdf / Биохимия
.pdf
Второй этап гликолиза включает реакции, приводящие к превращению фосфоглицеральдегида в пируват или лактат (соответственно реакции 6-10 или 6-11). Эти реакции связаны с синтезом АТФ;
2.Большинство гликолитических реакций обратимо, за исключением трех
(реакции 1, 3 и 10);
3.Все промежуточные соединения находятся в фосфорилированной форме. Источником фосфатной группы в реакциях фосфорилирования являются АТФ (реакции 1, 3) или Н3РО4 (реакция 6);
4.Регенерация НАД+, необходимого для окисления новых молекул фосфоглицеральдегида, происходит при аэробном гликолизе посредством дыхательной цепи. При этом водород транспортируется из цитозоля в митохондрии с помощью челночного механизма. При анаэробном гликолизе НАД+ регенерируется в реакции восстановления пирувата в лактат, сопряженного с окислением НАДН+Н+ . Процесс циклического восстановления и окисления НАД в реакциях анаэробного окисления глюкозы получил название гликолитическая
оксидоредукция:
Схема гликолитической оксидоредукции НАД-НАДН
5.Образование АТФ при гликолизе может идти двумя путями: либо субстратным фосфорилированием, когда для образования АТФ из АДФ и Н3РО4 используется энергия макроэргической связи субстрата (реакции 7, 10), либо путем окислительного фосфорилирования за счет энергии переноса электронов и протонов в дыхательной цепи.

Расчет выхода АТФ при анаэробном окислении глюкозы
Клетки, недостаточно снабжаемые кислородом, могут частично или полностью существовать за счет энергии гликолиза. В анаэробных условиях гликолиз является единственным способом получения энергии для синтеза АТФ из АДФ и неорганического фосфата.
Реакции гликолиза, связанные с затратой и образованием АТФ в анаэробных условиях

Участки гликолиза, связанные с затратой и образованием АТФ в анаэробных условиях
Расчет выхода АТФ при аэробном окислении
Большинство животных и растительных клеток в норме находится в аэробных условиях, и глюкоза полностью окисляется до СО2 и Н2О.
При наличии в клетке кислорода НАДН+Н+, возникающий на 6-й стадии, направляется в митохондрии на процесс окислительного фосфорилирования. Там его окисление сопровождается синтезом 3 молекул АТФ.
Образовавшийся в гликолизе пируват в аэробных условиях под действием пируватдегидрогеназного комплекса превращается в ацетил-SКоА, при этом образуется 1 молекула НАДН+Н+.
Ацетил-SКоА вовлекается в цикл Кребса и, окисляясь, дает 3 молекулы НАДН+Н+, 1 молекулу ФАДН2 и 1 молекулу ГТФ. При окислении НАДН+Н+, и ФАДН2 в дыхательной цепи образуется еще 11 молекул АТФ. В целом при сгорании 1 ацетильного остатка образуется 12 молекул АТФ.
Суммируя «гликолитический» АТФ, результаты окисления «гликолитического» и пируватдегидрогеназного НАДН+Н+, энергетический выход цикла Кребса и умножая все на 2, получаем 38 молекул АТФ:
Очевидно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.
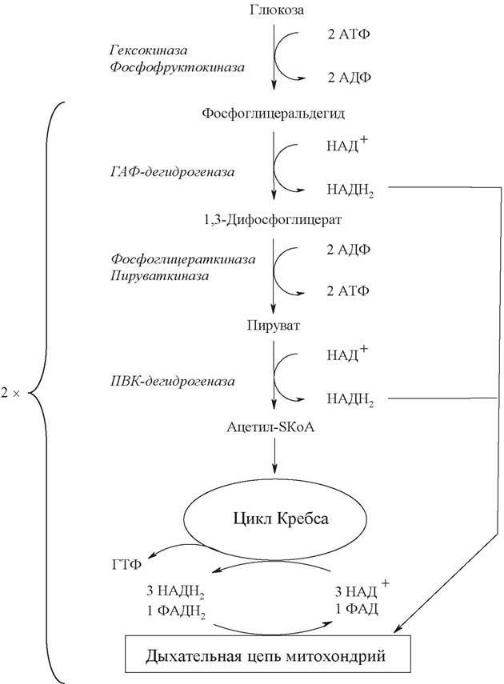
Участки аэробного окисления глюкозы, связанные с затратой и образованием АТФ
Мембрана митохондрий непроницаема для НАДН, поэтому перенос водорода с цитозольного НАДН в митохондрии осуществляется за счет челночного транспорта. Суть этого механизма сводится к тому, что НАДН в цитозоле восстанавливает некоторое соединение, способное проникать в митохондрию. В митохондрии это соединение окисляется, восстанавливая внутримитохондриальный НАД+, и вновь переходит в цитозоль. В качестве челнока работает глицеролфосфатный механизм или малат-аспартатная система:
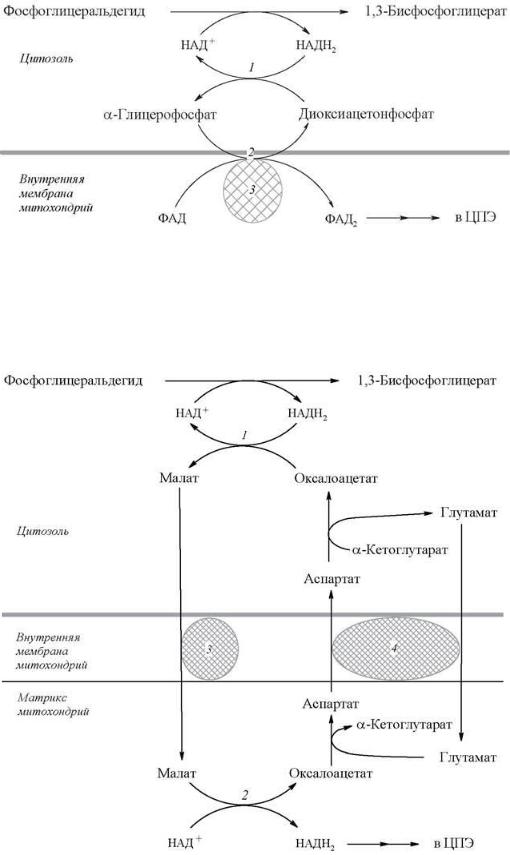
Глицеролфосфатный челнок: 1, 2 - окислительно-восстановительные реакции, обеспечивающие транспорт водорода из цитозоля в митохондрии на дыхательную цепь; 3 - ФАД-зависимая глицеролфосфатдегидрогеназа
Малат-аспартатный челнок: 1,2 - окислительно-восстановительные реакции, обеспечивающие транспорт водорода из цитозоля в митохондрии на дыхательную цепь; 3,4 - транслоказы, обеспечивающие транспорт малата, аспартата и глутамата через мембрану митохондрий
Если перенос водорода с НАДН происходит за счет глицеролфосфатного механизма, то реальное количество синтезируемых молекул АТФ меньше, так как энергия расходуется на транспорт НАДН из цитозоля через митохондриальную мембрану. Цитозольный НАДН сначала реагирует с цитозольным дигидроксиацетонфосфатом, образуя глицерол-3-фосфат, который легко проникает через мембрану митохондрии. Внутри митохондрии глицерол-3-фосфат окисляется до диоксиацетонфосфата с участием не НАД, а ФАД-зависимой глицерол-3-фосфат- дегидрогеназы. Восстановленный флавопротеин (фермент-ФАДН2) вводит приобретенные им электроны в дыхательную цепь на уровне KoQ. Таким образом, пара электронов (из одной молекулы цитозольного НАДН2), вводимая в дыхательную цепь с помощью глицеролфосфатного челночного механизма, дает не 3, а 2 АТФ и общий энергетический выход составляет не 38, а 36 молекул АТФ.
С помощью данного челночного механизма перенос восстановленных эквивалентов от цитозольного НАДН2 в митохондрии осуществляется лишь в скелетных мышцах и мозге.
Вклетках печени, почек и сердца действует более сложная малат-аспартатная челночная система. Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и аспартатаминотрансферазы как в цитозоле, так и в митохондриях. Цитозольный НАДН восстановливает оксалоацетат до малата при участии фермента малатдегидрогеназы. Малат с помощью системы, транспортирующей дикарбоновые кислоты, проходит через внутреннюю мембрану митохондрии в матрикс. Здесь малат за счет внутримитохондриального НАД+ окисляется в оксалоацетат, а восстановленный НАДН передает свои электроны в цепь дыхательных ферментов.
Всвою очередь, образовавшийся оксалоацетат в присутствии глутамата и фермента АСТ вступает в реакцию трансаминирования. Образующиеся аспартат и α- кетоглутарат с помощью специальных транспортных систем способны проходить через мембрану митохондрий. Трансаминирование в цитозоле регенерирует оксалоацетат, что вызывает к действию следующий цикл.
Вцелом процесс включает легкообратимые реакции, происходит без потребления энергии, в результате полного окисления одной молекулы глюкозы может образоваться не 36, а 38 молекул АТФ.
При переходе от анаэробных условий к аэробным накопление лактата в клетке прекращается в связи с его окислением в пируват. Первым это явление отметил Л. Пастер, сформулировав тезис о том, что с началом дыхания (т. е. потребления кислорода) брожение останавливается. Он определял брожение как жизнь без доступа кислорода.

Механизм эффекта Пастера
(блокирование брожения дыханием, сопровождаемое резким падением скорости утилизации глюкозы) объясняется тем, что в присутствии кислорода НАДН и пируват сразу после их образования утилизируются митохондриями. При переключении на аэробное окисление происходит убыль ранее накопленного лактата. Утилизация лактата, накопившегося в период дефицита кислорода, лежит в основе явления, которое получило название «ликвидация кислородной задолженности». Суть этого явления состоит в том, что после интенсивной мышечной работы легочное дыхание не сразу возвращается к норме, а некоторое время остается усиленным. Избыточное потребление кислорода в этот период определяется количеством лактата, накопившегося во время работы, недостаточно обеспеченной кислородом.
Таким образом, в отсутствие или при недостатке кислорода лактат не может не образоваться, а при достаточном снабжении кислородом он не может образоваться.
Схемы аэробного и анаэробного гликолиза
В ряде случаев выработка лактата может происходить в аэробных условиях. В частности, он может образовываться в аэробных условиях в злокачественных опухолях. Причины отсутствия эффекта Пастера в раковых клетках до сих пор не выяснены. Эритроциты также вырабатывают лактат в обычных аэробных условиях. Это связано с отсутствием митохондрий в этих клетках и, как следствие, невозможностью утилизации восстановленных коферментов и пирувата. Поэтому эритроциты обеспечивают себя энергией только за счет двух молекул АТФ, образующихся в реакции субстратного фосфорилирования (7-я стадия).
Регуляция катаболизма глюкозы в скелетных мышцах
Основное значение гликолиза - синтез АТФ, поэтому его скорость должна коррелировать с затратами энергии в организме. Регуляторные факторы, изменяющие скорость гликолиза, а значит, и образование АТФ, направлены на
необратимые реакции. Показателем потребления АТФ является накопление АДФ и АМФ - продуктов распада АТФ.
Даже небольшой расход АТФ ведет к заметному увеличению АДФ и АМФ. Отношение уровня АТФ к АДФ и АМФ характеризует энергетический статус клетки, а его составляющие служат аллостерическими регуляторами скорости как общего пути катаболизма, так и гликолиза.
Существенное значение для регуляции гликолиза имеет изменение активности фосфофруктокиназы, поскольку этот фермент катализирует наиболее медленную реакцию процесса. Фосфофруктокиназа активируется АМФ, но ингибируется АТФ. АМФ, связываясь с аллостерическим центром фосфофруктокиназы, увеличивает сродство фермента к фруктозо-6-фосфату и повышает скорость его фосфорилирования.
Повышение уровня АТФ относительно АДФ снижает скорость этой реакции, поскольку АТФ в этих условиях действует как ингибитор: связывается с аллостерическим центром фермента, вызывает конформационные изменения и уменьшает его сродство к субстрату - фруктозо-6-фосфату. Снижение активности фосфофруктокиназы при высоком уровне АТФ ведет к накоплению как фруктозо-6- фосфата, так и глюкозо-6-фосфата, а последний ингибирует гексокиназу. Гексокиназа во многих тканях (за исключением печени и β-клеток поджелудочной железы) ингибируется глюкозо-6-фосфатом.
При высоком уровне АТФ снижается скорость цикла лимонной кислоты и дыхательной цепи. В этих условиях процесс гликолиза также замедляется. Следует напомнить, что регуляция ферментов ОПК и дыхательной цепи связана с изменением концентрации таких ключевых продуктов, как NADH, АТФ и некоторых метаболитов. Так, увеличение концентрации NADH, в том случае, если снижается скорость его окисления в дыхательной цепи, ингибирует некоторые аллостерические ферменты цитратного цикла.
Физиологическая роль гликолиза в печени и жировой ткани несколько иная, чем в других тканях. В печени и жировой ткани гликолиз в период пищеварения функционирует в основном как источник субстратов для синтеза жиров. Регуляция гликолиза в печени имеет свои особенности и будет рассмотрена позже.

Регуляция катаболизма глюкозы в скелетных мышцах.
2,3-бисфосфоглицератный цикл
В гликолитическом пути может протекать дополнительная реакция, катализируемая бисфосфоглицератмутазой, превращающей 1,3-бисфосфоглицерат в 2,3-бисфосфоглицерат (2,3-БФГ), который может при участии 2,3-бисфосфогли- цератфосфатазы превращаться в 3-фосфоглицерат — метаболит гликолиза. Реакции получили название шунт Раппопорта.
В большинстве тканей 2,3-БФГ образуется в небольших количествах. В эритроцитах этот метаболит образуется в значительных количествах и выполняет роль аллостерического регулятора функции гемоглобина.

2,3-БФГ, связываясь с гемоглобином, понижает его сродство к кислороду, способствует диссоциации кислорода и переходу его в ткани.
Реакции шунта Раппопорта
Образование 2,3-БФГ предполагает потерю энергии макроэргической связи в 1,3-бисфосфоглицерате, которая не переносится на АТФ, а рассеивается в форме теплоты, что означает снижение энергетического эффекта гликолиза.
СИНТЕЗ ГЛЮКОЗЫ В ПЕЧЕНИ (ГЛЮКОНЕОГЕНЕЗ)
Некоторые ткани, например, мозг, нуждаются в постоянном поступлении глюкозы. Когда поступление углеводов в составе пищи недостаточно, содержание глюкозы в крови некоторое время поддерживается в пределах нормы за счёт расщепления гликогена в печени. Однако запасы гликогена в печени невелики. Они значительно уменьшаются к 6 —10 ч голодания и практически полностью исчерпываются после суточного голодания. В этом случае в печени начинается синтез глюкозы de novo — глюконеогенез.
Глюконеогенез — процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в
