
Полезные материалы за все 6 курсов / Учебники, методички, pdf / Биохимия
.pdf
Вторично-активный транспорт глюкозы и галактозы через мембраны энтероцитов
После всасывания моносахариды (главным образом, глюкоза) покидают клетки слизистой оболочки кишечника через мембрану, обращённую к кровеносному капилляру, с помощью облегчённой диффузии. Часть глюкозы (более половины) через капилляры кишечных ворсинок попадает в кровеносную систему и по воротной вене доставляется в печень. Остальное количество глюкозы поступает в клетки других тканей.
Потребление глюкозы клетками из кровотока происходит также путём облегчённой диффузии по градиенту концентрации с участием белковпереносчиков (глюкозных транспортеров – "ГлюТ").
ГЛЮТ-белки обнаружены во всех тканях. Описано 5 типов таких транспортеров, имеющих сходную первичную структуру:
ГЛЮТ-1 – обеспечивают переход глюкозы в клетки головного мозга, а также плаценты, почек, толстого кишечника;
ГЛЮТ-2 - переносят глюкозу в кровь из печени и энтероцитов. Участвуют также в транспорте глюкозы в β - клетки поджелудочной железы;
ГЛЮТ-3 – обладают большим сродством к глюкозе, локализованы во многих тканях, включая головной мозг, плаценту, почки;
ГЛЮТ-4 – переносят глюкозу в клетки мышечной и жировой ткани. Они отличаются от остальных белков-транспортеров тем, что локализуются не в клеточной мембране, а в цитозольных везикулах, перемещаемых к плазматическим мембранам и встраиваемых в них под влиянием инсулина, участвуя в поглощении глюкозы. После снижения концентрации инсулина в крови эти белки вновь перемещаются в цитоплазму, в результате чего поступление глюкозы прекращаетcя;
Влияние инсулина на перемещение транспортёров глюкозы из цитоплазмы в плазматическую мембрану: 1 — связывание инсулина с рецептором; 2 — участок инсулинового рецептора, обращённый внутрь клетки, стимулирует перемещение транспортёров глюкозы. 3, 4 — транспортёры в составе содержащих их везикул перемещаются к плазматической мембране клетки, включаются в её состав и переносят глюкозу в клетку.
ГЛЮТ-5 – локализованы в клетках тонкого кишечника, считаются переносчиками фруктозы.
Метаболизм глюкозы в клетке
После всасывания в кишечнике моносахариды поступают в воротную вену и далее преимущественно в печень. Поскольку в составе основных углеводов пищи преобладает глюкоза, её можно считать основным продуктом переваривания углеводов. Другие моносахариды, поступающие из кишечника в процессе метаболизма, могут превращаться в глюкозу или продукты её метаболизма. Часть глюкозы в печени депонируется в виде гликогена, а другая часть через общий кровоток доставляется и используется разными тканями и органами. При нормальном рационе питания концентрация глюкозы в крови поддерживается на уровне 3,3 — 5,5 ммоль/л (60 — 100 мг/дл). А в период пищеварения её концентрация может повышаться примерно до 150 мг/дл (8 ммоль/л).
Фосфорилирование глюкозы
В дальнейших превращениях в клетках глюкоза и другие моносахариды участвуют только в виде фосфорных эфиров. Фосфорилирование свободных моносахаридов — обязательная реакция на пути их использования, она приводит к образованию более реакционноспособных соединений и поэтому может рассматриваться как реакция активации.
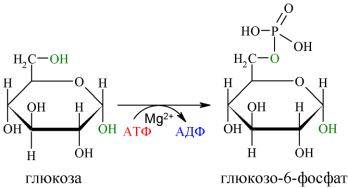
Глюкоза, поступающая в клетки органов и тканей, сразу же подвергается фосфорилированию с использованием АТФ. Эту реакцию во многих тканях катализирует фермент гексокиназа, а в печени и поджелудочной железе — фермент глюкокиназа. Фосфорилирование глюкозы — практически необратимая реакция, так как она протекает с использованием значительного количества энергии:
Образование глюкозо-6- фосфата в клетке — своеобразная «ловушка» для глюкозы, так как мембрана клетки непроницаема для фосфорилированной глюкозы (нет соответствующих транспортных белков). Кроме того, фосфорилирование уменьшает концентрацию свободной глюкозы в цитоплазме. В результате создаются благоприятные условия для облегчённой диффузии глюкозы в клетки из крови.
Глюкокиназа. Фосфорилирование глюкозы в гепатоцитах в период пищеварения обеспечивается свойствами глюкокиназы, которая имеет высокое значение Кm — 10 ммоль/л. В этот период концентрация глюкозы в воротной вене больше, чем в других отделах кровяного русла и может превышать 10 ммоль/л, а, следовательно, активность глюкокиназы в гепатоцитах повышается. Следует отметить, что активность глюкокиназы, в отличие от гексокиназы, не ингибируется продуктом катализируемой реакции — глюкозо-6-фосфатом. Это обстоятельство обеспечивает повышение концентрации глюкозы в клетке в фосфорилированной форме, соответственно её уровню в крови. Как уже упоминалось, глюкоза проникает в гепатоциты путём облегчённой диффузии при участии транспортёра ГЛЮТ-2 (независимого от инсулина). ГЛЮТ-2, так же, как глюкокиназа, имеет высокую Кm, что способствует повышению скорости поступления глюкозы в гепатоциты в период пищеварения, следовательно, ускоряет её фосфорилирование и дальнейшее использование для депонирования.
Хотя инсулин и не влияет на транспорт глюкозы, он усиливает приток глюкозы в гепатоциты в период пищеварения косвенным путём, индуцируя синтез глюкокиназы и ускоряя тем самым фосфорилирование глюкозы.
Преимущественное потребление глюкозы гепатоцитами, обусловленное свойствами глюкокиназы, предотвращает чрезмерное повышение её концентрации в крови в абсорбтивном периоде. Это, в свою очередь, снижает последствия протекания нежелательных реакций с участием глюкозы, например, гликозилирования белков.
Гексокиназа отличается от глюкокиназы высоким сродством к глюкозе (Кm <0,1 ммоль/л). Следовательно, этот фермент, в отличие от глюкокиназы, активен при низкой концентрации глюкозы в крови, что характерно для постабсорбтивного состояния. Печень в этот период поглощает гораздо меньше глюкозы, так как скорость её внутриклеточного фосфорилирования глюкокиназой резко снижается. Тогда как потребление глюкозы мозгом, эритроцитами и другими тканями обеспечивается активной в этих условиях гексокиназой. Фермент гексокиназа может катализировать фосфорилирование не только D-глюкозы, но и других гексоз, хотя и с меньшей скоростью. Активность гексокиназы изменяется в зависимости от потребностей клетки в энергии. В качестве регуляторов выступают соотношение АТФ/АДФ и внутриклеточный уровень глюкозо-6-фосфата (продукта катализируемой реакции). При снижении расхода энергии в клетке повышается уровень АТФ (относительно АДФ) и глюкозо-6-фосфата. В этом случае активность

гексокиназы снижается, и, следовательно, уменьшается скорость поступления глюкозы в клетку.
Следует отметить, что в разных тканях гексокиназа присутствует в различных изоформах, отличающихся величиной Кm. Глюкокиназа печени (и почек) является изоформой IV (гексокиназа IV). В клетках мышц содержится гексокиназа II, а в клетках опухолевых тканей преобладает гексокиназа III, с более высоким, чем у гексокиназы II, сродством к глюкозе.
Дефосфорилирование глюкозо-6-фосфата
Превращение глюкозо-6-фосфата в глюкозу возможно в печени, почках и клетках эпителия кишечника. В клетках этих органов имеется фермент глюкозо-6-фосфатаза, катализирующая отщепление фосфатной группы гидролитическим путём:
Глюкозо-6-фосфат +Н2O —> Глюкоза + Н3РO4
Образовавшаяся свободная глюкоза способна диффундировать из этих органов в кровь. В других органах и тканях глюкозо-6-фосфатазы нет, и поэтому дефосфорилирование глюкозо-6-фосфата невозможно. Пример подобного необратимого проникновения глюкозы в клетку — мышцы, где глюкозо-6-фосфат может использоваться только в метаболизме этой клетки.
Метаболизм глюкозо-6-фосфата
Глюкозо-6-фосфат может использоваться в клетке в различных превращениях, основными из которых являются: синтез гликогена, катаболизм с образованием СО2 и Н2О или лактата, синтез пентоз. Распад глюкозы до конечных продуктов служит источником энергии для организма. Вместе с тем в процессе метаболизма
глюкозо-6-фосфата образуются промежуточные продукты, используемые в дальнейшем для синтеза аминокислот, нуклеотидов, глицерина и жирных кислот. Таким образом, глюкозо-6-фосфат — не только субстрат для окисления, но и строительный материал для синтеза новых соединений.
Метаболизм гликогена
Общие принципы обмена гликогена:
- гранулы гликогена полностью не исчезают и не возникают заново. При синтезе гликогена происходит присоединение остатков - глюкоз поочередно к концам многочисленных ветвей затравочной молекулы, а при распаде – наоборот, отщепление от них;
-в процессе обмена гликогена может изменяться число ветвей в его молекуле, увеличиваясь при синтезе и, наоборот, уменьшаясь при распаде;
-рост гранул гликогена (синтез) обычно происходит в течение 1-2 часов после приема пищи, а уменьшение (мобилизация) – в период между приёмами пищи, физической работе и стрессе;
-глюкоза может откладываться только в виде полимера, так как накопление ее в свободном виде неизбежно повысило бы осмотическое давление в клетке и вызвало связанное с этим перемещение воды. Гликоген же, являясь высокомолекулярным соединением, не обладает осмотическим эффектом.
Синтез гликогена (гликогеногенез)
Гликоген синтезируется в период пищеварения (через 1 — 2 ч после приёма углеводной пищи). Процесс эндергонический, т. е. требующий затрат энергии.
Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (реакция 1). Затем глюкозо-6-фосфат в ходе обратимой реакции превращается в глюкозо-1- фосфат (реакция 2) под действием фермента фосфоглюкомутазы. Глюкозо-1-фосфат по термодинамическому состоянию мог бы служить субстратом для синтеза гликогена. Но в силу обратимости реакции глюкозо-6-фосфат <-> глюкозо-1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми. Чтобы синтез гликогена был термодинамически необратимым, необходима дополнительная стадия образования уридиндифосфатглюкозы из УТФ и глюкозо-1-фосфата (реакция 3). Фермент, катализирующий эту реакцию, назван по обратной реакции: УДФглюкопирофосфорилаза. Однако в клетке обратная реакция не протекает, потому что образовавшийся в ходе прямой реакции пирофосфат очень быстро расщепляется пирофосфатазой на 2 молекулы фосфата.
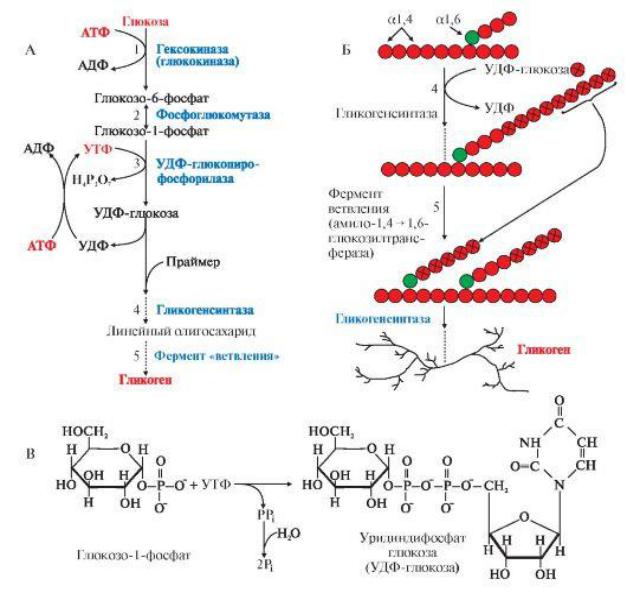
Синтез гликогена: 1 — глюкокиназа или гексокиназа; 2 — фосфоглюкомутаза; 3 — УДФ-глюкопирофосфорилаза; 4 — гликогенсинтаза (глюкозилтрансфераза); 5
— фермент «ветвления» (амило-1,4 —> 1,6-гликозилтрансфераза), светлые и заштрихованные кружки — глюкозные остатки, закрашенные кружки — глюкозные остатки в точке ветвления.
Реакция образования УДФ-глюкозы обусловливает необратимость всей серии реакций, протекающих при синтезе гликогена. Этим же объясняется невозможность протекания распада гликогена путём простого обращения процесса его синтеза.
Образованная УДФ-глюкоза далее используется как донор остатка глюкозы при синтезе гликогена. Эту реакцию катализирует фермент гликогенсинтаза (глюкозилтрансфераза). Поскольку в данной реакции не используется АТФ, фермент называют синтазой, а не синтетазой. Нуклеотидная часть УДФ-глюкозы играет существенную роль в действии гликоген синтазы, выполняя функцию «рукоятки», при помощи которой фермент располагает глюкозу в полисахаридной
цепи в нужном положении. Кроме того, нуклеотидная часть УДФ-глюкозы, повидимому, необходима для узнавания субстрата при катализе.
Синтез гликогена осуществляется путём удлинения уже имеющейся молекулы полисахарида, называемой «затравка», или «праймер». К «затравке» последовательно присоединяются молекулы глюкозы. В состав «затравки» может входить белок гликогенин, в котором к ОН-группе одного из тирозиновых остатков присоединена олигосахаридная цепочка (примерно 8 остатков глюкозы). Глюкозные остатки переносятся гликогенсинтазой на нередуцирующий конец олигосахарида и связываются α-1,4-гликозидными связями. По окончании синтеза гликогенин остаётся включённым в гранулу гликогена.
Разветвлённая структура гликогена образуется при участии амило-1,4 —> 1,6- глюкозилтрансферазы, называемой ферментом «ветвления» (от англ. branching enzyme). Как только гликогенсинтаза удлиняет линейный участок примерно до 11 глюкозных остатков, фермент ветвления переносит её концевой блок, содержащий 6
— 7 остатков, на внутренний остаток глюкозы этой или другой цепи. В точке ветвления концевой остаток глюкозы олигосахарида соединяется с гидроксильной группой в С6-положении с образованием α-1,6-гликозидной связи. Новая точка ветвления может быть образована на расстоянии не менее 4 остатков от любой уже существующей.
Таким образом, по мере синтеза гликогена многократно возрастает число ветвлений. Концы цепей служат точками роста молекулы при её синтезе и началом при её распаде.
Распад гликогена (гликогенолиз)
Распад гликогена или его мобилизация происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приёмами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы.
Распад гликогена происходит путём последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется с использованием неорганического фосфата, поэтому процесс называется фосфоролизом, а фермент гликогенфосфорилазой.
Гликогенфосфорилаза расщепляет только α-1,4-гликозидные связи и последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остаётся 4 мономера. Дальнейший распад гликогена требует участия двух других ферментов. Сначала три оставшихся до точки ветвления глюкозных остатка переносятся при участии олигосахаридтрансферазы на нередуцирующий конец соседней цепи, удлиняя её и таким образом создавая условия для действия фосфорилазы. Оставшийся в точке ветвления глюкозный остаток гидролитически

отщепляется с помощью α-1,6-глюкозидазы в виде свободной глюкозы, после чего неразветвлённый участок гликогена может вновь атаковаться фосфорилазой. Считают, что перенос трёх остатков глюкозы и удаление мономера из точки ветвления катализирует один и тот же фермент, который обладает двумя разными ферментативными активностями — трансферазной и гликозидазной. Его называют «деветвящим» ферментом (от англ, debranching enzyme).
Продукт действия гликогенфосфорилазы — глюкозо-1-фосфат — затем изомеризуется фосфоглюкомутазой в глюкозо-6-фосфат, который включается в процесс катаболизма или другие метаболические пути. В печени (но не в мышцах) глюкозо-6-фосфат может гидролизоваться с образованием глюкозы, которая выделяется в кровь. Эту реакцию катализирует фермент глюкозо-6-фосфатаза. Реакция протекает в просвете ЭР, куда с помощью специального белка транспортируется глюкозо-6-фосфат. Фермент локализован на мембране ЭР таким образом, что его активный центр обращён в просвет ЭР. Продукты гидролиза (глюкоза и неорганический фосфат) возвращаются в цитоплазму также с помощью транспортных систем.
Так же, как и синтез, расщепление гликогена начинается с нередуцирующего конца полисахаридной цепи. При этом наличие разветвлённой структуры гликогена
облегчает быстрое высвобождение глюкозных остатков, так как чем больше концов имеет молекула гликогена, тем больше молекул гликогенфосфорилазы могут действовать одновременно.
Биологическое значение обмена гликогена в печени и мышцах
1.Синтез и распад гликогена протекают по разным метаболическими путям;
2.Печень запасает глюкозу в виде гликогена не столько для собственных нужд, сколько для поддержания постоянной концентрации глюкозы в крови, и, следовательно, обеспечивает поступление глюкозы в другие ткани. Присутствие в печени глюкозо-6-фосфатазы обусловливает эту главную функцию печени в обмене гликогена;
3.Функция мышечного гликогена заключается в освобождении глюкозо-6-фосфата, потребляемого в самой мышце для окисления и использования энергии;
4.Синтез гликогена — процесс эндергонический - на включение одного остатка глюкозы в полисахаридную цепь используется 1 моль АТФ и 1 моль УТФ;
5.Распад гликогена до глюкозо-6-фосфата не требует энергии;
6.Необратимость процессов синтеза и распада гликогена обеспечивается их регуляцией.
Переключение процессов синтеза и мобилизации гликогена в печени и мышцах
происходит при переходе из абсорбтивного состояния в постабсорбтивное и из состояния покоя в режим физической работы. В переключении этих метаболических путей в печени участвуют инсулин, глюкагон и адреналин, а в мышцах -
инсулин и адреналин.
Влияние этих гормонов на синтез и распад гликогена осуществляется путем изменения в противоположном направлении активности двух ключевых ферментов: гликогенсинтазы и гликогенфосфорилазы с помощью их фосфорилирования и дефосфорилирования .
Гликогенсинтаза – активна в дефосфорилированной форме и неактивна в фосфорилированной.
Гликогенфосфорилаза - активна в фосфорилированной форме и неактивна в дефосфорилированной.

Первичным сигналом для синтеза инсулина и глюкагона является изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при переходе из абсорбтивного периода в постабсорбтивный изменяется их относительная концентрация. Отношение концентраций инсулина и глюкагона в крови называют инсулин-глюкагоновым
индексом, в зависимости от которого изменяется направление метаболизма гликогена в печени.
Регуляция метаболизма гликогена в печени.
В период пищеварения концентрация глюкозы в крови повышается до 10-12 ммоль/л, и это является сигналом для синтеза и секреции инсулина. Концентрация инсулина увеличивается, и его влияние является преобладающим. Инсулинглюкагоновый индекс в этом случае повышается. Под влиянием инсулина происходит:
-ускорение транспорта глюкозы в клетки инсулинзависимых мышечной и жировой тканей ;
-изменение активности ферментов путем фосфорилирования и дефосфорилирования. Так, например, инсулин активирует фосфодиэстеразу и снижает концентрацию цАМФ в клетке. Кроме этого, инсулин активирует
