
Полезные материалы за все 6 курсов / Учебники, методички, pdf / Биохимия
.pdf
Пируваткарбоксилаза — сложный олигомерный фермент, содержит 4
простетические группы, представленные биотином, который ковалентно связан амидной связью с ε-аминогруппами остатков лизина, находящегося в активном центре фермента:
Простетическая группа пируват карбоксилазы

Если для цикла лимонной кислоты не хватает оксалоацетата или какого-
нибудь другого промежуточного продукта, то карбоксилирование пирувата ускоряется. В этой реакции в качестве источника энергии используется АТФ.
Пируваткарбоксилаза — регуляторный фермент. Если концентрация ацетил-КоА увеличивается, то он действует как аллостерический активатор пируваткарбоксилазы, ускоряя образование оксалоацетата. Таким образом, избыток ацетил-КоА способствует активации цитратного цикла.
Метаболиты цитратного цикла используются не только как субстраты синтеза углеродного скелета ряда соединений, но и являются донорами водорода для образования восстановленных коферментов, участвующих в реакциях синтеза жирных кислот, стероидов и других веществ. Два метаболита цитратного цикла могут дегидрироваться при участии НАДФ-зaвиcимыx дегидрогеназ: малата и изоцитрата.
Например, малат может поступать из митохондрий в цитозоль клетки. В цитозоле находится НАДФ-зависимая дегидрогеназа (маликфермент), катализирующая реакцию:
Малат и изоцитрат обеспечивают образование около половины общего фонда НАДФН, используемого в восстановительных синтезах; вторая половина образуется в пентозофосфатном пути превращения глюкозы.
Гипоэнергетические состояния
Все живые клетки постоянно нуждаются в АТФ:
-клетки мозга потребляют большое количество АТФ для синтеза нейромедиаторов, регенерации нервных клеток, поддержания необходимого градиента Na+ и К+, для проведения нервного импульса;
-почки используют АТФ в процессе реабсорбции различных веществ при образовании мочи;
-в печени происходит синтез гликогена, жиров, белков и многих других соединений;
-в миокарде постоянно совершается механическая работа, необходимая для циркуляции крови;
-скелетные мышцы в покое потребляют незначительные количества АТФ,
но при физической нагрузке эти потребности возрастают в десятки раз.
Вместе с тем запасов АТФ в клетках практически не существует. Так, в
условиях прекращения синтеза АТФ в миокарде его запасы истощаются за несколько секунд и для постоянного синтеза АТФ клеткам необходим приток метаболитов как субстратов дыхания и кислорода как конечного акцептора электронов в реакциях окисления, сопряжённых с синтезом АТФ.
Нарушения какого-либо этапа метаболизма, приводящие к прекращению синтеза АТФ, гибельны для клетки.
Состояния, при которых синтез АТФ снижен, объединяют термином
«гипоэнергетические». Причинами гипоэнергетических состояний могут быть
голодание, гиповитаминозы В1, РР, В2; гипоксия.
Гипоксия может возникнуть:
-при недостатке кислорода во вдыхаемом воздухе;
-при заболеваниях лёгких и нарушении лёгочной вентиляции;
-при нарушениях кровообращения, вызванных заболеваниями сердца,
спазмом и тромбозом сосудов, кровопотерей.
Причинами гипоксии могут быть также наследственные или приобрётенные нарушения структуры гемоглобина. Частой причиной гипоэнергетических состояний могут быть нарушения процессов использования кислорода в клетках.
Причинами этих нарушений могут быть:
-действие ингибиторов и разобщителей в ЦПЭ;
-железодефицитные анемии;
-снижение уровня гемоглобина и других железосодержащих белков
(цитохромов, FeSбелков), в результате чего нарушаются перенос электронов и синтез АТФ;
- наследственные дефекты ферментов ЦПЭ и нитратного цикла.
Примерно 13 из 100 белков, участвующих в окислительном фосфорилировании, кодируются митохондриальной ДНК: 7 субъединиц комплекса I,
субъединица комплекса III, 3 субъединицы комплекса IV и 2 субъединицы комплекса
V, а также необходимые компоненты их трансляции. Остальные митохондриальные белки синтезируются в ядре.
Ядерная ДНК кодирует более 70 субъединиц белков, участвующих в окислительном фосфорилировании. Нарушения окислительного фосфорилирования в основном связаны с мутациями в митохондриальной ДНК, которые случаются примерно в 10 раз чаще, чем в ядерной. Ткани с высокой потребностью в АТФ (ЦНС,
скелетные мышцы, миокард, почки и печень) наиболее чувствительны к нарушениям окислительного фосфорилирования.
Дефекты митохондриальной ДНК наследуются по материнской линии, так как митохондрии из клеток сперматозоидов не проникают в оплодотворённую яйцеклетку. Мутации митохондриальной ДНК — частая причина, так как митохондрии не имеют такой же эффективной системы репарации Д НК, как ядро.
Даже у здоровых индивидуумов соматические мутации снижают с возрастом возможности окислительного фосфорилирования. В этих случаях способность к синтезу АТФ ниже тканеспецифического уровня нормальных клеток.
Образование токсичных форм кислорода в ЦПЭ
В ЦПЭ поглощается около 90% поступающего в клетки O2. Остальная часть
O2 используется в других окислительно-восстановительных реакциях. Ферменты,
участвующие в окислительно-восстановительных реакциях с использованием кислорода, делятся на 2 группы: оксидазы и оксигеназы.
Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2.
Оксигеназы включают один (монооксигеназы) или два (диоксигеназы)
атома кислорода в образующийся продукт реакции.
Хотя эти реакции не сопровождаются синтезом АТФ, они необходимы для многих специфических реакций в обмене аминокислот, синтезе жёлчных кислот и стероидов, в реакциях обезвреживания чужеродных веществ в печени.
Вбольшинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода.
Вневозбуждённом состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры.
О2 содержит 2 неспаренных электрона с параллельными спинами, которые не могут образовывать термодинамически стабильную пару и располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон.
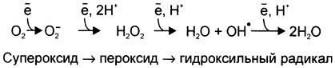
Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:
Супероксид, пероксид и гидроксильный радикал — активные окислители,
что представляет серьёзную опасность, для многих структурных компонентов клетки:

Повреждающее действие свободных радикалов на компоненты клетки:
1 — разрушение белков; 2 — повреждение ЭР; 3 — разрушение ядерной мембраны и повреждение ДНК; 4 — разрушение мембран митохондрий; 5 — ПОЛ клеточной мембраны; 6, 7, 8 — проникновение в клетку воды и ионов.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции.
Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего, при функционировании QН2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса («утечки»)
электронов с QН2 на кислород:
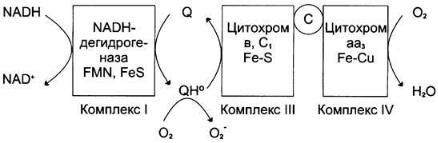
Образование супероксида в ЦПЭ
«Утечка» электронов в ЦПЭ может происходить при переносе электронов с участием коэнзима Q. При восстановлении убихинон превращается в анион-
радикал семихинона. Этот радикал неферментативно взаимодействует с О2 с
образованием супероксидного радикала. Комплекс II на рисунке не указан.
В отличие от рассмотренного механизма на этапе переноса электронов при участии цитохромоксидазы (комплекс IV) «утечка» электронов не происходит благодаря наличию в ферменте специальных активных центров, содержащих Fе и Сu
и восстанавливающих O2 без освобождения промежуточных свободных радикалов.
Вфагоцитирующих лейкоцитах (гранулоцитах, макрофагах и эозинофилах)
впроцессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов. Активные формы кислорода образуются в результате активации NADPH-
oкcидaзы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый «респираторный взрыв» с образованием активных форм кислорода.
Защита организма от токсического действия активных форм кислорода связана с наличием во всех клетках высокоспецифичных ферментов, а также с действием антиоксидантов.
Системы защиты клеток от активных форм кислорода
Ферменты антиоксидантного действия
К ферментам, защищающим клетки от действия активных форм кислорода,
относят супероксиддисмутазу, каталазу и глутатионпероксидазу. Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико.
Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода:
2 О2•‾ + 2 Н+ —> Н2О2 + О2.
Изоферменты СОД находятся и в цитозоле и в митохондриях и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода при утечке электронов из дыхательной цепи. Супероксиддисмутазы обладают узкой субстратной специфичностью, действие их направлено только на полувосстановленную молекулу кислорода. Синтез фермента ицдуцируется при активации в клетках перекисного окисления.
Каталаза – хромопротеин, состоит из 4 субъединиц, имеющих по одной группе гема, локализуется в основном в пероксисомах, частично – в микросомах и в меньшей мере – в цитозоле. Полагают, что каталаза не имеет высокого сродства к перекиси водорода и не может эффективно обезвреживать это соединение при низких концентрациях, имеющихся в цитозоле. В пероксисомах, где концентрация перекиси водорода высока, каталаза активно разрушает ее:
2 Н2О2 —> 2 Н2О + О2
Глутатионпероксидаза — важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как он разрушает и пероксид водорода и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью трипептида глутатиона (γ-глутамилцистеинилглицин). Сульфгидрильная группа глутатиона (GSН) служит донором электронов и, окисляясь, образует дисульфидную форму глутатиона, в которой 2 молекулы глутатиона связаны через дисульфидную группу:
Н2O2 + 2 GSH —> 2 Н2O + G-S-S-G
Окисленный глутатион восстанавливается глутатионредуктазой:
GS-SG + NADPH + Н+ —> 2 GSH + NADP+

Глутатионпероксидаза, которая восстанавливает гидропероксиды липидов в составе мембран, в качестве кофермента использует селен (необходимый микроэлемент пищи). При его недостатке активность антиоксидантной защиты снижается.
Витамины, обладающие антиоксидантным действием
Витамин Е (α-токоферол) - наиболее распространённый антиоксидант в природе - является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α- токоферол наиболее активен. Витамин Е отдаёт атом водорода свободному радикалу пероксида липида (LOO• ), восстанавливая его до гидропероксида (LOOH) и таким образом останавливает развитие перекисного окисления липидов:
Участие токоферола в нейтрализации перекисных радикалов
