
Полезные материалы за все 6 курсов / Учебники, методички, pdf / Биохимия
.pdf
ингибируется глюкозо-6-фосфатом (в отличие от гексокиназы мышц), то основная часть глюкозо-6-фосфата в абсорбтивном периоде направляется на синтез гликогена и по гликолитическому пути:
Направление реакций второго субстратного цикла зависит от активности фосфофруктокиназы и фосфатазы фруктозо-1,6-бисфосфата. В этом цикле действует фруктозо-2,6-бисфосфат, который одновременно выполняет функцию аллостерического активатора фосфофруктокиназы (регуляторный фермент гликолиза) и аллостерического ингибитора фосфатазы фруктозо- 1,6-бисфосфата (регуляторный фермент глюконеогенеза):
Фруктозо-2,6-бисфосфат образуется в абсорбтивный период путем фосфорилирования фруктозо-6-фосфата при участии бифункционального фермента (БИФ), который в дефосфорилированной форме (БИФ-ОН) проявляет киназную активность. Дефосфорилирование БИФ происходит с помощью фермента фосфопротеинфосфатазы, который активируется при высоком инсулинглюкагоновом индексе за счет инсулинового рецептора:

При низком инсулин-глюкагоновом индексе, характерном для периода голодания, происходит фосфорилирование БИФ (БИФ-ОРО3Н2) с помощью протеинкиназы А, которая активируется вследствие активации аденилатциклазной системы в результате взаимодействия гормона глюкагона с рецепторами. При этом БИФ проявляет фосфатазную активность. В результате БИФ катализирует реакции обратимого превращения фруктозо-6-фосфата в фруктозо-2,6-бисфосфат. БИФ может находиться в двух формах: дефосфорилированной (БИФ-ОН) и фосфорилированной (БИФ-ОРО3Н2). БИФ-ОН обладает киназной активностью и способствует образованию фруктозо-2,6-бисфосфата. БИФ-ОРО3Н2 обладает фосфатазной активностью и способствует уменьшению концентрации фруктозо-2,6- бисфосфата и образованию фруктозо-6-фосфата.
Фосфорилирование и дефосфорилирование БИФ связано с ритмом питания и регулируется гормонами. Инсулин (абсорбтивный период) активирует фермент фосфопротеинфосфатазу, что приводит к появлению формы БИФ-ОН, а глюкагон (постабсорбтивный период) активирует аденилатциклазную систему, что вызывает активацию протеинкиназы А и появление формы БИФ-ОРО3Н2 уменьшается количество фруктозо-2,6-бисфосфата, что приводит к замедлению гликолиза и переключению метаболизма на глюконеогенез. Наличие двух активностей (киназной и фосфатазной) у БИФ определило название фермента - «бифункциональный».
БИФ присутствует только в гепатоцитах. Киназную и фосфатазную реакции катализируют разные активные центры БИФ, которые функционируют по очереди в зависимости от состояния фермента фосфорилированного или дефосфорилированного. Превращение фруктозо-2,6-бисфосфата в фруктозо-6- фосфат не является обратимым процессом. Образование фруктозо-2,6- бисфосфата требует затрат АТФ, а при образовании фруктозо-6-фосфата из фруктозо-2,6- бисфосфата высвобождается неорганический фосфат.
В регуляции третьего субстратного цикла основная роль принадлежит пируваткиназе, фосфорилированная форма которой неактивна, а дефосфорилированная активна:

Дефосфорилирование пируваткиназы происходит в период пищеварения, когда инсулин активирует фосфопротеинфосфатазу, которая дефосфорилирует пируваткиназу, переводя ее в активное состояние. Следовательно, реакция превращения фосфоенолпируват в пируват ускоряется при пищеварении (абсорбтивный период). В постабсорбтивном состоянии пируваткиназа при действии глюкагона на печень переходит в фосфорилированное неактивное состояние.
Реакция глюконеогенеза превращения пирувата - оксалоацетат катализируется биотин-зависимым ферментом - пируваткарбоксилазой с участием АТФ в качестве источника энергии. Регуляция этой реакции осуществляется с помощью аллостерической активации ацетилКоА:
Биологическое значение этого эффекта объясняется тем, что при голодании организм начинает использовать жирные кислоты как источник энергии. Регуляция активности пируваткиназы в печени осуществляется путем фосфорилирования (дефосфорилирования) в зависимости от ритма питания.

Ацетил-КоА - продукт окисления жирных кислот, активируя пируваткарбоксилазу, направляет пируват по пути глюконеогенеза.
Координация в регулировании субстратных циклов II и III достигается с помощью фруктозо-1,6-бисфосфата - продукта субстратного цикла II (гликолитическое направление), который является аллостерическим активатором пируваткиназы. В период пищеварения вследствие ускорения начальных стадий гликолиза концентрация фруктозо-1,6-бисфосфата повышается, что приводит к дополнительной активации пируваткиназы.
Общая схема регуляции гликолиза и глюконеогенеза в печени в зависимости от ритма питания
Регуляция энергетического статуса
гепатоцитов осуществляется путем изменения скорости аэробного распада глюкозы. АТФ, AДФ, АМФ, а также NADH, NAD+ служат аллостерическими эффекторами ключевых ферментов гликолиза и глюконеогенеза.

При высокой концентрации энергетических молекул АТФ и NADH, характерных для высокоэнергетического статуса клетки, происходит ингибирование ключевых ферментов гликолиза - фосфофруктокиназы и пируваткиназы, что вызывает торможение гликолиза.
Высокая концентрация AMФ вызывает активацию фосфофруктокиназы (фермент гликолиза) и ингибирование фосфатазы фруктозо-1,6-бисфосфата (фермент глюконеогенеза), а AДФ ингибирует пируваткарбоксилазу, замедляя глюконеогенез. Таким образом, в случае низкого энергетического статуса клетки наблюдается активация гликолиза и ингибирование глюконеогенеза.
Регуляция гликолиза и глюконеогенеза в печени энергетическим зарядом клетки
Индукция (репрессия) синтеза ключевых ферментов
регулируется с помощью гормонов. Стероидные гормоны осуществляют регуляцию экспрессии генов, изменяя (увеличивая или уменьшая) синтез ключевых ферментов. Глюкагон и инсулин также влияют на синтез ключевых ферментов, однако в отличие от стероидных гормонов они, используя системы трансмембранной передачи сигналов, вызывают изменение активности факторов транскрипции, что также приводит к ослаблению или повышению синтеза регуляторных ферментов гликолиза и глюконеогенеза.
Впериод пищеварения инсулин индуцирует синтез глюкокиназы, фосфофруктокиназы и пируваткиназы, что приводит к активации гликолиза и вызывает репрессию фосфоенолпируваткарбоксикиназы и замедляет глюконеогенез.
Впостабсорбтивный период глюкагон повышает транскрипцию генов и синтез ключевых ферментов глюконеогенеза - фосфоенолпируваткарбоксикиназы, фруктозо-1,6-бисфосфатазы и глюкозо-6-фосфатазы, в результате чего активируется глюконеогенез.
Впериод длительного голодания особое значение в стимуляции глюконеогенеза имеет стероидный гормон кортизол, который вызывает индукцию фермента глюконеогенеза - фосфоенолпируваткарбоксикиназы.
Регуляция содержания глюкозы в крови
Результат регуляции метаболических путей превращения глюкозы — постоянство концентрации глюкозы в крови.
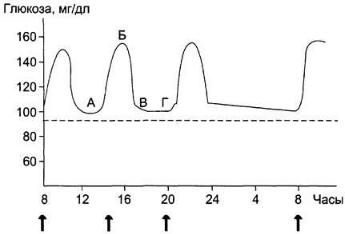
Концентрация глюкозы в артериальной крови в течение суток поддерживается на постоянном уровне 60-100 мг/дл (3,3-5,5 ммоль/л). После приёма углеводной пищи уровень глюкозы возрастает в течение примерно 1 ч до 150 мг/дл (~8 ммоль/л, алиментарная гипергликемия), а затем возвращается к нормальному уровню (примерно через 2 ч):
А, Б — период пищеварения; В, Г — постабсорбтивный период. Стрелкой указано время приёма пищи, пунктиром показана нормальная концентрация глюкозы.
В регуляции метаболизма глюкозы, связанной с режимом питания, участвуют гормоны инсулин и глюкагон.
После приема богатой углеводами пищи концентрация глюкозы в воротной вене повышается до 180-360 мг/дл (10-20 ммоль/л), возрастает инсулин/глюкагоновый индекс и поэтому возрастает скорость глюкокиназной реакции. Инсулин вызывает активацию фосфопротеинфосфатаз, дефосфорилируюих гликогенсинтазу, которая становится активной, и гликогенфосфорилазу, переходящую в неактивное состояние (ингибирующую). В результате в печени глюкозо-6-фосфат включается в гликолиз, удовлетворяя потребности клеток в энергии, и участвует в синтезе гликогена (гликогенез).
Повышение уровня инсулина увеличивает поступление глюкозы в мышцы и жировую ткань за счет ускорения транспорта глюкозы через клеточные мембраны путем перемещения белков - переносчиков ГЛЮТ-4 в плазматическую мембрану. Кроме того, инсулин стимулирует синтез гликогена в мышцах. Таким образом, поглощение глюкозы печенью, мышцами и жировой тканью приводит к восстановлению нормальной концентрации глюкозы в крови приблизительно через 2 часа после приема пищи.
В постабсорбтивный период концентрация глюкозы в крови понижается по сравнению с абсорбтивным периодом, значение инсулин/глюкагонового индекса падает. Концентрация глюкозы в крови в этих условиях поддерживается за счет процессов распада гликогена печени (гликогенолиз) и глюконеогенеза.
В течение 12-часового голодания гликоген печени является основным поставщиком глюкозы: глюкагон вызывает активацию гликогенфосфорилазы и мобилизацию гликогена.
Через сутки после последнего приема пищи гликоген печени полностью исчерпан и глюконеогенез - единственный источник, поддерживающий концентрацию глюкозы в крови в пределах нормы.
Повышение содержания глюкозы в крови выше 5,5 ммоль/л в постабсорбтивный период называется гипергликемией или гиперглюкоземией и является патологическим состоянием, связанным с гормональным нарушением регуляции содержания глюкозы в крови. Снижение содержания глюкозы в крови ниже 3,3 ммоль/л получило название гипогликемии или гипоглюкоземии. Гипоглюкоземия значительно более опасна для человека, нежели гиперглюкоземия, так как снижение содержания глюкозы в крови приводит к нарушению энергообеспечения клеток головного мозга, в результате чего возможны потеря сознания (гипогликемическая кома), судороги, что может привести к летальному исходу. У здорового человека гипогликемические состояния возникают редко и носят временный характер. Устойчивая гипогликемия развивается при инсуломе - опухоли из β-клеток поджелудочной железы, сопровождающейся гиперпродукцией инсулина, или у больных сахарным диабетом при передозировке инсулина.
ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ПРЕВРАЩЕНИЯ ГЛЮКОЗЫ
Пентозофосфатный путь, называемый также гексомонофосфатным шунтом, служит альтернативным путём окисления глюкозо-6-фосфата. альтернативный путь окисления глюкозы. Его функции:
-поставляет клеткам кофермент НАДФН, использующийся как донор водорода в реакциях восстановления;
-обеспечивает клетки пентозофосфатами для синтеза нуклеотидов и нуклеиновых кислот.
Пентозофосфатный путь не приводит к синтезу АТФ.
Ферменты пути локализованы в цитозоле, протекает в печени, жировой ткани, молочной железе, коре надпочечников, эритроцитах и состоит из 2 фаз (частей) — окислительной и неокислительной.
Вокислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу — рибулозо-5- фосфат, и образуется восстановленный NADРН.
Внеокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо- 5-фосфат и метаболиты гликолиза.
Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным коферментом NАDРН, который используется в восстановительных процессах.
Окислительный этап
В окислительной части пентозофосфатного пути глюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования.
Первая реакция дегидрирования — превращение глюкозо-6-фосфата в глюконолактон-6-фосфат — катализируется NADP+-зaвиcимoй глюкозо-6- фосфатдегидрогеназой и сопровождается окислением альдегидной группы у первого атома углерода и образованием одной молекулы восстановленного кофермента
NАDРH:

Далее глюконолактон-6-фосфат быстро превращается в 6-фосфоглюконат при участии фермента глюконолактонгидратазы (лактоназа):
Фермент 6-фосфоглюконатдегидрогеназа катализирует вторую реакцию дегидрирования окислительной части, в ходе которой происходит также и декарбоксилирование. При этом углеродная цепь укорачивается на один атом углерода, образуется рибулозо-5-фосфат и вторая молекула гидрированного NАDРН:
Восстановленный NАDРН ингибирует первый фермент окислительного этапа пентозофосфатного пути — глюкозо-6-фосфатдегидрогеназу. Превращение NАDРН в окисленное состояние NАDР+ приводит к ослаблению ингибирования фермента. При этом скорость соответствующей реакции возрастает, и образуется большее количество NАDРН.
Суммарное уравнение окислительного этапа:
Глюкозо-6-фосфат + 2 NАDР+ + Н2O —> Рибулозо-5-фосфат + 2 (NАDРН + Н+) + СO2.
Реакции окислительного этапа служат основным источником NАDРН в клетках. Гидрированные коферменты снабжают водородом биосинтетические процессы, окислительно-восстановительные реакции, включающие защиту клеток от активных форм кислорода. NАDРН как донор водорода участвует в анаболических процессах.
NАDРН образуется также при окислении малата до пирувата и диоксида углерода (при участии NАDР+-зависимой малатдегидрогеназы) и дегидрировании изоцитрата (при участии NADP+-зaвиcимoй изоцитратдегидрогеназы), но в большинстве случаев потребности клеток в восстановительных эквивалентах удовлетворяются за счёт пентозофосфатного пути.
Реакции окислительного пути протекают только в том случае, если восстановленный кофермент NАDРН возвращается в исходное окисленное состояние NАDР+ при участии NADPH-зaвиcимыx дегидрогеназ (т. е. при условии использования гидрированного NАDРН в восстановительных процессах). Если потребности клетки в NADPH незначительны, рибозо-5-фосфат образуется в результате обратимых реакций неокислительного этапа пентозофосфатного пути, используя в качестве исходных веществ метаболиты гликолиза — глицеральдегид-3- фосфат и фруктозо-6-фосфат.
Неокислительный этап
Неокислительный этап пентозофосфатного пути включает серию обратимых реакций, в результате которых рибулозо-5-фосфат превращается в рибозо-5-фосфат и ксилулозо-5-фосфат, и далее за счёт переноса углеродных фрагментов в метаболиты гликолиза — фруктозо-6-фосфат и глицеральдегид-3-фосфат. В этих превращениях принимают участие ферменты: эпимераза, изомераза, транскетолаза (использует кофермент тиаминдифосфат) и трансальдолаза. Неокислительный этап используется только для синтеза пентоз.
Рибулозо-5-фосфат служит субстратом для двух ферментов. Фермент рибулозо-5- фосфат-3-эпимераза изменяет стехиометрическое положение одной ОН-группы у третьего атома углерода, превращая рибулозо-5-фосфат в ксилулозо-5-фосфат. Другой фермент — рибулозо-5-фосфат-изомераза — катализирует превращение рибулозо-5-фосфата в рибозо-5-фосфат:
