
- •Введение в биохимию
- •Биохимия
- •Признаки живой материи:
- •Признаки живой материи:
- •Место в структуре программы специалитета. Биохимия относится к дисциплинам базовой части.
- •Объекты биохимических исследований. Современные направления исследований.
- •Биохимические анализы крови, мочи, ликвора, слюны -
- •Клиническая биохимия -
- •Структура дисциплины
- •Успехов в освоении дисциплины!
- •Вся наша жизнь - нелепое чудо, пробившееся в реальность вопреки всем законам мироздания.
- •Проблемы и задачи протеомики в медицине
- •Основные вопросы лекции:
- •Белки (протеины)
- •«Жизнь есть способ существования белковых тел» Ф. Энгельс
- •Международный проект «Протеом человека» (Human Proteome Project, НРР)
- •Белки – высокомолекулярные органические полимеры, построенные из аминокислот, связанных между собой
- •В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом
- •Качественный состав белка зависит от состава аминокислот.
- •Строение белков
- •Первичная структура белка. Аминокислоты могут ковалентно связываться друг
- •Характеристика пептидной связи
- •Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях.
- •Количество аминокислот в составе пептидов (белков) может сильно варьировать.
- •В организме вырабатывается множество пептидов, участвующих в регуляции биологических процессов и обладающих высокой
- •Молекулярная масса (ММ) белка зависит от количества
- •Роль первичной структуры
- •Вторичная структура белков -
- •Пептидные цепи могут приобретать структуры 2 типов:
- •β- структура
- •Нерегулярные вторичные структуры
- •Третичная структура белков -
- •Третичная структура белка
- •Фолдинг -
- •Форма белковой молекулы
- •Растворимость белка определяется его структурой
- •ИЭТ – индивидуальная характеристика белка
- •Центр связывания белка (активный центр) - участок
- •Этапы формирования функционально активного белка. В основе функционирования любого белка лежит его способность
- •Домен белка— элемент третичной структуры белка.
- •Сложные белки (холопротеины)
- •Сложные белки
- •Белки обладают антигенными свойствами.
- •Конформационная лабильность белков -
- •Четвертичная структура белков. Характеризуются белки, состоящие из 2 и более полипептидных цепей.
- •ОСОБЕННОСТИ ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ
- •Гемоглобин (НЬ) — олигомерный белок, состоит из 4 протомеров
- •Кооперативные изменения конформации протомеров Нb ускоряют нагрузку О2 в легких и разгрузку в
- •Изменение конформации облегчает взаимодействие следующего
- •Характерная для гемоглобина S-образная кривая насыщения О2 свидетельствует, что связывание первой молекулы О2
- •Размер белка может измеряться в числе аминокислотных остатков или в дальтонах (молекулярная масса,
- •Денатурация белка -
- •Денатурация белка. Ренативация белка.
- •Применение денатурирующих агентов в биологических исследованиях и медицине
- •Полиморфизм белков -
- •Полиморфизм белков в онтогенезе. Изофункциональные белки.
- •Полиморфизм белков при патологии. ИЗМЕНЕНИЯ БЕЛКОВОГО СОСТАВА ОРГАНИЗМА
- •Первичные протеинопатии.
- •Прионы
- •Вторичные протеинопатии: причины и следствия
- •Благодарю за внимание!

Центр связывания белка (активный центр) - участок
белковой молекулы, состоящий из радикалов аминокислот, сближенных при формировании третичной структуры.
Активный центр отвечает за специфическое взаимодействие с лигандом (низко- или высокомолекулярное вещество).
Взаимодействие лиганда с активным центром осуществляется по принципу комплементарности (пространственное и химическое соответствие).
Лигандами, взаимодействующими с трехмерной
структурой пептидной цепи, |
могут быть |
различными соединениями, |
в том числе |
ДНК, РНК, полисахариды, белки. |
|
Альбумин - белок плазмы крови проявляет свою транспортную функцию, присоединяя к активному центру гидрофобные лиганды
(жирные кислоты, билирубин,
лекарства).

Этапы формирования функционально активного белка. В основе функционирования любого белка лежит его способность к избирательному взаимодействию с лигандами.
Структурный аналог лиганда может как усиливать функцию белка (активатор), так и снижать ее (ингибитор).
Ингибиторы белковых функций могут быть лекарствами и ядами.
Многие лекарственные препараты действуют как ингибиторы белков.
Некоторые яды - специфические лиганды определённых белков.

Домен белка— элемент третичной структуры белка.
Если полипептидная цепь белка содержит > 200 аминокислот,
её пространственная структура сформирована в виде 2 или более доменов. Домен - участок
полипептидной цепи, который в процессе |
формирования |
третичной структуры приобрёл независимо |
от других |
участков той же цепи конформацию глобулярного белка.
Домен отвечает за выполнение определенных функций.
В доменных белках центры связывания с лигандом часто располагаются между доменами.
В некоторых белках домены выполняют самостоятельные функции, связываясь с различными лигандами.
Такие белки называются многофункциональными.

Сложные белки (холопротеины)
Некоторые лиганды, присоединяясь к активному центру белка, выполняют вспомогательную роль в функционировании белков.
Такие лиганды называются кофакторами, а белки, имеющие
всвоем составе небелковую часть, - сложными белками.
Небелковая часть, прочно соединенная с белком - простетическая группа.
Белки |
Простетическая |
|
группа |
|
|
Металлопротеины |
Ионы металлов |
|
|
Фосфопротеины |
Н3РО4 |
|
|
Хромопротеины |
Гем |
Флавопротеины |
Витамин В2 |
|
|
Гликопротеины |
Углеводы |
|
|
Липопротеины |
Липиды |
|
|
Нуклеопротеины |
РНК, ДНК |
|
|
Протеогликаны |
Гликозаминогликаны |
|
|

Сложные белки
Гликопротеины –
это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов в них варьирует от 1 до 85%. Гликопротеинами являются многие белки крови (антитела, интерфероны), слюны и др.
Фосфопротеины.
Фосфатная группа может выполнять:
-структурную роль, придавая заряд,
растворимость и изменяя свойства белка;
-функциональную роль, определяя активность белка (фермента).
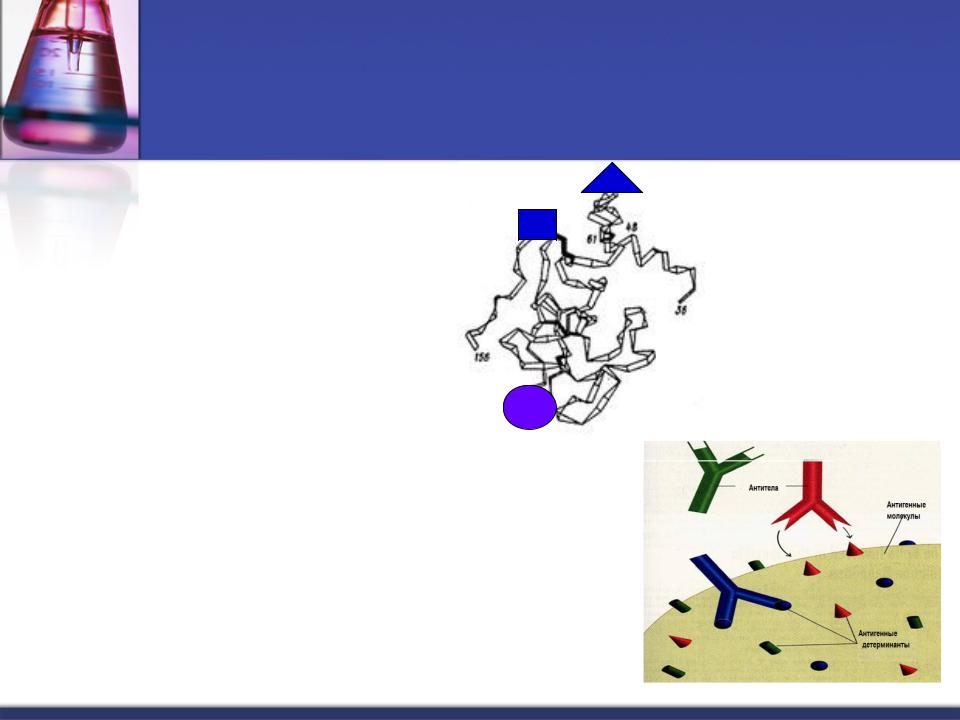
Белки обладают антигенными свойствами.
Антигены
(от греч. Anti - противодействие,
genes - рождающий) - органические вещества, способные реагировать с рецепторами лимфоцитов иммунной системы и стимулировать иммунный ответ.
Антигенные детерминанты состоят из 10—20 аминокислотных остатков и содержат гидрофильные группы ЛИЗ, АРГ, АСП и ГЛУ. Предпочитают водное окружение и располагаются на поверхности белковой глобулы.
Антитела (иммуноглобулины) —белки плазмы крови, распознают и связывают антигены.

Конформационная лабильность белков -
склонностью к небольшим изменениям конформации за счёт разрыва одних
иобразования других слабых связей.
Конформация белка может меняться
при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами.
Конформационные изменения играют огромную роль в функционировании
белков в живой клетке

Четвертичная структура белков. Характеризуются белки, состоящие из 2 и более полипептидных цепей.
Протомер – отдельная полипептидная цепь, не выполняющая функцию белка.
Субъединица – протомер или несколько протомеров, способных выполнять часть функций белка.
Олигомер - сочетание протомеров (субъединиц), несущих полную функциональную активность белка.
Взаимодействие протомеров осуществляется во многих точках контактирующих поверхностей с образованием десятков слабых связей.
Благодаря этому контактные поверхности соединяются с высокой специфичностью, и ошибки формирования четвертичной
структуры белков практически исключены.

ОСОБЕННОСТИ ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ
Олигомерные белки могут содержать четное количество протомеров (2, 4…………. 24).
В состав олигомерных белков могут входить одинаковые или разные протомеры.
Различные по структуре протомеры могут связывать разные лиганды.
Взаимодействие одного протомера со специфическим лигандом вызывает конформационные изменения всего белка и изменяет сродство других протомеров к лигандам.
Это явление носит название
кооперативное изменение конформации протомеров.

Гемоглобин (НЬ) — олигомерный белок, состоит из 4 протомеров
(2 α-цепи и 2 β-цепи)
НЬ — белок, родственный миоглобину
(белок мышц, мономер).
Вторичная и третичная структуры миоглобина и протомеров НЬ сходны.
Возможность регуляции сродства НЬ к 02 отличает его от миоглобина.
В 1960 г. была установлена пространственная структура
миоглобина – белка, выделенного из мышц кашалота. В составе
миоглобина 153 аминокислоты, они формируют общую спираль, охватывающего гем.
Функции миоглобина – создание резерва О2 в работающих мышцах.
