
- •Вопросы для подготовки к экзамену
- •Виды хеморецепторов
- •Симпатический и парасимпатический отделы и их различия
- •Функции
- •Функции
- •Функции ретикулярной формации
- •Основные ритмы на ээг
- •Альфа-ритм
- •Бета-ритм
- •Дельта-ритм
- •Тета-ритм
- •Симпатическую
- •Парасимпатическую
- •Метасимпатическую
- •Стволовые центры
- •Гипоталамические центры
- •Общие свойства нервных центров
- •I. По характеру психической активности:
- •По характеру целесообразности деятельности:
- •III. По использованию дополнительных средств:
- •IV. По продолжительности сохранения материала:
- •V. По участию наследственных механизмов:
- •Внешний и внутренний гемостаз
- •Регуляция деятельности дыхательного центра
- •Выделение слюны по механизму условного рефлекса
Внешний и внутренний гемостаз
Вторичный гемостаз крови имеет два механизма:
внешний, запускаемый за счет работы тканевых факторов коагуляции;
внутренний, активирующийся в результате работы факторов свертывания, находящихся в крови, плазме (также в этот механизм входит активность ферментов и тромбоцитарных клеток).
Следует отметить, что механизм внутреннего и внешнего гемостаза отличается только до момента активации протромбина. Далее их работа не отличается.
Первая фаза. Происходит образование активного ферментативного комплекса — протромбиназы(активатор протромбина). В образовании этого комплекса принимают участие тканевые и кровяные факторы. → формируются тканевая и кровяная протромбиназы. Образование тканевой протромбиназы начинается с активации тканевого тромбопластина, образующегося при повреждении стенок сосуда и окружающих тканей. Вместе с VII фактором и ионами кальция он активирует X фактор. В результате взаимодействия активированного X фактора с V фактором и с фосфолипидами тканей или плазмы образуется тканевая протромбиназа. Этот процесс длится 5—10 секунд. Образование кровяной протромбиназы начинается с активации XII фактора при его контакте с волокнами коллагена поврежденных сосудов. В активации и действии XII фактора участвуют также высокомолекулярный кининоген (ф XV) и калликреин (ф XIV). Затем XII фактор активирует XI фактор, образуя с ним комплекс. Активный XI фактор совместно с IV фактором активирует IX фактор, который, в свою очередь, активирует VIII фактор. Затем происходит активация X фактора, который образует комплекс с V фактором и ионами кальция→ образование кровяной протромбиназы. В этом также участвует тромбоцитарный фактор 3. Этот процесс длится 5-10 минут.
Вторая фаза. Под влиянием протромбиназы происходит переход протромбина в активный фермент тромбин. В этом процессе принимают участие факторы IV, V, X.
Третья фаза. Растворимый белок крови фибриноген превращается в нерастворимый фибрин (основа тромба) → под влиянием тромбина происходит образование фибринмономера → с участием ионов кальция образуется растворимый фибрин-полимер. Под влиянием фибринстабилизирующего фактора XIII происходит образование нерастворимого фибрин-полимера, устойчивого к фибринолизу. В фибриновых нитях оседают форменные элементы крови, в частности эритроциты, и формируется кровяной сгусток, или тромб, который закупоривает рану.
После образования сгустка начинается процесс ретракции, т.е. уплотнения и закрепления тромба в поврежденном сосуде. Это происходит с помощью сократительного белка тромбоцитов тромбостенина и ионов кальция. Через 2 — 3 часа сгусток сжимается до 25 — 50% от своего первоначального объема и идет отжатие сыворотки, т.е. плазмы, лишенной фибриногена. За счет ретракции тромб становится более плотным и стягивает края раны.
Противосвертывающая система крови. Естественные антикоагулянты.
Несмотря на то что в циркулирующей крови имеются все факторы, необходимые для образования тромба, в естественных условиях при наличии целостности сосудов кровь остается жидкой. Это обусловлено наличием в кровотоке противосвертывающих веществ, получивших название естественных антикоагулянтов, или фибринолитического звена системы гемостаза.
Естественные антикоагулянты делят на первичные и вторичные. Первичные антикоагулянты всегда присутствуют в циркулирующей крови, вторичные — образуются в результате протеолитического расщепления факторов свертывания крови в процессе образования и растворения фибринового сгустка.
Первичные антикоагулянты можно разделить на три основные группы: 1) антитромбопластины — обладающие антитромбопластическим и антипротромбиназным действием; 2) антитромбины — связывающие тромбин; 3) ингибиторы самосборки фибрина — дающие переход фибриногена в фибрин. К вторичным антикоагулянтам относят «отработанные» факторы свертывания крови (принявшие участие в свертывании) и продукты деградации фибриногена и фибрина (ПДФ), обладающие мощным антиагрегационным и противосвертывающим действием, а также стимулирующие фибринолиз. Роль вторичных антикоагулянтов сводится к ограничению внутрисосудистого свертывания крови и распространения тромба по сосудам.
Первичные:
Антитромбин III - γ2-Глобулин. Синтезируется в печени. Прогрессивно действующий ингибитор тромбине, факторов Ха, IXa, XIa, ХIIa, калликреина и в меньшей степени — плазмина и трипсина. Плазменный кофактор гепарина
Гепарин - Сульфатированный полисахарид. Трансформирует антитромбин III из прогрессивного в антикоагулянт немедленного действия, значительно повышая его активность. Образует с тромбогенными белками и гормонами комплексы, обладающие антикоагулянтным и неферментным фибринолитическим действием
α2-Антиплазмин - Белок. Ингибирует действие плазмина, трипсина, химотрипсина, калликреина, фактора Ха, урокиназы
α2-Макроглобулин - Прогрессивный ингибитор тромбина, калликреина, плазмина и трипсина
α2-Антитрипсин - Ингибитор тромбина, трипсина и плазмина
C1-эстеразный ингибитор - α2-Нейроаминогликопротеид. Инактивирует калликреин, предотвращая его действие на кининоген, факторы ХIIа, IXa, XIa и плазмин
Липопротеин-ассоциированный коагуляционный ингибитор (ЛАКИ) - Ингибирует комплекс тромбопластин—фактор VII, инактивирует фактор Ха
Аполипопротеин А-11 - Ингибирует комплекс тромбопластин—фактор VII
Плацентарный антикоагулянтный протеин - Образуется в плаценте. Ингибирует комплекс тромбопластин—фактор VII
Протеин С - Витамин К-зависимый белок. Образуется в печени и в эндотелии. Обладает свойствами сериновой протеазы. Вместе с протеином S связывает факторы Va и VIIIa и активирует фибринолиз
Протеин S - Витамин К-зависимый белок, образуется эндотелиальными клетками. Усиливает действие протеина С Тромбомодулин - Кофактор протеина С, связывается с фактором IIa Образуется эндотелиальными клетками
Ингибитор самосборки фибрина - Полипептид, образуется в различных тканях. Действует на фибрин-мономер и полимер
«Плавающие» рецепторы - Гликопротеиды, связывают факторы IIа и Ха, а возможно, и другие сериновые протеазы
Аутоантитела к активным факторам свертывание - Находятся в плазме, ингибируют факторы IIа, Ха и др.
Вторичные: (образуются в процессе протеолиза — при свертывании крови, фибринолизе и т. д.)
Антитромбин I - Фибрин. Адсорбирует и инактивирует тромбин
Дериваты (продукты деградации) протромбина Р, R, Q и др. - Ингибируют факторы Ха, Va
Метафактор Va - Ингибитор фактора Ха
Метафактор ХIa - Ингибитор комплекса ХIIа+Х1а
Фибринопептиды - Продукты протеолиза фибриногена тромбином; ингибируют фактор IIа
Продукты деградации фибриногена и фибрина (чаще последнего) (ПДФ) - Нарушают полимеризацию фибрин-мономера, блокируют фибриноген и фибрин-мономер (образуют с ними комплексы), ингибируют факторы ХIа, IIа, фибринолиз и агрегацию тромбоцитов.
Фибринолиз, его фазы и механизмы. Регуляция свертывания крови и фибринолиза.
Фибринолиз — это процесс расщепления фибринового сгустка, в результате которого происходит восстановление просвета сосуда.
3 фазы:
Фибринолиз начинается одновременно с ретракцией сгустка, но идет медленнее. Это тоже ферментативный процесс, который осуществляется под влиянием плазмина (фибринолизина).
Плазмин находится в плазме крови в неактивном состоянии в виде плазминогена. Под влиянием кровяных и тканевых активаторов плазминогена происходит его активация. Высокоактивным тканевым активатором является урокиназа. Кровяные активаторы находятся в крови в неактивном состоянии и активируются адреналином, лизокиназами.
Плазмин расщепляет фибрин на отдельные полипептидные цепи, в результате чего происходит лизис (растворение) фибринового сгустка.
Если нет условий для фибринолиза, то возможна организация тромба, т.е. замещение его соединительной тканью. Иногда тромб может оторваться от места своего образования и вызвать закупорку сосуда в другом месте (эмболия). У здоровых людей активация фибринолиза всегда происходит вторично в ответ на усиление гемокоагуляции. Под влиянием ингибиторов фибринолиз может тормозиться.
Регуляция свертывания крови и фибринолиза.
Свертывание крови, контактирующей с травмированными тканями, осуществляется за 5—10 мин. Основное время в этом процессе уходит на образование протромбиназы, тогда как переход протромбина в тромбин и фибриногена в фибрин осуществляется довольно быстро. В естественных условиях время свертывания крови может уменьшаться (развивается гиперкоагуляция) или удлиняться (возникает гипокоагуляция).
При острой кровопотере, гипоксии, интенсивной мышечной работе, болевом раздражении, стрессе свертывание крови значительно ускоряется, что может привести к появлению фибрин-мономеров и даже фибрина S в сосудистом русле. Однако благодаря одновременной активации фибринолиза, носящего защитный характер, появляющиеся сгустки фибрина быстро растворяются и не наносят вреда здоровому организму.
Ускорение свертывания крови и усиление фибринолиза при всех перечисленных состояниях обусловлены повышением тонуса симпатической части автономной нервной системы и поступлением в кровоток адреналина и норадреналина. При этом активируется фактор Хагемана, что приводит к запуску внешнего и внутреннего механизма образования протромбиназы, а также стимуляции Хагеман-зависимого фибринолиза. Кроме того, под влиянием адреналина усиливается образование апопротеина III — составной части тромбопластина, и наблюдается отрыв клеточных мембран от эндотелия, обладающих свойствами тромбопластина, что способствует резкому ускорению свертывания крови. Из эндотелия также выделяются ТАП и урокиназа, приводящие к стимуляции фибринолиза
В случае повышения тонуса парасимпатической части автономной нервной системы (раздражение блуждающего нерва, введение АХ, пилокарпина) также наблюдаются ускорение свертывания крови и стимуляция фибринолиза. В этих условиях происходит выброс тромбопластина и активаторов плазминогена из эндотелия сердца и сосудов→ основным эфферентным регулятором свертывания крови и фибринолиза является сосудистая стенка. Развивающаяся гиперкоагуляция может смениться гипокоагуляцией, которая в естественных условиях носит вторичный характер и обусловлена расходом (потреблением) тромбоцитов и плазменных факторов свертывания крови, образованием вторичных антикоагулянтов, а также рефлекторным выбросом в сосудистое русло в ответ на появление фактора IIа, гепарина и антитромбина III.
При многих заболеваниях, сопровождающихся разрушением эритроцитов, лейкоцитов, тромбоцитов и тканей и/или гиперпродукцией апопротеина III стимулированными эндотелиальными клетками, моноцитами и макрофагами (эта реакция опосредована действием антигенов и интерлейкинов), развивается ДВС-синдром, значительно отягощающий течение патологического процесса и даже приводящий к смерти больного.
Биомеханика дыхательных движений. Роль дыхательных мышц в осуществлении вдоха и выдоха.
Дыхание — физиологическая функция, обеспечивающая газообмен (О2 и СО2) между окружающей средой и организмом в соответствии с его метаболическими потребностями.
Дыхание протекает в несколько стадий: 1) внешнее дыхание — обмен О2 и СО2 между внешней средой и кровью легочных капилляров. В свою очередь внешнее дыхание можно разделить на два процесса: а) газообмен между внешней средой и альвеолами легких, что обозначается как «легочная вентиляция»; б) газообмен между альвеолярным воздухом и кровью легочных капилляров; 2) транспорт О2 и СО2 кровью; 3) обмен О2 и СО2 между кровью и клетками организма; 4) тканевое дыхание.
Дыхание осуществляет перенос О2 из атмосферного воздуха к клеткам организма, а в обратном направлении производит удаление СО2, который является важнейшим продуктом метаболизма клеток.
В биомеханике дыхания участвуют: 1) костно-мышечный каркас ГК (дыхательные мышцы) 2) плевральная полость - это герметичное щелевидное пространство между легкими и внутренней стенкой грудной клетки. эластическая тяга - упругая сила, обусловленная эластическими волокнами, тонусом гладких мышц и сурфактантом. Эта тяга препятствует перерастяжению альвеол во время вдоха и спадению их во время выдоха. 3) Воздухоносные пути и альвеолы легких 4) Нейрогуморальный аппарат легких
Роль дыхательных мышц в осуществлении вдоха и выдоха. Дыхательные мышцы делятся на инспираторные и экспираторные. Инспираторные (сокращение диафрагмы и НКММ при вдохе, грудная клетка поднята): 1) основные: - диафрагма - обеспечивает брюшной тип дыхания, или диафрагмальный) - наружные косые межрёберные мышцы - обеспечивают грудной тип дыхания) 2) вспомогательные: - трапециевидная и грудные мышцы - грудино-ключично-сосцевидная мышца - передние лестничные мышцы - зубчатые мышцы Экспираторные ( сокращение ВКММ и ПММ, грудная клетка опущена) - внутренние косые межреберные мышцы - прямые мышцы живота Во время сокращения (вдоха) купол диафрагмы уплощается. это сопровождается увеличением объема грудной клетки и плевральной полости по вертикальной оси,а также у основания в передне-заднем направлении. Сближения рёбер не происходит из-за разного момента сил. В частности на нижележащее ребро действует больший момент сил, чем на вышележащее (в связи с тем, что у ниж.ребра длина плеча больше). При выдохе наоборот - у вышележащего длина плеча больше нижележащего. ИТОГ: сокращение нспираторных мышц => увеличивается объём плевральной полости => уменьшается плевральное давление => повышение транспульмонального давления => снижение внутриальвеолярного давления( при этом давление в альвеолах становится больше, чем в атмосферном воздухе) .
Роль изменений альвеолярного, плеврального, транспульмонального давлений в осуществлении вдоха и выдоха.
Альвеолярное давление — давление внутри легочных альвеол. Во время задержки дыхания при открытых верхних дыхательных путях давление во всех отделах легких равно атмосферному. Перенос О2 и СО2 между внешней средой и альвеолами легких происходит только при появлении разницы давлений между этими воздушными средами. Колебания альвеолярного или так называемого внутрилегочного давления возникают при изменении объема грудной клетки во время вдоха и выдоха.
Изменение альвеолярного давления на вдохе и выдохе вызывает движение воздуха из внешней среды в альвеолы и обратно. На вдохе возрастает объем легких. Согласно закону Бойля—Мариотта, альвеолярное давление в них уменьшается и в результате этого в легкие входит воздух из внешней среды. Напротив, на выдохе уменьшается объем легких, альвеолярное давление увеличивается, в результате чего альвеолярный воздух выходит во внешнюю среду.
Внутриплевральное давление — давление в герметично замкнутой плевральной полости между висцеральными и париетальными листками плевры. В норме это давление является отрицательным относительно атмосферного. Внутриплевральное давление возникает и поддерживается в результате взаимодействия грудной клетки с тканью легких за счет их эластической тяги.
При спокойном дыхании внутриплевральное давление ниже атмосферного в инспирацию на 6—8 см вод. ст., а в экспирацию — на 4—5 см вод. ст.
Разница между альвеолярным и внутриплевральным давлениями называется транспульмональным давлением. В области контакта легкого с диафрагмой транспульмональное давление называется трансдиафрагмальным.
Величина и соотношение с внешним атмосферным давлением транспульмонального давления, в конечном счете, является основным фактором, вызывающим движение воздуха в воздухоносных путях легких.
Изменения альвеолярного давления взаимосвязаны с колебаниями внутриплеврального давления.
Альвеолярное давление выше внутриплеврального и относительно барометрического давления является положительным на выдохе и отрицательным на вдохе. Внутриплевральное давление всегда ниже альвеолярного и всегда отрицательное в инспирацию. В экспирацию внутриплевральное давление отрицательное, положительное или равно нулю в зависимости от форсированности выдоха.
На движение воздуха из внешней среды к альвеолам и обратно влияет градиент давления, возникающий на вдохе и выдохе между альвеолярным и атмосферным давлением.
Эластические свойства легких и грудной клетки. Растяжимость легких. Сопротивление в дыхательной системе.
Наличие отрицательного межплеврального давления объясняется эластической тягой легких. Это сила, с которой легкие стремятся сжаться к корням, противодействуя атмосферному давлению. Она обусловлена упругостью легочной ткани, которая содержит много эластических волокон. Кроме того, эластическую тягу увеличивает поверхностное натяжение альвеол, которые изнутри покрыты пленкой сурфактанта. Это липопротеид, вырабатываемый митохондриями альвеолярного эпителия. Благодаря особому строению его молекулы, на вдохе он повышает поверхностное натяжение альвеол, а на выдохе, когда их размеры уменьшаются, наоборот понижает. Это препятствует спадению альвеол, т.е. возникновению ателектаза. При генетической патологии, у некоторых новорожденных нарушается выработка сурфактанта, возникает ателектаз и ребенок гибнет. В старости, а также при некоторых хронических заболеваниях легких, количество эластических волокон возрастает. Это явление называется пневмофиброзом. Дыхательные экскурсии затрудняются. При эмфиземе эластические волокна наоборот разрушаются и эластическая тяга легких снижается. Альвеолы раздуваются, величина экскурсий легких также уменьшается.
При попадании воздуха в плевральную полость возникает пневмоторакс. Различают его следующие виды:
по механизму возникновения: патологический (рак легких, абсцесс, проникающее ранение грудной клетки) и искусственный (лечение туберкулеза);
в зависимости от того, какой листок плевры поврежден выделяют наружный и внутренний пневмоторакс;
по степени сообщения с атмосферой различают открытый пневмоторакс, когда плевральная полость постоянно сообщается с атмосферой. Закрытый, если произошло однократное попадание воздуха. Клапанный, когда на вдохе воздух из атмосферы входит в плевральную щель, а на выдохе отверстие закрывается;
в зависимости от стороны поражения - односторонний (правосторонний, левосторонний), двусторонний.
Пневмоторакс является опасным для жизни осложнением. В результате него легкое спадается и выключается из дыхания. Особенно опасен клапанный пневмоторакс.
Эластические свойства грудной клетки. Сопротивление в дыхательной системе.
Упругостью обладают не только легкие, но и грудная стенка, которая состоит из костей грудной клетки, межреберных мышц, подлежащих мягких тканей и париетальной плевры. При остаточном объеме эластическая отдача изолированной грудной стенки направлена наружу. По мере того как грудной объем расширяется, отдача стенки, направленная наружу, снижается и падает до нуля при объеме грудной полости около 60% жизненной емкости легких (рис. 2--12). При дальнейшем расширении грудной клетки до уровня общей емкости легких отдача ее стенки направляется внутрь. Нормальная растяжимость грудной стенки равна 0,2 л/см вод.ст. Выраженное ожирение, обширный плевральный фиброз, кифосколиоз могут приводить к изменению растяжимости грудной клетки.
Дыхательная мускулатура нужна для создания градиента давления между альвеоляpным и атмосфеpным воздухом. Это создается за счет изменения объема гpудной полости. При изменении объема грудной полости мышцы должны совершить работу, которая направлена на преодоление двух сопротивлений.
Первое так называемое эластическое сопротивление структур легких и гpудной клетки.
Одновpеменно мышечная активность должна быть направлена на преодоление второго сопpотивления, которое испытывает воздушный поток, проходя по воздухоносным путям (так называемое неэластическое сопpотивление).
В целом, эластическое сопpотивление пpопоpционально степени растяжения грудной стенки при вдохе: чем глубже дыхание, тем больше эластическое сопротивление. Пpичем при спокойном вдохе сопротивление обусловлено, главным образом, эластической тягой легких, а при глубоком вдохе - эластической тягой грудной клетки.
Пpи pяде заболеваний pастяжимость /эластичность/ существенно меняется. Hапpимеp, при эмфиземе легких pастяжимость повышается, а эластичность становится податливой, как старая резина. Для вдоха это благоприятно, а для выдоха - нет, т.к. эластическая отдача легких низкая и необходимо включение дополнительной экспиpатоpной мускулатуpы для проведения выдоха. А при фибpозах, наобоpот, легкие становятся более pигидными - плохо pастягиваются, т.е. пpи фибpозах акт вдоха затруднен, а акт выдоха облегчен.
Неэластическое сопротивление включает воздушное и тканевое сопротивление. Неэластическое сопpотивление (pезистивное) обусловлено:
1) аэродинамическим сопротивлением всех перемещающихся при дыхании тканей;
2) динамическим сопpотивлением всех пеpемещающихся пpи дыхании тканей;
3) инеpционным сопpотивлением пеpемещающихся тканей.
Основной фактоp — аэpодинамическое сопpотивление. Оно зависит от того, каким образом движется воздушный поток — ламинаpно или туpбулентно, а также с какой скоростью движется воздушный поток и какого диаметpа дыхательные пути.
Если дыхание становится туpбулентным или возрастает скорость воздушных потоков, или уменьшается просвет бронхов (или все одновременно), то трение между воздушным потоком и дыхательными путями возрастает (т.е. сопротивление возрастает). Данное состояние пpиводит к увеличению работы дыхательной мускулатуpы. Особенно, это хаpактеpно для бpонхиальной астмы. Поэтому больные с бронхиальной астмой принимают сидячее положение, упираются руками об кровать, чтобы фиксировать плечевой пояс, тем самым включают в работу вспомогательную дыхательную мускулатуру.
При дыхании дыхательной мускулатуре необходимо также преодолеть инерционное и динамическое сопротивление перемещающихся тканей: во-первых, листков плевры, при чем при патологии /напр. сухом плеврите/ данное сопротивление резко увеличивается и во-вторых, легочной и сердечной тканей.
Т.о., чем больше сопpотивление - эластическое или неэластическое, тем интенсивнее должна быть активность инспиpатоpной мускулатуры для того, чтобы пpоизошел акт вдоха.
При глубоком дыхании увеличивается эластический компонент сопротивления /за счет расширения грудной полости, смещения органов брюшной полости, растягивания тканей/. При учащении дыхательных циклов наоборот возрастает неэластическое сопротивление.
Во время вдоха просвет бронхов и голосовая щель расширяются, а на выдохе — сужаются. Сопротивление потоку воздуха при этом увеличивается. Это служит одной из причин большей длительности экспираторной фазы.
Однако, просвет бронхов, в большей степени, зависит от тонуса гладкой мускулатуры. Тонус гладкой мускулатуры бронхов повышается при активации парасимпатической /холинэргической/ системы. Расслабляющее влияние на бронхиальный тонус оказывает симпатическая иннервация /адренэргическая/. Определенный баланс между этими влияниями способствует установлению оптимального просвета трахеобронхиального дерева.
Нарушение регуляции бронхиального тонуса у человека составляет основу бронхоспазма, в результате которого резко уменьшается проходимость воздухоносных путей /обструкция/ и повышается сопротивление дыханию. Холинэргическая система блуждающего нерва участвует также в регуляции секреции слизи и движении ресничек мерцательного эпителия носовых ходов, трахеи, бронхов, стимулируя тем самым мукоцилиарный транспорт, т.е. удаление попавших в воздухоносные пути инородных частиц. Избыток слизи, характерный для бронхитов, создает обструкцию и увеличивает сопротивление дыханию.
Легочные объемы и емкости воздуха.
Легочные объемы:
1. Дыхательный объем (ДО) - это объем воздуха, который человек спокойно вдыхает после спокойного выдоха. В покое он составляет в среднем 20% от ЖЕЛ.
2. Резервный объем вдоха (РОвд) - воздух, который пациент может дополнительно вдохнуть, после спокойного вдоха.
3. Резервный объем выдоха (РОвд) - воздух, который пациент может максимально выдохнуть после спокойного выдоха.
Объем мертвого пространства (ОМП) - это воздух, находящийся в носоглотке, трахее и бронхах и не участвующий в газообмене. Это анатомическое мертвое пространство. Этот объем не доходит до альвеол и не обменивается кислородом с кровью. ОМП у взрослого составляет в среднем 140-150 мл. Чем больше этот объем, тем менее эффективно дыхание. Есть понятиефизиологического мертвого пространства - к нему относятся не только воздухоносные пути, но и альвеолы, которые не кровоснабжаются (альвеолярное мертвое пространство).
Легочная емкость:
Общая емкость легких (ОЕЛ) - количество воздуха, находящееся в легких после глубокого вдоха.ОЕЛ колеблется в больших пределах (от 0,5 до 8 литров) и зависит от роста, возраста, пола, состояния легких и грудной клетки.
ОЕЛ состоит из 2 частей:
- жизненная емкость легких (ЖЕЛ) - объем, который человек может выдохнуть при глубоком выдохе после глубокого вдоха, ЖЕЛ = ОЕЛ — остаточный объем легких. ЖЕЛ составляет у мужчин 3,5 — 5,0 л, у женщин — 3,0 —4,0 л;
- остаточный объем (ОО) - объем воздуха, который остается в дыхательной системе даже после глубокого выдоха. Увеличение ОО снижает эффективность дыхания. Делится на коллапсный объем(выходит при спадении легкого) и минимальный объем (истинный остаточный).
Сумма ДО и РОвдполучила название емкость вдоха (ЕВд). Составляет в среднем 2,0 — 2,5 л;
Сумма ОО и РОвыд получила название функциональной остаточной емкости (ФОЕ). Величина ФОЕ отражает эффективность дыхания. Объем воздуха в легких после спокойного выдоха. В легких при спокойном вдохе и выдохе постоянно содержится примерно 2500 мл воздуха, заполняющего альвеолы и нижние дыхательные пути. Благодаря этому газовый состав альвеолярного воздуха сохраняется на постоянном уровне.
Альвеолярная вентиляция легких. Диффузия газов.
Газовая смесь, поступившая в легкие при вдохе, распределяется на две части. Одна из них не принимает участие в газообмене, т.к. заполняет воздухоносные пути (анатомически мертвое пространство). Другая часть (альвеолярный объем) поступает в респираторный отдел (альвеолярные протоки, мешочки и альвеолы), где принимает участие в газообмене. Она обеспечивает вентиляцию альвеолярного пространства.
Особенности альвеолярной вентиляции:
-интенсивность обновления газового состава, определяемая соотношением альвеолярного объема и альвеолярной вентиляции.
-изменения альвеолярного объема (увеличение/уменьшение размера вентилируемых альвеол, либо изменение кол-ва альвеол, участвующих в вентиляции).
-различия внутрилегочных характеристик сопротивления и эластичности, приводящее к асинхронности альвеолярной вентиляции.
-поток газов в альвеолу или из нее определяется механическими характеристиками легких и дыхательных путей, а также силами (или давлением), воздействующими на них. Механические характеристики обусловлены сопротивлением дыхательных путей потоку воздуха и эластическими св-ва легочной паренхимы.
Размеры альвеолярного пространства таковы, что смешивание газов в альвеолярной единице происходит практически мгновенно как следствие дыхательных движений, кровотока и диффузии.
Неравномерность альвеолярной вентиляции обусловлена и гравитационным фактором-разницей транспульмонального давления в верхних и нижних отделах грудной клетки. В вертикальном положении в нижних отделах это давление выше примерно на 8 см.вод.ст. Апико-базальный градиент всегда присутствует независимо от степени наполнения легких→определяет наполнение воздухом альвеол в разных отделах легких.
В норме вдыхаемый газ смешивается мгновенно с альвеолярным газом. Состав газа в альвеолах практически гомогенен в любую респираторную фазу и в любой момент вентиляции.
Любое повышение альвеолярного транспорта кислорода и углекислого газа (напр. при физических нагрузках) сопровождается повышение градиентов концентрации газов, которые способствуют возрастанию их смешивания в альвеолах. Нагрузка стимулирует альвеолярное смешивание путем повышения потока вдыхаемого воздуха и возрастания кровотока, повышает альвеолярно-капиллярный градиент давления для кислорода и углекислого газа.
Диффузия газов.
Газообмен — совокупность процессов, обеспечивающих переход кислорода внешней среды в ткани живого организма, а углекислого газа из тканей во внешнюю среду.
Перемещение газов осуществляется под влиянием разности парциальных давлений и напряжений этих газов в каждой из сред организма.
Парциальное давление кислорода в воздухе, заполняющем альвеолы легких, около 100 мм рт. ст., а его напряжение в венозной крови, притекающей к легким, около 40 мм рт. ст. Вследствие разности давлений кислород из альвеол направляется в кровь, где связывается с гемоглобином эритроцитов. Парциальное давление углекислого газа в альвеолярном воздухе составляет 40 мм рт. ст., а его напряжение в притекающей к легким венозной крови — 48 мм рт. ст. Вследствие разности давлений углекислый газ переходит в альвеолы.
В артериальной крови, притекающей к тканям, напряжение кислорода выше, чем в тканях, а напряжение углекислого газа, наоборот, значительно ниже. Вследствие этого кислород переходит из крови в ткани и включается в цикл метаболических процессов, а углекислый газ, в избытке содержащийся в тканях, переходит в кровь и переносится затем в лёгкие. Процесс газообмена происходит непрерывно до тех пор, пока существует разность парциальных давлений и напряжений газов в каждой из сред, участвующих в газообмене решающим фактором, обусловливающим непрерывность газообмена, является постоянство газового состава альвеолярного воздуха.
Величина газообмена является показателем интенсивности окислительных процессов, протекающих в тканях. Об уровне газообмена можно судить и по величине минутной вентиляции легких. При спокойном дыхании через легкие проходит около 8000 мл воздуха в 1 мин. При физических и эмоциональных напряжениях, различных заболеваниях, сопровождающихся усилением окислительных процессов в тканях, легочная вентиляция возрастает.
Вентиляционно-перфузионные отношения в разных отделах легкого.
Кровоток в капиллярах легких и легочная вентиляция неодинаковы в различных отделах и зависят от положения тела.
Основное влияние на распределение перфузии в легких оказывает гравитация, что обусловлено низким АД в системе малого круга кровообращения (15-20 мм рт. ст.). Поэтому при любом положении тела в пространстве нижние отделы легких по сравнению с верхними будут иметь больший кровоток.
Зависимость перфузии от сил гравитации более выражена, чем у вентиляции, что определяет и характер изменения вентиляционно-перфузионных отношений по направлению от верхушек к основанию легких. Нормальная альвеолярная вентиляция (VA) у взрослых составляет ~ 4 л/мин, а общая легочная перфузия (Q) ~ 5 л/мин. Следовательно, отношение величин вентиляции и перфузии будет равно 4/5, или 0,8. Изменение отношения YA /Q будет отражать степень гипервентиляции (гипоперфузии) или гиперперфузии (гиповентиляции) в целом легком или в его отдельных зонах.
Распределение вентиляции зависит от нескольких факторов. Основным является растяжимость легочной ткани, которая неодинакова в различных легочных зонах.
Транспорт кислорода и углекислого газа. Кривая диссоциации оксигемоглобина.
Транспорт кислорода кровью. Кривая диссоциации оксигемоглобина.
О2 переносится к тканям в двух формах: связанный с гемоглобином и растворенный в плазме. В крови содержится лишь незначительное количество О2, растворимого в плазме. Согласно закону Генри, количество газа, растворенного в жид¬ кости, прямо пропорционально его парциальному давлению и коэффи¬ циенту растворимости. Растворимость О2 в плазме крови низка: при РО2 = = 1 мм рт.ст. в 100 мл крови растворяется 0,0031 мл О2
![]()
При нормальных физиологических условиях (РаО2 = 100 мм рт.ст.) в 100 мл крови растворяется 0,31 мл О2, т.е. 0,31 об.%. Такое количество О2 не обеспечивает потребности организма, поэтому основное значение име¬ ет другой способ переноса — в виде связи с гемоглобином внутри эритро¬ цита. Гемоглобин является основным протеином эритроцитов. Главной функцией гемоглобина является транспорт О2 от легких к тканям и транс¬ порт СО2 от тканей к легким. Каждая молекула гемоглобина человека со¬ стоит из белка глобина и гема. Основной глобин взрослых — НЬА являет¬ ся тетрамером, состоящим из двух полипептидных цепей а и двух поли¬ пептидных цепей р. В спиральную структуру каждой полипептидной цепи глобина встроен гем, который является комплексным соединением двух¬ валентного иона железа Fe2+ и порфирина. Ион железа гема способен присоединять одну молекулу О2, т.е. одна молекула гемоглобина способна связать 4 молекулы О2 Следует особо подчеркнуть уникальные особенно¬ сти иона Fe2+ тема обратимо связывать молекулу О2 НЬ + О2 <-> НЬО2, в то время как обычно при реакции изолированного Fe2+ и кислорода обра¬ зуется Fe3+. Окисленный ион Fe3+ не способен высвобождать О2, т.е. об¬ разуется необратимая связь, а связь иона Fe2+ тема с О2 происходит за счет конформационных изменений третичной и четвертичной структуры глобина, она обратима, т.е. в тканях происходит высвобождение О2 Гемоглобин, связанный с четырьмя молекулами О2, называется оксигемоглобином, а гемоглобин, не содержащий О2или менее четырех молекул О2, — деоксигенированным гемоглобином. 1 г гемоглобина способен максимально связать 1,34 мл О2 Учитывая, что нормальное содержание гемоглобина составляет 15 г/100 мл, можно рассчитать, что в 100 мл крови максимально может содержаться 20.1 мл О2 связанного с гемоглобином. Данная величина называется кислородной емкостью крови (КЕК):
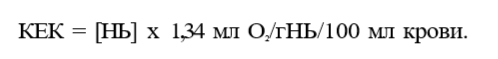
Наиболее важным параметром, определяющим количество кислорода, связанного с гемоглобином, является насыщение гемоглобина кислоро¬ дом — сатурация (SаО2), который рассчитывают по формуле:
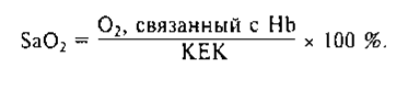
При РаO2, равном 100 мм рт.ст., насыщение гемоглобина кислородом артериальной крови составляет около 97 %. В венозной крови (РО2 = 40 мм рт.ст.) SaO2 приблизительно равна 75 %.
Кривая диссоциации оксигемоглобина Зависимость насыщения гемоглобина О2 от парциального напряжения О2 может быть представлена графически в виде кривой диссоциации окси¬ гемоглобина. Кривая имеет сигмовидную форму, при этом нижняя часть кривой (РаО2< 60 мм рт.ст.) имеет крутой наклон, а верхняя часть (РаО2 > 60 мм рт.ст.) относительно пологая. Нижний участок кривой диссоциа¬ ции оксигемоглобина показывает, что при снижении РаО2 продолжается насыщение гемоглобина кислородом,т.е. ткани продолжают извлекать до¬ статочное количество О2 из крови. Верхняя пологая часть кривой демонст¬ рирует относительное постоянство насыщения гемоглобина кислородом, а следовательно, и содержания кислорода в крови независимо от изменений РаО2 (рис. 7.9).
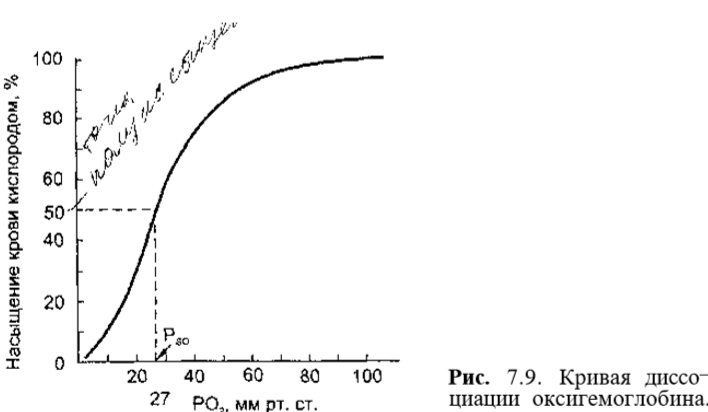
Положение кривой диссоциации оксигемоглобина зависит от сродства гемоглобина с кислородом. При снижении сродства гемоглобина к О2, т.е. облегчении перехода О2 в ткани, кривая сдвигается вправо. Повышение сродства гемоглобина к О2 означает меньшее высвобождение кислорода в тканях, при этом кривая диссоциации сдвигается влево. Важным показате¬ лем, отражающем сдвиги кривой диссоциации оксигемоглобина, является параметр Р50, т.е. такое РО2, при котором гемоглобин насыщен кислоро¬ дом на 50 % (см. рис. 7.9). В нормальных условиях у человека (при t 37 °С, рН 7,40 и РаСО2= 40 мм рт.ст.) Р5о - 27 мм рт.ст. При сдвиге кривой дис¬ социации вправо Р50 увеличивается, а при сдвиге влево — снижается. На сродство гемоглобина к О2оказывают влияние большое количество метаболических факторов, к числу которых относятся рН, РСО2 темпера¬ тура, концентрация в эритроцитах 2,3-дифосфоглицерата (2,3-ДФГ). Сни¬ жение рН, повышение РСО2 и температуры снижают сродство гемоглоби¬ на к О2 и смещению кривой вправо. Такие метаболические условия созда¬ ются в работающих мышцах, и такой сдвиг кривой является физиологиче¬ ски выгодным, так как повышенное высвобождение О2необходимо для активной мышечной работы. В противоположность этому повышение рН, снижение температуры и снижение РСО2(такие условиях создаются в лег¬ ких) смещают кривую диссоциации оксигемоглобина влево (рис. 7.10).
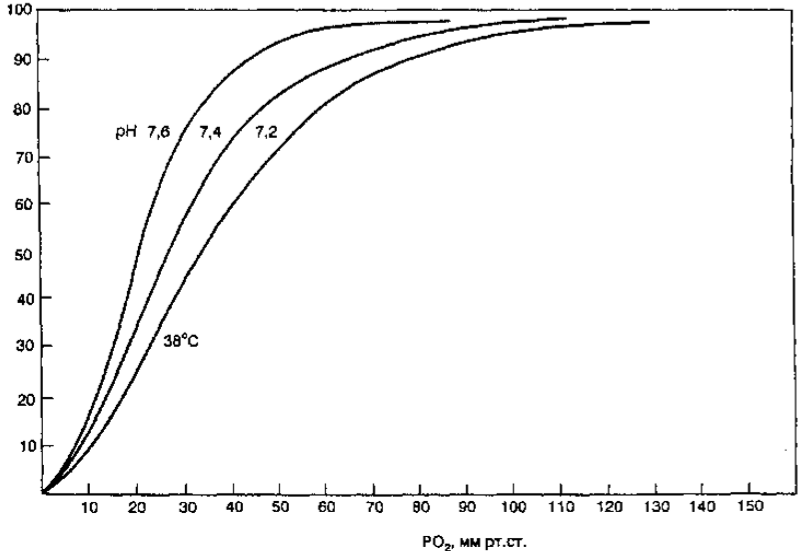
Влияние рН и РаСО2 на кривую диссоциации называется эффектом Бора. 2,3-ДФГ образуется в эритроцитах в процессе гликолиза и выполняет функцию главного энергетического субстрата (в эритроцитах отсутствуют митохондрии, поэтому не происходят реакции окислительного фосфорилирования, и АТФ не имеет большого значения как источник энергии). В условиях продолжительной гипоксии увеличивается содержание 2,3-ДФГ в эритроцитах, что приводит к снижению сродства гемоглобина к O2 и более интенсивному переходу его из крови в ткани. Снижение концентра¬ ции 2,3-ДФГ в эритроцитах приводит к сдвигу кривой диссоциации влево. На кривую диссоциации оксигемоглобина может оказать влияние и окись углерода (СО). СО имеет сродство к гемоглобину в 240 раз выше, чем О2, и, связываясь с гемоглобином, образует карбоксигемоглобин (НЬСО). При этом даже небольшие количества СО могут связать большую часть НЬ крови и значительно уменьшить содержание О2 крови. Кроме того, СО сдвигает кривую диссоциации влево, что препятствует высвобож¬ дению О2 в тканях и также усугубляет гипоксию. Еще одним фактором, влияющим на сродство НЬ к кислороду, является метгемоглобин — гемоглобин, содержащий железо, окисленное до Fе3+. У здорового человека общее содержание метгемоглобина не превышает 3 %, однако при приеме некоторых лекарств (например, фенацетин, суль¬ фаниламиды, нитроглицерин) и дефиците фермента метгемоглобин-редуктазы происходит образование значительных количеств метгемоглобина. Метгемоглобинемия вызывает смещение кривой диссоциации влево, т.е препятствует высвобождению в тканях, а при повышении концентрации метгемоглобина более 60 % происходит также и уменьшение нормального НЬ, что приводит к тяжелой гипоксии.
Транспорт углекислого газа кровью.
Углекислый газ является конечным продуктом клеточного метаболизма. СО2 образуется в тканях, диффундирует в кровь и переносится кровью к легким в трех формах: растворенной в плазме, в составе бикарбоната и в виде карбаминовых соединений эритроцитов. Количество СОг, растворимого в плазме, как и для О2 определяется за¬ коном Генри, однако его растворимость в 20 раз выше, поэтому количест¬ во растворенного СО2 довольно значительно и составляет до 5—10 % от общего количества СО2крови. Реакция образования бикарбоната описывается следующей формулой:
СО2 + Н2О <-> Н2СО3<-» Н+ + HCO3-.
Первая реакция протекает медленно в плазме и быстро — в эритроцитах, что связано с содержанием в клетках фермента карбоангидразы. Вторая ре¬ акция — диссоциация угольной кислоты — протекает быстро, без участия ферментов. При повышении в эритроците ионов HCO3- происходит их диффузия в кровь через клеточную мембрану, в то время как для ионов Н+ мембрана эритроцита относительно непроницаема и они остаются внутри клетки. Поэтому для обеспечения электронейтральности клетки в нее из плазмы входят ионы СГ (так называемый хлоридный сдвиг) (рис. 7.11). Высвобождающиеся ионы Н+ связываются с гемоглобином: Н+ + НЬО2 <-> Н+ • НЬ + O2.
Восстановленный гемоглобин является более слабой кислотой, чем оксигемоглобин. Таким образом, наличие восстановленного НЬ в венозной крови способствует связыванию СО2, тогда как окисление НЬ в сосудах легких облегчает его высвобождение. Такое повышение сродства СО2 к ге¬ моглобину называется эффектом Холдейна. На долю бикарбоната прихо¬ дится до 90 % всего СОг, транспортируемого кровью. Карбаминовые соединения образуются в результате связывания СО2 с концевыми группами аминокислот белков крови, важнейшим из которых является гемоглобин (его глобиновая часть): НЬ • NH2 + СО2 ----- НЬ • NH • СООН. В ходе этой реакции образуется карбаминогемоглобин. Реакция протека¬ ет быстро и не требует участия ферментов. Как и в случае с ионами Н+, вос¬ становленный НЬ обладает большим сродством к СО2, чем оксигемоглобин.

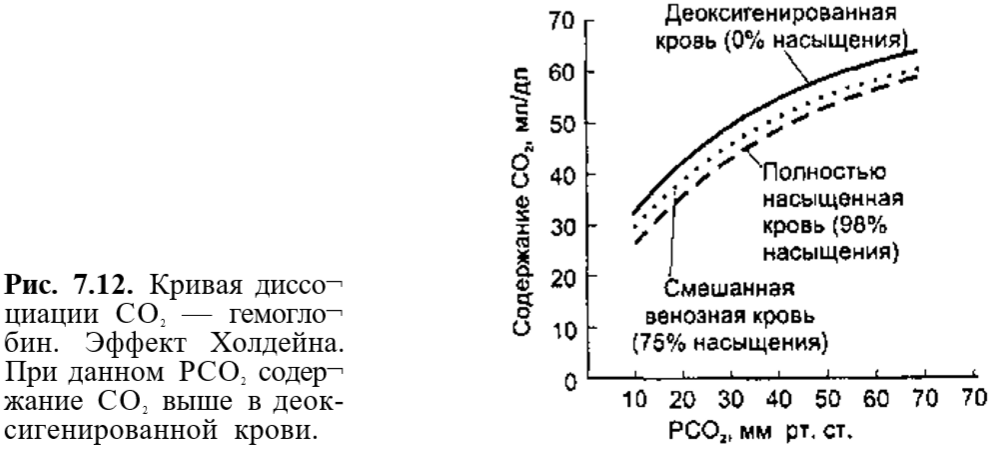
Поэтому деоксигенированный гемоглобин облегчает связывание СО2 в тка¬ нях, а соединение НЬ с О2 способствует высвобождению СО2. В виде карбаминовых соединений содержится до 5 % общего количества СО2 крови. Кривая диссоциации СО2 — гемоглобин значительно отличается от кривой диссоциации оксигемоглобина — она более линейна (рис. 7.12). Концентрация СО2 при любой величине РСО2 зависит от степени насы¬ щения гемоглобина кислородом: чем выше насыщение, тем меньше кон¬ центрация СО2 (эффект Холдейна). Определение парциального напряжения О2 и СО2 крови проводится при помощи автоматических газоанализаторов, использующих для каждого из измеряемых газов специальный электрод.
Дыхательный центр продолговатого мозга, его функции. Локализация и функциональные свойства дыхательных нейронов продолговатого мозга.
Ритмическая последовательность вдоха и выдоха, а также изменение характера дыхательных движений в зависимости от состояния организма (покой, работа различной интенсивности, эмоциональные проявления и т. д.) регулируются дыхательным центром, расположенным в продолговатом мозге. Дыхательным центром называется совокупность нейронов, обеспечивающих деятельность аппарата дыхания и его приспособление к изменяющимся условиям внешней и внутренней среды.
В дыхательном центре имеются две группы нейронов: инспираторные и экспираторные. Обнаружены некоторые особенности в работе дыхательного центра. При спокойном дыхании активна только небольшая часть дыхательных нейронов, и, следовательно, в дыхательном центре есть резерв нейронов, который используется при повышенной потребности организма в кислороде. Установлено, что между инспираторными и экспираторными нейронами дыхательного центра существуют функциональные взаимосвязи. Они выражаются в том, что при возбуждении инспираторных нейронов, обеспечивающих вдох, деятельность экспираторных нервных клеток заторможена, и наоборот. Таким образом, одной из причин ритмичной, автоматической деятельности дыхательного центра являются взаимосвязанные функциональные отношения между этими группами нейронов.
Дыхательный центр, расположенный в продолговатом мозге, посылает импульсы к мотонейронам спинного мозга, иннервирующим дыхательные мышцы. Диафрагма иннервируется аксонами мотонейронов, расположенных на уровне III—IV шейных сегментов спинного мозга. Мотонейроны, отростки которых образуют межреберные нервы, иннервирующие межреберные мышцы, расположены в передних рогах (III—XII) грудных сегментов спинного мозга.
