
- •Вопросы для подготовки к экзамену
- •Виды хеморецепторов
- •Симпатический и парасимпатический отделы и их различия
- •Функции
- •Функции
- •Функции ретикулярной формации
- •Основные ритмы на ээг
- •Альфа-ритм
- •Бета-ритм
- •Дельта-ритм
- •Тета-ритм
- •Симпатическую
- •Парасимпатическую
- •Метасимпатическую
- •Стволовые центры
- •Гипоталамические центры
- •Общие свойства нервных центров
- •I. По характеру психической активности:
- •По характеру целесообразности деятельности:
- •III. По использованию дополнительных средств:
- •IV. По продолжительности сохранения материала:
- •V. По участию наследственных механизмов:
- •Внешний и внутренний гемостаз
- •Регуляция деятельности дыхательного центра
- •Выделение слюны по механизму условного рефлекса
Выделение слюны по механизму условного рефлекса
Слюна выделяемая по условно-рефлекторному механизму называется «запальной». Она выделяется на вид, запах, время и другие сигналы (стимулы).
Используются дистантная рецепция:
Обонятельная (хеморецептроры)
Зрительная
Выделение слюны наступает ещё до поступления пищи в рот при действии различных раздражителей, сочетающихся заранее с приемом пищи.
Саливация возможна даже при мысли о приеме пищи («слюнки текут»).
Условные сигналы, эмоции могут затормозить саливацию.

Глотание, его фазы глотания. Продвижение пищевого комка из ротовой полости в желудок.
Глотание — перевод пищевого комка из полости рта в желудок. Человек среднем совершает за сутки 600 глотаний, 200 из которых производятся о время еды. Глотание имеет рефлекторный механизм и возникает в результате раздражения чувствительных окончаний тройничных, гортанных языкоглоточных нервов. По их афферентным волокнам импульсы поступают в продолговатый мозг, в котором расположен центр глотания. От его импульсы по эфферентным двигательным волокнам тройничного, языкоглоточного, подъязычного и блуждающего нервов достигают мышц, обеспечивающих глотание. Доказательством рефлекторного характера глотания служит то, что если выключить рецепторы корня языка и глотки, обработав их раствором кокаина, то глотание не осуществится. Организация деятельности бульбарного центра глотания координируется двигательными центрами среднего мозга, коры большого мозга и находится в тесной связи с центром дыхания, тормозя его при глотании, что предотвращает попадание пищи в воздухоносные пути.
Глотание состоит из трех последовательных фаз: 1 — ротовой (произвольная), 2 — глоточной (быстрая, короткая непроизвольная), 3 — пищеводной (медленная, длительная непроизвольная).
Во время первой фазы из пищевой пережеванной массы во рту формируется пищевой комок объемом 5—15 см\ который движениями языка перемещается на его спинку. Произвольными сокращениями передней части языка пищевой комок прижимается к твердому небу, затем переводится на корень языка за передние дужки.
Во время второй фазы раздражения рецепторов корня языка рефлектор-но вызывают сокращение мыщц, приподнимающих мягкое небо, что препятствует попаданию пищи в полость носа. Движения языка проталкивают пищевой комок в глотку. Одновременно сокращаются мышцы, смещающие подъязычную кость и вызывающие поднятие гортани, вследствие чего закрывается вход в дыхательные пути, что препятствует поступлению в них пищи. Переводу ее в глотку способствует повышение давления в полости рта и снижение давления в глотке. Препятствуют обратному движению пищи в ротовую полость поднявшийся корень языка и прилегающие к нему дужки. Вслед за поступлением пищи в глотку сокращаются мышцы, суживающие ее просвет выше пищевого комка, вследствие чего он продвигается в пищевод.
Перед глотанием глоточно-пищеводный сфинктер закрыт, во время глотания давление в глотке повышается до 45 мм рт.ст. и через открывшийся сфинктер пищевой комок поступает в начало пищевода, где давление не более 30 мм рт.ст. Вторую фазу глотания нельзя выполнить произвольно, если в полости рта нет пищи, жидкости или слюны. Если раздражать корень языка, то произойдет глотание, которое произвольно остановить нельзя. Две фазы акта глотания длятся около 1 с.
Третью фазу глотания составляют прохождение пищи по пищеводу и перевод ее в желудок сокращениями пищевода. Движения пищевода вызываются рефлекторно при каждом глотательном акте. Продолжительность третьей фазы при глотании твердой пищи 8—9 с, жидкой 1—2 с. В момент глотания пищевод подтягивается к зеву и начальная его часть расширяется, принимая пищевой комок. Сокращения пищевода имеют характер волны, возникающей в верхней его части и распространяющейся в сторону желудка (перистальтические сокращения). При этом последовательно сокращаются кольцеобразно расположенные мыщцы пищевода, передвигая перетяжкой пищевой комок. Перед ним движется волна пониженного тонуса пищевода (релаксационная). Средняя скорость перистальтической волны 2—4 см/с. По мере продвижения ее к желудку давление в полости пищевода нарастает до 50—70 мм рт.ст. Глотание твердой пищи повышает давление в большей мере, чем жидкой.
Секреторная функция желудка. Состав и функции желудочного сока. Регуляция секреции желудочного сока.
Секреторная функция желудка. Состав и функции желудочного сока.
Секреторная функция - совокупность процессов, обеспечивающих образование и выделение железистой клеткой специфического секрета. Общий объем секрета ЖКТ составляет 6-8 л/сут, большая часть его всасывается обратно.
Желудочный сок продуцируется железами желудка, расположенными в его слизистой оболочке. Она покрыта слоем цилиндрического эпителия, клетки которого секретируют слизь и слабощелочную жидкость. Слизь секретируется в виде густого геля, который покрывает равномерным слоем всю слизистую оболочку.
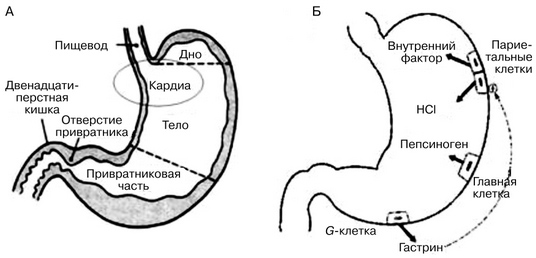
На поверхности слизистой оболочки видны мелкие впадинки — желудочные ямки, общее количество которых достигает 3 млн. В каждую из них открываются просветы 3-7 трубчатых желудочных желез. Различают три вида желудочных желез:
собственные железы желудка - располагаются в области тела и дна желудка (фундальные). Фундальные железы состоят из трех основных типов клеток: главные - секретирующие пепсиногены, обкладочные (париетальные) — соляную кислоту и добавочные — мукоидный секрет слизь (рис. 1);
кардиальные железы - расположены в кардиальном отделе желудка; это трубчатые железы, состоящие в основном из клеток, продуцирующих слизь;
пилорические железы - расположены в пилорическом отделе желудка. Они практически не имеют обкладочных клеток и выделяют небольшое количество секрета, не стимулируемое приемом пищи.
Желудочно-кишечные эндокриноциты (endocrinocyti gastrointestinales). В желудке по морфологическим, биохимическим и функциональным признакам выделено несколько видов эндокринных клеток.
EC-клетки (энтерохромаффинные) — самые многочисленные, располагаются в области тела и дна желез между главными клетками. Эти клетки секретируют серотонин и мелатонин. Серотонин стимулирует секрецию пищеварительных ферментов, выделение слизи, двигательную активность. Мелатонин регулирует фотопериодичность функциональной активности (т.е. зависит от действия светового цикла). G-клетки(гастринпродуцируюшие) также многочисленны и находятся главным образом в пилорических железах, а также в кардиальных, располагаясь в области их тела и дна, иногда шейки. Выделяемый ими гастрин стимулирует секрецию пепсиногена главными клетками, соляной кислоты — париетальными клетками, а также стимулирует моторику желудка. При гиперсекреции желудочного сока у человека отмечается увеличение числа G-клеток. Кроме гастрина, эти клетки выделяют энкефалин, являющийся одним из эндогенных морфинов. Ему приписывают роль медиации боли. Менее многочисленными являются Р-, ECL-, D-, D1-, А- и Х-клетки. Р-клетки секретируют бомбезин, стимулирующий выделение соляной кислоты и панкреатического сока, богатого ферментами, а также усиливают сокращение гладкой мускулатуры желчного пузыря.ECL-клетки (энтерохромаффиноподобные) характеризуются разнообразием формы и располагаются главным образом в теле и дне фундальных желез. Эти клетки вырабатывают гистамин, который регулирует секреторную активность париетальных клеток, выделяющих хлориды. D- и D1-клетки выявляются главным образом в пилорических железах. Они являются продуцентами активных полипептидов. D-клеткивыделяют соматостатин, ингибирующий синтез белка. D1-клетки секретируют вазоинтестинальный пептид (ВИП), который расширяет кровеносные сосуды и снижает артериальное давление, а также стимулирует выделение гормонов поджелудочной железы. A-клетки синтезируют глюкагон, т.е. имеют сходную функцию с эндокринными А-клетками островков поджелудочной железы.
Регуляция секреции желудочного сока.
Железы желудка в состоянии относительного покоя (в условиях отсутствия процесса пищеварения) выделяют небольшое количество сока нейтральной или слабощелочной реакции (фоновая секреция). Под влиянием пищевого раздражения во время приема пищи железы желудка секретируют значительный объем желудочного сока, богатого протеолитическими ферментами. Эта реакция желез является рефлекторным ответом на раздражение пищей рецепторов слизистой оболочки ротовой полости, глотки и желудка (безусловный рефлекс) и воздействие комплекса раздражителей, влияющих на другие рецепторы, предшествующих и сопутствующих приему пищи (условный рефлекс).
Афферентные импульсы с раздражаемых пищей рецепторов (тактильных, температурных и вкусовых) по афферентным волокнам V, VII, IX и X черепно-мозговых нервов передаются в бульбарный, таламический, гипо-таламический и корковый отделы пищевого центра. Нисходящие влияния коркового представительства пищевого центра активируют парасимпатические и симпатические ядра гипоталамуса. При возбуждении парасимпатических ядер их эфферентные влияния активируют клетки бульбарного отдела пищевого центра, импульсы от которых по преганглионарным волокнам блуждающего нерва передаются на постганглионарные нейроны ин-трамуральных ганглиев желудка (клетки Догеля I типа). Выделяемый в окончаниях их аксонов медиатор ацетилхолин через М-холинорецепторы мембраны гландулоцитов стимулирует секреторную деятельность главных, обкладочных и мукоидных клеток желез желудка. Поэтому после перерезки блуждающих нервов у собак не выделяется желудочный сок при раздражении пищей рецепторов полости рта, на ее вид и запах.
Ацетилхолин активирует также эндокринные У-клетки слизистой оболочки антрального отдела желудка, вырабатывающие гастрин, который через кровоток достигает обкладочных клеток желез и через специальные рецепторы их мембраны вызывает выработку соляной кислоты.
Ацетилхолин и гастрин в слизистой оболочке фундального отдела желудка стимулируют активность эндокринных клеток, выделяющих гиста-мин, который, диффундируя по межклеточным пространствам, через Н2-рецепторы мембраны обкладочных клеток стимулирует выработку большого количества кислого желудочного сока, бедного ферментами и мукоида-ми. После перерезки блуждающих нервов (в экспериментах на животных) сокогонный эффект ацетилхолина, гастрина и гистамина резко ослабляется.
Поступление пищи в желудок во время еды усиливает безусловно-рефлекторное отделение желудочного сока, что обусловлено раздражением механорецепторов при растяжении его стенок (особенно антрального отдела) и хеморецепторов пептидами и экстрактивными веществами пищи. При этом рефлекс осуществляется с участием бульбарного отдела пищевого центра, дополняется местной реакцией, реализуемой через холинергиче-ские нейроны интраорганной нервной системы.
Увеличение концентрации соляной кислоты в желудочном соке приводит к угнетению выработки гастрина У-клетками и последующим уменьшением кислотности сока. Этот механизм саморегуляции предотвращает избыточное выделение соляной кислоты. Подавляют секрецию соляной кислоты соматостатин, ВИП и серотонин
При возбуждении симпатических ядер гипоталамуса его нисходящие влияния стимулируют преганглионарные симпатические нейроны боковых рогов торакальных сегментов (IV—X) спинного мозга. Их эфферентные влияния стимулируют постганглионарные нейроны симпатических ганглиев, аксоны которых в составе чревных нервов достигают желез желудка. Выделяющийся в их окончаниях медиатор норадреналин тормозит секрецию желудочного сока, но приводит к накоплению секреторного материала в гландулоцитах, содержащих пепсиногены и мукоиды.
В процессе пищеварения можно выделить 3 фазы желудочной секреции:
1.мозговая (сложно-рефлекторная);её хорошо изучил И.П.Павлов в опытах на собаках с мнимым кормлением, когда животных дразнили пищей. Эта фаза имеет место и у человека, когда желудочный сок выделяется при упоминании о пище, а самого приема пищи нет, т.е.нет раздражения рецепторов полости рта. Фаза длится 5-10 минут.
2.желудочная (нейрогуморальная) фаза – при соприкосновении пищи со слизистой желудка. При этом больше сока выделяется на употребление мяса, печени, алкоголя. В среднем фаза секреции продолжается 3-4 часа в зависимости от времени нахождения пищи в желудке (при жирной пище = 5-6 часов).
3.кишечная (гуморально-химическая) фаза – секреция желудочного сока продолжается и во время перехода пищевых веществ из желудка в кишечник. Эта фаза отличается большой продолжительностью секреции – до 6-8 часов.
Моторная деятельность желудка. Виды моторики желудка. Регуляция моторики желудка.
Моторная деятельность желудка.
Прием пищи приводит к рефлекторному расслаблению стенок желудка, что способствует депонированию пищевого комка в полости желудка и транспорту желудочного сока
Она способствует перемешиванию пищевого комка с желудочным соком и перемещением содержимого желудка в двенадцатиперсную кишку.
Моторная деятельность обеспечивается гладкой мускулатурой.
Виды моторики желудка, их характеристика.
Вне пищеварения происходит периодическая моторная деятельность, которая совпадает с периодической секреторной деятельностью. Это голодовые сокращения желудка.
При пищеварении - 4 вида моторики:
перистальтика;
тонические сокращения;
антральная систола;
антиперистальтика.
Перистальтика - сокращение круговых мышц желудка, идет от кардиальной части желудка к пилорической. Скорость распространения равна 1см/сек - в кардиальной части; 3-4 см/сек - в пилорической части. Обеспечивает продвижение пищи по желудку.
Тонические сокращения - неперистальтические сокращения, которые проявляются изменением тонуса мышц желудка. При повышении тонуса объем желудка уменьшается и давление внутри него увеличивается. Это способствует эвакуации. И наоборот.
Антральная систола - сокращение пилорической части желудка - эвакуация пищи из желудка в ДПК.
Антиперистальтика - волна перистальтического сокращения, направленная от пилорической части к кардиальной (при рвоте).
Регуляция моторики желудка.
Раздражение блуждающих нервови выделение АХ усиливают моторику желудка: увеличивают ритм и силу сокращений, ускоряют движение перистальтических волн. Влияния блуждающих нервов могут оказывать и тормозной эффект: рецептивная релаксация желудка, снижение тонуса пилорического сфинктера.
Раздражение симпатических нервови активация α‑адренорецепторов тормозят моторику желудка: уменьшают ритм и силу его сокращений, скорость движения перистальтической волны.
Описаны и стимулирующие α‑ и β‑адренорецепторные влияния (например, на пилорический сфинктер). Двунаправленные влияния осуществляются пептидергическими нейронами. Названные типы влияний осуществляются рефлекторно при раздражении рецепторов рта, пищевода, желудка, тонкой и толстой кишки.
Замыкание рефлекторных дуг осуществляется на различных уровнях ЦНС, в периферических симпатических ганглиях и интрамуральной нервной системе.
В регуляции моторики желудка велико значение гастроинтестиналъных гормонов.Моторику желудка усиливают гастрин, мотилин, серотонин, инсулин, а тормозят — секретин, ХЦК, глюкагон, ЖИП, ВИП. Механизм их влияний на моторику прямой (непосредственно на мышечные пучки и миоциты) и опосредованный через интрамуральные нейроны.
Моторика желудка зависит от уровня его кровоснабжения и сама влияет на него, изменяя сопротивление кровотоку при сокращениях желудка.
Секреция поджелудочной железы. Состав и свойства поджелудочного сока.
Основную массу поджелудочной железы (80—85%) составляют экзокринные элементы, среди которых 80—95 % приходится на ацинозные (ацинарные) клетки; эти клетки секретируют ферменты (и небольшое количество неферментных белков); центроацинозные и протоковые клетки секретируют воду, электролиты, слизь; из протоков компоненты смешанного секрета частично реабсорбируются.
Поджелудочная железа человека натощак выделяет небольшое количество секрета.
Сок представляет собой бесцветную прозрачную жидкость со средним содержанием воды 987 г/л. Щелочная среда сока (рН 7,5—8,8) обусловлена наличием в нем гидрокарбонатов (до 150 ммоль/л). Концентрация гидрокарбонатов в соке изменяется прямо пропорционально скорости секреции. Гидрокарбонаты сока поджелудочной железы участвуют в нейтрализации и ощелачивании кислого пищевого содержимого желудка в двенадцатиперстной кишке. В соке отмечается значительная концентрация белка, основную часть которого составляют ферменты.
Сок поджелудочной железы богат ферментами, которые синтезируются в ацинозных панкреоцитах. Ферменты поджелудочного сока переваривают все виды питательных веществ. Амилаза, липаза и нуклеаза секретируются поджелудочной железой в активном состоянии, а протеазы — в виде зимогенов.
Трипсиноген сока поджелудочной железы в двенадцатиперстной кишке под действием ее фермента энтерокиназы превращается в трипсин. Активация состоит в отщеплении от трипсиногена гексапепти-да под действием энтерокиназы и трипсина при рН 6,8—8,0. Процесс ускоряется в присутствии ионов Са2+.
Химотрипсиноген активируется трипсином. Трипсин и химотрипсин (а также панкреатопептидаза, или эластаза) расщепляют преимущественно внутренние пептидные связи белков. Эти ферменты действуют и на высокомолекулярные полипептиды, в результате чего образуются низкомолекулярные пептиды и аминокислоты. В составе сока поджелудочной железы выделяется некоторое количество ингибитора трипсина.
Поджелудочная железа синтезирует прокарбоксипептидазы А и В, проэластазы и профосфолипазу. Они активируются трипсином с образованием соответствующих ферментов: карбоксипепти-даз А и В, эластаз и фосфолипазы.
Сок поджелудочной железы богат а-амилазой, расщепляющей полисахариды до ди- и моносахаридов. На производные нуклеиновых кислот действуют рибо- и дезоксирибонуклеазы. Панкреатическая липаза расщепляет жиры, в основном триглицериды, до моноглицеридов и жирных кислот. На липиды действуют также фосфолипаза А2 и эстераза.
Поджелудочная железа секретирует профермент — панкреатическую фосфолипазу, которая активируется трипсином. Поскольку триглицериды нерастворимы в воде, липаза действует только на поверхности жира. Чем больше суммарная площадь поверхности контакта жира и липазы, тем активнее идет его гидролиз. Поэтому эмульгирование жира имеет огромное значение для его переваривания. Эмульгирование обеспечивается желчью, точнее — ее желчными кислотами и их солями. Размеры частиц жира 0,2—5,0 мкм. Активность липазы повышает также фермент колипаза. Она связывается с липазой в присутствии желчных солей и снижает оптимум рН действия фермента с 9 до 6—7, а также способствует адсорбции липазы на слизистой оболочке кишки.
Повышают активность липазы присутствие и ионов Са2+. Под действием липаз осуществляется обычно неполный гидролиз триглицеридов; при этом образуется смесь из моноглицеридов (около 50 %), жирных кислот и глицерина (40 %), ди- и триглицеридов (3-10%).
Фазы секреции поджелудочной железы. Влияние пищевых режимов на поджелудочную секрецию. Регуляция секреции поджелудочной железы.
Регуляция секреции поджелудочной железы.
Секреция поджелудочной железы регулируется нервными и гуморальными механизмами.
Нервная регуляция. И. П. Павлов показал, что раздражение блуждающего нерва вызывает выделение большого количества сока поджелудочной железы, богатого ферментами. Холинергические волокна блуждающих нервов с помощью АХ действуют на М-холинорецепторы панкреацитов. Затем высвобождающиеся ион Са2+ и комплекс ГЦ — цГМФ в роли вторичных мессенджеров стимулируют секрецию панкреоцитами ферментов и гидрокарбонатов. Холинергические нейроны, кроме того, потенцируют секреторные эффекты секретина и ХЦК. Хирургическая ваготомия существенно снижает секрецию поджелудочной железы.
Симпатические волокна, иннервирующие поджелудочную железу через р-адренорецепторы, тормозят ее секрецию, усиливают синтез органических веществ в ней. Адренергические эффекты снижения секреции обеспечиваются также уменьшением кровоснабжения поджелудочной железы путем сужения кровеносных сосудов через их а-адренорецепторы.
Торможение секреции вызывают болевые раздражения, сон, напряженная физическая и умственная работа и др.
Поджелудочная железа имеет также пептидергическую иннервацию. Окончания этих нейронов выделяют ряд нейропептидов, одни из которых стимулируют, другие — тормозят секрецию поджелудочной железы.
Гуморальная регуляция. Секретин — стимулятор обильного сокоотделения и секреции гидрокарбонатов. Высвобождение этого гормона в кровь S-клетками двенадцатиперстной кишки происходит при действии на ее слизистую оболочку перешедшего в кишку кислого желудочного содержимого. Секретин стимулирует секрецию в большей мере через соответствующие мембранные рецепторы и вторичные мессенджеры АЦ — цАМФ центроацинозные и протоковые клетки, в меньшей мере — ацинозные клетки, поэтому выделяется секрет с высокой концентрацией гидрокарбонатов и низкой ферментативной активностью.
Вторым гормоном, усиливающим секрецию поджелудочной железы, является холецистокинин (ХЦК). Высвобождение гормона в кровь из слизистой оболочки двенадцатиперстной и тощей кишки происходит под влиянием пищевого химуса (особенно продуктов начального гидролиза пищевых белков и жиров, углеводов, некоторых аминокислот). Стимулируют высвобождение ХЦК присутствие ионов Са2+ и снижение рН в двенадцатиперстной кишке.
ХЦК действует преимущественно на ацинусы поджелудочной железы, поэтому выделяющийся в ответ на стимуляцию этим гормоном сок богат ферментами. Вторичными мессенджерами являются ионы Са2+ и комплекс ГЦ — цГМФ. Одновременное действие на Железу секретина и ХЦК (при приеме пищи) усиливает их стимуляторный эффект. Секретин и ХЦК применяются в клинике как стимуляторы секреции при диагностике заболеваний поджелудочной железы. Пептид химоденин стимулирует секрецию химотрипсиногена.
Секреция поджелудочной железы усиливается также гастрином, серотонином, инсулином, бомбезином, солями желчных кислот. Тормозят выделение поджелудочного сока глюкагон, соматостатин, вазопрессин, вещество Р, АКТГ, энкефалин, кальцито-нин, ЖИП, ПП, УУ. ВИП может возбуждать и тормозить секрецию поджелудочной железы.
Фазы секреции поджелудочной железы. Влияние пищевых режимов на секрецию.
Выделяют три фазы поджелудочной секреции,
1) Сложнорефлекторная фаза. Она запускает секрецию сока. Включает условно-рефлекторный и безусловнорефлекторный периоды. Сокоотделение начинается через 2-3 минуты после начала приема пищи. Это связано с воздействием условно-рефлекторных факторов на рецепторы зрительной, слуховой и обонятельной сенсорных систем. При воздействии пищевых масс на механо-, термо- и вкусовые рецепторы полости рта и глотки включаются безусловно-рефлекторные механизмы. Нервные импульсы от рецепторов поступают в секреторный центр продолговатого мозга. От него по эфферентным волокнам вагуса они идут к ацинарным клеткам. Симпатические нервы тормозят секрецию.
2) Желудочная фаза. Начинается с момента поступления пищевого комка в желудок. Он также раздражает механо- и хеморецепторы желудка, импульсы от которых идут в центр секреции, а затем по вагусу к поджелудочной железе. Наиболее сильными рефлекторными стимуляторами секреции панкреатического сока в эту фазу являются соляная кислота, продукты гидролиза жиров и углеводов. Также возбуждает секрецию вырабатывающийся в желудке гастрин.
3) Кишечная фаза. Развивается после поступления химуса в двенадцатиперстную кишку. Рефлекторные механизмы в этой фазе играют незначительную роль. Соляная кислота, содержащаяся в химусе, вызывает выделение S-клетками слизистой двенадцатиперстной кишки гормона секретина (Долинский и Попельский, 1898 г. Бейлисс и Старлинг, 1902 г.). Секретин значительно усиливает поступление из эпителиальных клеток в протоки гидрокарбонат-анионов. В результате выделяется большое количество сока богатого гидрокарбонатом натрия. Одновременно соляная кислота стимулирует образование клетками кишки гормона холецистокининапанкреозимина (ХЦК-ПЗ). Он вызывает высвобождение проферментов из гранул ацинарных клеток, а поэтому их выделение в сок. Кроме того, панкреатическую секрецию в этой фазе усиливают вазоактивный интестинальный пептид (ВИП), серотонин, инсулин. Тормозящее влияние на выделение поджелудочного сока оказывают глюкагон, желудочный ингибирующий пептид (GIP) и соматостатин.
Влияние пищевых режимов на секрецию поджелудочной железы. Прием пищи вызывает увеличение выделения всех ферментов в составе сока, но для разных видов пищи это увеличение выражено в разной мере, В случае приема пищи с большим содержанием углеводов в наибольшей мере увеличивается секреция амилазы, белков — трипсина и химотрипсина, прием жирной пищи вызывает секрецию сока с более высокой липолитической активностью. Спектр ферментов сока поджелудочной железы срочно адаптируется к виду принимаемой пищи во все три фазы секреции и особенно в кишечную фазу.
Существуют и медленные адаптации секреции ферментов в зависимости от длительного режима питания. Суть адаптации состоит в том, что поджелудочная железа синтезирует и секретирует больше того фермента, который гидролизует преобладающие в рационе питательные вещества. Преобладание в рационе белков повышает выделение в составе сока поджелудочной железы про-теаз, преимущественное углеводное питание вызывает увеличение выделения с соком амилазы, а большое количество жира в рационе — выделение с соком липазы.
Эти изменения носят согласованный с изменениями функционирования других отделов пищеварительного тракта характер, составляя часть интегрированных адаптации всего пищеварительного конвейера.
Желчеобразование и желчевыделение, их регуляция. Состав и функции желчи.
Желчь вырабатывается гепатоцитами путем активного и пассивного транспорта в них воды, холестерина, билирубина, катионов. В гепатоцитах из холестерина образуются первичные желчные кислоты - холевая и дезоксихолевая. Из билирубина и глюкуроновой кислоты синтезируется водорастворимый комплекс. Они поступают в желчные капилляры и протоки, где желчные кислоты соединяются с глицином и таурином. В результате образуются гликохолевая и таурохолевая кислоты. Гидрокарбонат натрия образуется с помощью тех же механизмов, что и в поджелудочной железе.
Поскольку вне пищеварения сфинктер Одди, расположенный в устье общего желчного протока, закрыт, выделяющаяся желчь накапливается в желчном пузыре. Здесь из нее реабсорбируется вода, а содержание основных органических компонентов и муцина возрастает в 5-10 раз. Поэтому пузырная желчь содержит 92% воды и 8% сухого остатка. Она более темная, густая и вязкая, чем печеночная. Благодаря этой концентрации пузырь может накапливать желчь в течение 12 часов.
Желчь вырабатывается печенью постоянно. В сутки ее образуется около 1 литра. Это жидкость золотисто-желтого цвета щелочной реакции. Ее рН=7,4-8,6. Она состоит из 97,5% воды и 2,5% сухого остатка. В сухом остатке содержатся:
1) минеральные вещества: катионы натрия, калия и кальция, гидрокарбонат, фосфат анионы, анионы хлора;
2) желчные кислоты - таурохолевая и гликохолевая;
3) желчные пигменты - билирубин и его окисленная форма биливердин. Билирубин придает желчи цвет;
4) холестерин и жирные кислоты; 5. мочевина, мочевая кислота, креатинин;
5) муцин.
Желчеобразование осуществляется непрерывно, но интенсивность его изменяется за счет регуляторных влияний. Усиливают желчеобразование акт еды, принятая пища. Рефлекторно изменяется желчеобразование при раздражении интероцепторов пищеварительного тракта, других внутренних органов и условнорефлекторном воздействии.
Парасимпатические холинергические нервные волокна (воздействия) усиливают, а симпатические адренергические — снижают желчеобразование. Имеются экспериментальные данные об усилении желчеобразования под влиянием симпатической стимуляции.
К числу гуморальных стимуляторов желчеобразования (холеретиков) относится сама желчь. Чем больше желчных кислот поступает из тонкой кишки в кровоток воротной вены (портальный кровоток) тем больше их выделяется в составе желчи, но меньше желчных кислот синтезируется гепатоцитами. Если поступление в портальный кровоток желчных кислот уменьшается, то дефицит их восполняется усилением синтеза желчных кислот в печени. Секретин усиливает секрецию желчи, выделение в ее составе воды и электролитов (гидрокарбонатов). Слабее стимулируют желчеобразование глюкагон, гастрин, ХЦК, простагландины.
Действие различных стимуляторов желчеобразования различно. Например, под влиянием секретина увеличивается в основном объем желчи, под влиянием блуждающих нервов, желчных кислот повышаются ее объем и выделение органических компонентов, высокое содержание в пище полноценных белков увеличивает выделение и концентрацию этих веществ в составе желчи. Желчеобразование усиливают многие продукты животного и растительного происхождения. Соматостатин уменьшает желчеобразование.
Желчевыделение, его регуляция.
Движение желчи в желчевыделительном аппарате обусловлено разностью давления в его частях и в двенадцатиперстной кишке, состоянием сфинктеров внепеченочных желчных путей. В них выделяют следующие сфинктеры: в месте слияния пузырного и общего печеночного протока (сфинктер Мирисси), в шейке желчного пузыря (сфинктер Люткенса) и концевом отделе общего желчного протока и сфинктер ампулы, или Одди. Тонус мышц этих сфинктеров определяет направление движения желчи. Давление в желчевыделительном аппарате создается секреторным давлением желчеобразования и сокращениями гладких мышц протоков и желчного пузыря. Эти сокращения согласованы с тонусом сфинктеров и регулируются нервными и гуморальными механизмами. Давление в общем желчном протоке колеблется от 4 до 300 мм вод. ст., а в желчном пузыре вне пищеварения составляет 60—185 мм вод. ст., во время пищеварения за счет сокращения пузыря поднимается до 200—300 мм вод. ст., обеспечивая выход желчи в двенадцатиперстную кишку через открывающийся сфинктер Одди.
Вид, запах пищи, подготовка к ее приему и собственно прием пищи вызывают сложное и неодинаковое у разных лиц изменение деятельности желчевыделительного аппарата, при этом желчный пузырь сначала расслабляется, а затем сокращается. Небольшое количество желчи через сфинктер Одди выходит в двенадцатиперстную кишку. Этот период первичной реакции желчевыделительного аппарата длится 7—10 мин. На смену ему приходит основной эвакуаторный период (или период опорожнения желчного пузыря), во время которого сокращение желчного пузыря чередуется с расслаблением и в двенадцатиперстную кишку через открытый сфинктер Одди переходит желчь, сначала из общего желчного протока, затем пузырная, а в последующем — печеночная.
Длительность латентного и эвакуаторного периодов, количество выделенной желчи зависят от вида принятой пищи. Сильными стимуляторами желчевыделения являются яичные желтки, молоко, мясо и жиры.
Рефлекторная стимуляция желчевыделительного аппарата и холекинеза осуществляется условно- и безусловно-рефлекторно при раздражении рецепторов рта, желудка и двенадцатиперстной кишки с участием блуждающих нервов.
Наиболее мощным стимулятором желчевыделения является ХЦК, вызывающий сильное сокращение желчного пузыря; гастрин, секретин, бомбезин (через эндогенный ХЦК) вызывают слабые сокращения, а глюкагон, кальцитонин, антихолецистокинин, ВИП, ПП тормозят сокращение желчного пузыря.
Пищеварение в тонкой кишке. Состав и функции сока тонкой кишки. Регуляция кишечной секреции.
Пищеварение в тонкой кишке. Состав и функции сока тонкой кишки.
Кишечный сок является продуктом бруннеровых, либеркюнновых желез и энтероцитов тонкого кишечника. Железы вырабатывают жидкую часть сока, содержащую минеральные вещества и муцин. Ферменты сока выделяются распадающимися энтероцитами, которые образуют его плотную часть в виде мелких комочков. Сок это жидкость желтоватого цвета с рыбным запахом и щелочной реакцией. рН сока 7,6-8,6. Он содержит 98% воды и 2% сухого остатка. В состав сухого остатка входят:
1) минеральные вещества (катионы натрия, калия, кальция; бикарбонат, фосфат анионы, анионы хлора);
2) простые органические вещества (мочевина, креатинин, мочевая кислота, глюкоза, аминокислоты);
3) муцин;
4) ферменты. В кишечном соке более 20 ферментов. 90% из них находится в плотной части сока. Они делятся на следующие группы:
- пептидазы - расщепляют олигопептиды до аминокислот. Это аминополипептидаза, аминотрипептидаза, дипептидаза, трипептидаза, катеп-сины. К ним же относится энтерокиназа;
- карбогидразы -амилаза гидролизует олигосахариды, образовавшиеся при расщеплении крахмала, до мальтозы и глюкозы.
-Сахараза, расщепляет тростниковый сахар до глюкозы.
-Лактаза гйдролизует молочный сахар, а мальтаза солодковый;
- липазы - кишечные липазы играют незначительную роль в переваривании жиров;
- фосфатазы - отщепляют фосфорную кислоту от фосфолипидов;
- нуклеазы (РНКаза и ДНКаза) - гидролизуют нуклеиновые кислоты до нуклеотидов.
Регуляция кишечной секреции.
Прием пищи, местное механическое и химическое раздражение кишки усиливают секрецию ее желез с помощью холинергических и пептидергических механизмов.
В регуляции кишечной секреции ведущее значение имеют местные механизмы. Механическое раздражение слизистой оболочки тонкой кишки вызывает увеличение выделения жидкой части сока. Химическими стимуляторами секреции тонкой кишки являются продукты переваривания белков, жиров, сок поджелудочной железы, соляная и другие кислоты. Местное воздействие продуктов переваривания питательных веществ вызывает отделение кишечного сока, богатого ферментами.
Акт еды существенно не влияет на кишечную секрецию, в то же время имеются данные о тормозных влияниях на нее раздражения антральной части желудка, модулирующих влияний ЦНС, о стимулирующем действии на секрецию холиномиметических веществ и тормозном влиянии холинолитических и симпатомиме-тических веществ. Стимулируют кишечную секрецию ГИП, ВИП, мотилин, тормозит соматостатин. Гормоны энтерокринин и дуо-кринин, вырабатываемые в слизистой оболочке тонкой кишки, стимулируют соответственно секрецию кишечных крипт (либеркюно-вы железы) и дуоденальных (бруннеровых) желез. В очищенном виде эти гормоны не выделены.
Полостной и пристеночный гидролиз питательных веществ.
Пищеварение в тонком кишечнике осуществляется с помощью двух механизмов: полостного и пристеночного гидролиза. При полостном пищеварении ферменты действуют на субстраты, находящиеся в полости кишки, т.е. на расстоянии от энтероцитов. Они гидролизуют лишь крупномолекулярные вещества, поступившие из желудка. В процессе полостного пищеварения расщепляется всего 10-20% связей белков, жиров и углеводов.
Гидролиз оставшихся связей обеспечивает пристеночное или мембранное пищеварение. Оно осуществляется ферментами, адсорбированными на мембранах энтероцитов. На мембране энтероцита имеется до 3000 микроворсинок. Они образуют щеточную кайму. На гликокаликсе каждой микроворсинки фиксируются молекулы ферментов поджелудочного и кишечного соков. Причем их активные группы направлены в просвет между микроворсинками. Благодаря этому поверхность слизистой кишки приобретает свойство пористого катализатора. Скорость гидролиза молекул пищевых веществ увеличивается в сотни раз. Кроме того, образующиеся конечные продукты гидролиза концентрируются у мембраны энтероцитов. Поэтому пищеварение сразу переходит к процессу всасывания и образовавшиеся мономеры быстро переходят в кровь и лимфу. Т.е. формируется пищеварительно-транспортный конвейер. Важной особенностью пристеночного пищеварения является и то, что оно протекает в стерильных условия, т.к. бактерии и вирусы не могут попасть в просвет между микроворсинками. Механизм пристеночного пищеварения обнаружен ленинградским физиологом академиком A.M. Уголевым.
Моторная деятельность тонкой кишки и ее регуляция.
Сокращения кишечника обеспечиваются гладкомышечными клетками, образующими продольный и циркулярный слои. Благодаря связям клеток между собой гладкие мышцы кишечника являются функциональным синцитием. Поэтому возбуждение быстро и на большие расстояния распространяется по нему. В тонком кишечнике наблюдаются следующие типы сокращений:
1) Непропульсивная перистальтика. Это волна сужения кишки, образующаяся за счет сокращения циркулярных мышц и распространяющаяся в каудальном направлении. Ей не предшествует волна расслабления. Такие волны перистальтики движутся лишь на небольшое расстояние.
2) Пропульсивная перистальтика. Это также распространяющееся локальное сокращение циркулярного слоя гладких мышц. Ему предшествует волна расслабления. Такие перистальтические волны более сильные и могут захватывать весь тонкий кишечник.
Перистальтические волны формируются в начальном отделе двенадцатиперстной кишки, где расположены пейсмекерные ГМК. Они движутся со скоростью от 0,1 до 20 см/сек. За счет непропульсивной перистальтики обеспечивается продвижение химуса на небольшие расстояния. Пропульсивная возникает к концу пищеварения и служит для перехода химуса в толстый кишечник.
3) Ритмическая сегментация. Это местные сокращения циркулярных мышц, в результате которых на кишечнике образуются множественные перетяжки, разделяющие его на небольшие сегменты. Место расположения перетяжек постоянно меняется. Благодаря этому происходит перемешивание химуса.
4) Маятникообразные сокращения. Этот вид наблюдается при попеременном сокращении и расслаблении продольного слоя мышц участка кишки. В результате отрезок кишки движется назад-вперед и происходит перемешивание химуса. Кроме того, наблюдаются движения макроворсин тонкого кишечника. В них проходит гладкомышечное волокно. Их движения улучшают контакт слизистой с химусом.
Регуляция моторики кишечника (актуально для тонкого и толстого) осуществляется миогенными, нервными и гуморальными механизмами. Миогенные заключаются в способности гладкомышечных клеток, в особенности пейсмекеров, к автоматии. В них возникают спонтанные медленные колебания мембранного потенциала - медленные волны. На вершинах этих волн деполяризации генерируются пачки потенцилов действия, сопровождающихся ритмическими сокращениями. Медленные волны с ПД распространяются по продольному слою гладких мышц каудально. Это главный механизм перистальтики.
Кроме того, ГМК возбуждаются при растяжении. Поэтому возрастает частота и амплитуда медленных волн. Чем дальше от желудка, тем ниже частота спонтанной активности пейсмекеров.
Важную роль в регуляции моторики играют интрамуральные нервные сплетения. При растяжении стенки кишки возбуждаются чувствительные нейроны подслизистого слоя. Импульсы от них идут к эфферентным нейронам межмышечного. От последних отходят возбуждающие холинергические окончания к ГМК кишки. Роль экстрамуральных вегетативных нервов небольшая. Парасимпатические нервы стимулируют моторику, а симпатические тормозят. За счет интрамуральных сплетений и отчасти экстрамуральных нервов осуществляется ряд моторных рефлексов. Например, желудочно-кишечный или кишечно-кишечные. В частности, при раздражении дистального отдела кишки моторика проксимального тормозится.
Тормозят моторику адреналин и норадреналин, а стимулируют ацетилхолин, серотонин, гистамин, брадикинин. Движения ворсин активирует кишечный гормон вилликинин. Он образуется энтерохромаффинными клетками слизистой при воздействии соляной кислоты.
В эксперименте секреторная функция тонкого кишечника исследуется путем создания изолированного отрезка кишки по Тири-Велла или Тири-Павлову. В последнем случае сохраняется иннервация кишки. В клинике секреторную функцию изучают с помощью зондирования специальным трехканальным зондом. Им можно получить относительно чистый кишечный сок. В последующем определяют содержание ферментов. Используются также копрологическое исследование, фиброколоноскопию. Моторику изучают рентгеноскопически.
Всасывание воды, электролитов и продуктов гидролиза белков, жиров и углеводов в кишечнике.
Вода поступает в пищеварительный тракт в составе пищи и выпиваемых жидкостей (2—2,5 л), секретов пищеварительных желез (6—7 л), выводится же с калом 100—150 мл воды. Все остальное количество воды всасывается из пищеварительного тракта в кровь, небольшое количество — в лимфу. Всасывание воды начинается в желудке, но наиболее интенсивно оно происходит в тонкой и особенно толстой кишке (за сутки около 8 л).
Некоторое количество воды всасывается по осмотическому градиенту, хотя вода всасывается и при отсутствии разности осмотического давления. Основное количество воды всасывается из изотонических растворов кишечного химуса, так как в кишечнике гипер- и гипотонические растворы достаточно быстро концентрируются или разводятся. Абсорбция воды из изотонических и гипертонических растворов требует затраты энергии. Активно всасываемые эпителиоцитами растворенные вещества «тянут» за собой воду. Решающая роль в переносе воды принадлежит ионам, особенно Na+, поэтому все факторы, влияющие на его транспорт, изменяют и всасывание воды. Ингибитор натриевого насоса оуа-баин подавляет всасывание воды. Всасывание воды сопряжено и с транспортом Сахаров и аминокислот. Так, подавление всасывания Сахаров флоридином замедляет всасывание воды. Многие эффекты замедления или ускорения всасывания воды являются результатом изменения транспорта из тонкой кишки других веществ.
За счет энергии, освобождаемой в тонкой кишке при гликолизе и окислительных процессах, усиливается всасывание воды. Наиболее интенсивно всасывание натрия и воды в кишке осуществляется при рН 6,8 (при рН 3 всасывание воды прекращается).
Изменяют всасывание воды рационы питания. Увеличение в нем доли белка повышает скорость всасывания воды, натрия и хлора.
Скорость всасывания воды изменяется в зависимости от гидратированности организма. Наркоз (эфиром и хлороформом), а также ваготомия замедляют всасывание воды. Доказано условно-рефлекторное изменение всасывания воды. На ее всасывание влияют многие гормоны желез внутренней секреции и некоторые гастроинтестинальные гормоны (снижают всасывание воды гастрин, секретин, ХЦК, ВИП, бомбезин, серотонин).
За сутки в желудочно-кишечном тракте всасывается более 1 моля натрия хлорида. У человека натрий почти не всасывается в желудке, интенсивно всасывается в толстой и подвздошной кишке, в тощей кишке его всасывание значительно меньше.
Натрий поступает из полости тонкой кишки в кровь как через кишечные эпителиоциты, так и по межклеточным каналам. Поступление ионов Na+ в эпителиоцит происходит по электрохимическому градиенту пассивным путем. Имеется также система транспорта ионов Na+, сопряженная с транспортом Сахаров и аминокислот, возможно, ионов С1~ и HCO3~. Ионы Na+ из эпителиоцитов через их базолатеральные мембраны транспортируются активно в межклеточную жидкость, кровь и лимфу. Это обеспечивает возможность дальнейшего пассивного транспорта ионов Na+ через апикальные мембраны в эпителиоциты из полости кишечника. Различные стимуляторы и ингибиторы всасывания натрия действуют прежде всего на механизмы активного транспорта базола-теральных мембран эпителиоцитов. Интенсивность всасывания натрия зависит от рН кишечного содержимого и гидратации организма.
В толстой кишке всасывание натрия не зависит от наличия Сахаров и аминокислот, а в тонкой кишке зависит. В тонкой кишке переносы ионов Na+ и С1~ сопряжены друг с другом, в толстой кишке происходит обмен всасывающегося иона Na+ на ион К+. При снижении содержания в организме натрия его всасывание кишечником резко увеличивается. Усиливают всасывание натрия гормоны гипофиза и надпочечников, угнетают гастрин, секретин и ХЦК.
Всасывание калия происходит в основном в тонкой кишке с помощью механизмов активного и пассивного транспорта по электрохимическому градиенту. Во всасывании калия роль активного транспорта мала, и он сопряжен с транспортом натрия в ба-золатеральных мембранах эпителиоцитов.
Всасывание ионов хлора происходит в желудке и наиболее активно в подвздошной кишке по типу активного и пассивного транспорта. Пассивный транспорт ионов Cl~ сопряжен с транспортом ионов Na+. Активный транспорт ионов С1~ осуществляется через апикальные мембраны, он сопряжен с транспортом ионов Na+ или обменом иона С1~ на ион НСО3~.
Двузарядные ионы в пищеварительном тракте всасываются очень медленно. Так, в кишечник человека поступает ежесуточно 35 ммоль кальция, но только половина его всасывается. Он всасывается в 50 раз медленнее, чем ион Na+, но быстрее, чем двузарядные ионы железа, цинка и марганца. Всасывание кальция совершается с участием переносчиков, активируется желчными кислотами и витамином D, соком поджелудочной железы, некоторыми аминокислотами, натрием, некоторыми антибиотиками. При недостатке кальция в организме его всасывание увеличивается, в чем большую роль могут играть гормоны щитовидной, паращитовид-ной желез, гипофиза и надпочечников.
Всасывание продуктов гидролиза белков. Белки всасываются в основном в кишечнике после их гидролиза до аминокислот. Всасывание различных аминокислот происходит с неодинаковой скоростью в различных отделах тонкой кишки.
Быстрее других всасываются аргинин, метионин, лейцин, медленнее — фенилаланин, цистеин, тирозин и еще медленнее — аланин, серии, глютаминовая кислота. L-формы аминокислот всасываются интенсивнее, чем D-формы. Всасывание аминокислот из кишки в эпителиоциты через апикальные мембраны осуществляется активно с помощью переносчиков и со значительной затратой энергии фосфорсодержащих макроэргов. Количество аминокислот, всасывающихся пассивно путем диффузии, невелико.
В апикальных мембранах эпителиоцитов существует несколько видов переносчиков аминокислот. Из эпителиоцитов аминокислоты транспортируются в межклеточную жидкость по механизму облегченной диффузии. Имеются данные о взаимосвязи транспорта аминокислот через апикальную и базальную мембраны. Большинство аминокислот, образующихся в процессе гидролиза белков и пептидов, всасывается быстрее, чем свободные аминокислоты, введенные в тонкую кишку. Между всасыванием различных аминокислот имеются сложные отношения, в результате которых одни аминокислоты могут ускорять и замедлять всасывание других аминокислот. Транспорт натрия стимулирует всасывание аминокислот. Из менее концентрированных растворов аминокислоты всасываются быстрее, чем из более концентрированных.
Интенсивность всасывания аминокислот зависит от возраста (более интенсивно в молодом возрасте), уровня белкового обмена в организме, содержания в крови свободных аминокислот и ряда других факторов, от нервных и гуморальных влияний.
Всасывание углеводов. Всасывание углеводов происходит в основном в тонкой кишке. С наибольшей скоростью всасываются гексозы, а в их числе глюкоза и галактоза, пентозы всасываются медленнее. Всасывание глюкозы и галактозы осуществляется путем активного транспорта через апикальные мембраны кишечных эпителиоцитов. Они обладают высокой избирательной способностью во всасывании различных углеводов. Транспорт моносахаридов, образующихся при гидролизе олигосахаридов, осуществляется с большей скоростью, чем всасывание моносахаридов, введенных в просвет кишки. Всасывание глюкозы (и некоторых других моносахаридов) через апикальные мембраны кишечных эпителиоцитов активируется транспортом натрия. Глюкоза в отсутствие натрия транспортируется через мембрану в 100 раз медленнее, а против градиента концентрации транспорт глюкозы в этом случае прекращается, что объясняется общностью их переносчика.
Глюкоза аккумулируется в кишечных эпителиоцитах и в последующем транспортируется из них через базолатеральные мембраны в межклеточную жидкость и кровь по градиенту концентрации. Не исключается возможность и активного транспорта их глюкозы через базолатеральные мембраны.
Всасывание фруктозы (и некоторых других моносахаридов) не зависит от транспорта натрия, происходит активно. Не исключают возможность и пассивного транспорта фруктозы через апикальные мембраны эпителиоцитов.
Всасывание углеводов тонкой кишкой усиливается некоторыми аминокислотами, резко тормозится ингибиторами тканевого дыхания.
Различные моносахариды в различных отделах тонкой кишки всасываются с неодинаковой скоростью.
На всасывание Сахаров влияют диета, многие факторы внешней среды, концентрация глюкозы в крови. Существует слож-
ная нервная и гуморальная регуляция всасывания углеводов (Р. О. Файтельберг). Доказано изменение их транспорта под влиянием коры большого мозга, подкорковых структур, ствола головного мозга и спинного мозга. Парасимпатические нервные волокна усиливают, а симпатические тормозят транспорт углеводов из тонкой кишки.
Всасывание глюкозы усиливается гормонами надпочечников, гипофиза, щитовидной железы, а также серотонином, ацетилхоли-ном. Тормошит всасывание глюкозы соматостатин, в меньшей мере — гистамин.
Всасывание продуктов гидролиза липидов. Всасывание различных жиров зависит от их эмульгирования и гидролиза и наиболее активно происходит в двенадцатиперстной кишке и проксимальной части тощей кишки.
В результате действия в полости кишки панкреатической липазы из триглицеридов образуются диглицериды, затем моноглице-риды и жирные кислоты, хорошо растворимые в растворах солей желчных кислот. Кишечная липаза производит гидролиз липидов в зоне исчерченной каемки эпИтелиоцитов. Из моноглицеридов, жирных кислот с участием солей желчных кислот, фосфолипидов и холестерина в полости тонкой кишки образуются мельчайшие мицеллы (диаметром около 100 нм), которые переходят в кишечные эпителиоциты. При этом желчные кислоты мицелл остаются в полости кишки и всасываются в подвздошной кишке по механизму активного транспорта.
В кишечных эпителиоцитах происходит ресинтез триглицеридов. Из них, а также из холестерина, фосфолипидов и глобулинов образуются хиломикроны — мельчайшие жировые частицы, заключенные в тончайшую белковую оболочку. Хиломикроны покидают эпителиоциты через базолатеральные мембраны, переходя в соединительные пространства ворсинок, а оттуда — в центральный лимфатический сосуд ворсинки, чему содействуют ее сокращения. Основное количество жира всасывается в лимфу, поэтому через 3—4 ч после приема пищи лимфатические сосуды наполнены большим количеством лимфы, напоминающей молоко и называемой потому млечным соком.
В нормальных условиях в кровь поступает небольшое количество всосавшегося в кишечнике жира, представленного тригли-церидами жирных кислот, молекулы которых содержат короткие углеводородные цепи. В кровеносные капилляры из эпителиоци-тов и межклеточного пространства могут транспортироваться и растворимые в воде свободные жирные кислоты и глицерин. В целом же для всасывания жиров, молекулы которых содержат короткие и средние углеводородные цепи, образование в эпителиоцитах хиломикронов необязательно. Небольшое количество хило-микронов может поступать и в кровеносные сосуды ворсинок. Возможно всасывание нейтрального жира в виде молекулярных и мицеллярных растворов.
Скорость гидролиза и всасывание липидов регулируются ЦНС.
Парасимпатические нервы ускоряют, а симпатические замедляют всасывание липидов. Стимулируют их всасывание гормоны коркового вещества надпочечников, щитовидной железы и гипофиза, а также гормоны, вырабатываемые в двенадцатиперстной кишке,— секретин и ХЦК.
Функции толстой кишки и её роль в пищеварении. Виды моторной деятельности толстой кишки и её регуляция.
Пища почти полностью переваривается и всасывается в тонкой кишке. Небольшое количество веществ пищи, в том числе клетчатка и пектин, в составе химуса подвергаются гидролизу в толстой кишке. Гидролиз осуществляется ферментами химуса, микроорганизмов и сока толстой кишки.
Сок толстой кишки в небольшом количестве выделяется вне ее раздражения. Местное механическое раздражение слизистой оболочки увеличивает секрецию в 8—10 раз. Сок состоит из жидкой и плотной частей, имеет щелочную реакцию (рН 8,5—9,0). Плотную часть сока составляют слизистые комочки из отторгнутых кишечных эпителиоцитов и слизи, секретируемой бокаловидными клетками.
Основное количество ферментов содержится в плотной части сока; их активность значительно меньше, чем в тонкой кишке, хотя
спектры ферментов близки. В соке толстой кишки нет энтероки-назы и сахаразы, щелочной фосфатазы содержится в 15—20 раз меньше, чем в соке тонкой кишки. В соке толстой кишки содержится небольшое количество катепсина, пептидазы, липазы, амилазы и нуклеазы.
С участием этих ферментов в проксимальной части толстой кишки происходит гидролиз питательных веществ. В зависимости от осмотического и гидростатического давления кишечного содержимого интенсивно всасывается вода (до 4—6 л за сутки). Химус постепенно превращается в каловые массы (за сутки выводится 150—250 г сформированного кала). При употреблении растительной пищи их больше, чем после приема смешанной или мясной пищи. Если пища богата неперевариваемыми волокнами (целлюлоза, гемицеллюлоза, пектин, лигнин), то количество кала увеличивается не только за счет них, но и вследствие ускорения передвижения химуса и формируемого кала, что предотвращает запоры и их патогенные последствия.
Виды моторной деятельности толстой кишки и её регуляция.
Весь процесс пищеварения у взрослого человека длится 1 — 3 сут, из них наибольшее время приходится на пребывание остатков пищи в толстой кишке. Ее моторика обеспечивает резервуар-ную функцию — накопление содержимого, всасывание из него ряда веществ, в основном воды, продвижение его, формирование каловых масс и их удаление (дефекация).
У здорового человека контрастная масса через 3—3,1/2 ч после ее приема начинает поступать в толстую кишку, которая заполняется в течение 24 ч и полностью опорожняется за 48—72 ч.
Содержимое слепой кишки совершает небольшие и длительные перемещения то в одну, то в другую сторону за счет медленных сокращений кишки. Для толстой кишки характерны сокращения нескольких типов: малые и большие маятникообразные, перистальтические и антиперистальтические, пропульсивные. Первые четыре типа сокращений обеспечивают перемешивание содержимого кишки и повышение давления в ее полости, что способствует сгущению содержимого путем всасывания воды. Сильные пропульсивные сокращения возникают 3—4 раза в сутки и продвигают кишечное содержимое в дистальном направлении.
Толстая кишка имеет интра- и экстрамуральную иннервацию, играющую ту же роль, что и у тонкой кишки. Толстая кишка получает парасимпатическую иннервацию в составе блуждающих и тазовых нервов; парасимпатические влияния усиливают моторику путем условных и безусловных рефлексов при раздражении пищевода, желудка и тонкой кишки. Симпатические нервы проходят в составе чревных нервов и тормозят моторику кишки.
Ведущее значение в организации моторики толстой кишки имеют интрамуральные нервные механизмы при местном механическом и химическом раздражении толстой кишки ее содержимым. Раздражение механорецепторов прямой кишки тормозит моторику вышележащих отделов тонкой кишки. Тормозят ее и серото-нин, адреналин, глюкагон.
Непроизвольная и произвольная регуляция акта дефекации.
Каловые массы удаляются с помощью акта дефекации, представляющего сложнорефлекторный процесс опорожнения дистального отдела толстой кишки через задний проход. При наполнении ампулы прямой кишки калом и повышении в ней давления до 40 — 50 см вод.ст. происходит раздражение механо- и барорецепторов. Возникшие при этом импульсы по афферентным волокнам тазового (парасимпатического) и срамного (соматического) нервов направляются в центр дефекации, который расположен в поясничной и крестцовой частях спинного мозга (непроизвольный центр дефекации). Из спинного мозга по эфферентным волокнам тазового нерва импульсы идут к внутреннему сфинктеру, вызывая его расслабление, и одновременно усиливают моторику прямой кишки.
Произвольный акт дефекации осуществляется при участии коры больших полушарий, гипоталамуса и продолговатого мозга, которые оказывают свой эффект через центр непроизвольной дефекации в спинном мозге. От альфа-мотонейронов крестцового отдела спинного мозга по соматическим волокнам срамного нерва импульсы поступают к наружному (произвольному) сфинктеру, тонус которого вначале повышается, а при увеличении силы раздражения тормозится. Одновременно происходит сокращение диафрагмы и брюшных мышц, что ведет к уменьшению объема брюшной полости и повышению внутрибрюшного давления, что способствует акту дефекации.
Продолжительность эвакуации, т.е. время, в течение которого происходит освобождение кишок от содержимого, у здорового человека достигает 24 — 36 часов. Парасимпатические нервные волокна, идущие в составе тазовых нервов, тормозят тонус сфинктеров, усиливают моторику прямой кишки и стимулируют акт дефекации. Симпатические нервы повышают тонус сфинктеров и тормозят моторику прямой кишки.
Функции печени, их характеристика.
Из всех органов печень играет ведущую роль в обмене белков, жиров, углеводов, витаминов, гормонов и других веществ. Ее основные функции:
1) Антитоксическая. В ней обезвреживаются токсические продукты, образующиеся в толстом кишечнике в результате бактериального гниения белков - индол, скатол и фенол. Они, а также экзогенные токсические вещества (алкоголь), подвергаются биотрансформации. (Экк-Павловское соустье).
2) Печень участвует в углеводном обмене. В ней синтезируется и накапливается гликоген, а также активно протекают процессы гликогенолиза и неоглюкогенеза. Часть глюкозы используется для образования жирных кислот и гликопротеинов.
3) В печени происходит дезаминирование аминокислот, нуклеотидов и других азотсодержащих соединений. Образующийся при этом аммиак нейтрализуется путем синтеза мочевины.
4) Печень участвует в жировом обмене. Она преобразует короткоцепочечные жирные кислоты в высшие.
Образующийся в ней холестерин используется для синтеза ряда гормонов.
1) Она синтезирует ежесуточно около 15 г альбуминов, 1 и 2-глобулины, 2-глобулины плазмы.
2) Печень обеспечивает нормальное свертывание крови, аз-глобулинами являются протормбин. Ас-глобулин, конвертин, антитромбины. Кроме того, ею синтезируется фибриноген и гепарин.
3) В ней инактивируются такие гормоны, как адреналин, норадреналин, серотонин, андрогены и эстрогены.
4) Она является депо витаминов А, В, D, Е, К.
5) В ней депонируется кровь, а также происходит разрушение эритроцитов с образованием из гемоглобина билирубина.
6) Экскреторная. Ею выделяются в желудочно-кишечный тракт холестерин, билирубин, мочевина, соединения тяжелых металлов.
7) В печени образуется важнейший пищеварительный сок - желчь.
Понятие о валовом и основном обмене. Факторы, определяющие величину основного обмена.
Общий обмен (Валовый) - это обмен веществ и энергии между организмом и внешней средой, происходящий у животного при обычных условиях его жизни, это обмен веществ в целом, т. е. валовой обмен. При изучении общего обмена учитывают количество питательных веществ в суточном рационе и количество продуктов распада, выделенных из организма с калом и мочой. Для этого проводят так называемые балансовые опыты.
Общий обмен веществ значительно варьирует в зависимости от условий внешней среды, питания, пола, возраста, породы, массы тела, функционального состояния нервной системы и т. д. По существу, почти нет ни одного фактора, который в той или иной степени не влиял бы на характер общего обмена.
Основной обмен. Факторы, определяющие величину основного обмена.
Основной обмен — минимальное количество энергии, необходимое для обеспечения нормальной жизнедеятельности в условиях относительного физического и психического покоя. Эта энергия расходуется на процессы клеточного метаболизма, кровообращение, дыхание, выделение, поддержание температуры тела, функционирование жизненно важных нервных центров мозга, постоянную секрецию эндокринных желёз.
Факторами, влияющими на величину основного обмена, являются: пол человека (у мужчин основной обмен выше, чем у женщин, на 10%), возраст (чем меньше возраст, тем выше основной обмен) и масса тела, характер питания (при ограничении питания основной обмен снижается), физическая нагрузка (напряженная работа мышц способствует усилению основного обмена), климатические факторы (указанный критерий повышается в условиях неблагоприятного климата при низких температурах воздуха (<140 С) на 5%, а при высоких снижается) В среднем величина основного обмена у мужчин 1700 ккал/сут., а у женщин 1550.
Специфическое динамическое действие пищи. Рабочая прибавка. Величины энергозатрат в зависимости от особенностей профессии.
Специфическое динамическое действие пищи.
После приема пищи интенсивность обмена веществ и энерготраты организма увеличиваются по сравнению с их уровнем в условиях основного обмена. Увеличение обмена веществ и энергии начинается через час, достигает максимума через 3 ч после приема пищи и сохраняется в течение нескольких часов. Влияние приема пищи, усиливающее обмен веществ и энергетические затраты, получило название специфического динамического действия пищи.
При белковой пище оно наиболее велико: обмен увеличивается в среднем на 30 %. При питании жирами и углеводами обмен увеличивается у человека на 14—15 %.
Специфически – динамическое действие пищи обусловлено:
• затратами энергии на переваривание пищи,
• всасыванием в кровь и лимфу питательных веществ из ЖКТ
• ресинтезом белковых, сложных липидных и других молекул;
• влиянием на метаболизм биологически активных веществ, поступающих в организм в составе пищи
Рабочая прибавка. Величины энергозатрат в зависимости от особенностей профессии.
Рабочая прибавка — это расход энергии на выполнение внешней работы и движения. Она определяется преимущественно мышечной работой, ее интенсивностью и продолжительностью. Поэтому при установлении величин суточной потребности в энергии взрослого трудоспособного населения определяющее значение приобретает характер труда.
По интенсивности и профессиональной направленности труда с учетом возраста и пола выделяют 5 групп населения (табл. 1).
Суточная потребность в энергии у детей относительно выше, чем у взрослых и составляет на 1 кг массы тела в возрасте 6—9 лет — 80—70 ккал; 10—13 лет — 75—65 ккал и 14—17 лет — 65—50 ккал.
Половые различия у детей по характеру расхода энергии наступают с 11 лет, поэтому в зависимости от возраста суточная потребность в энерготратах определяется в возрасте 7—10 лет — 2 300 ккал; 11—13 лет: мальчики — 2 700 ккал, девочки 2450 ккал; 14—17 лет: юноши — 2900 ккал, девушки — 2 600 ккал.
Таблица 1: Группы населения по интенсивности и профессиональной направленности труда
Группы интенсивности труда |
Возраст (лет) |
Энергия (ккал) |
I. Работники преимущественно умственного труда |
18—29 30—39 40—59 |
2800/2400 2700/2300 2550/2200 |
II. Работники, занятые легким физическим трудом |
18—29 30—39 40—59 |
3000/2550 2900/2450 2900/2450 |
III. Работники среднего по тяжести труда |
18—29 30—39 40—59 |
3200/2700 3100/2600 2950/2500 |
IV. Работники тяжелого физического труда |
18—29 30—39 40—59 |
3700/3150 3600/3150 3450/2900 |
V. Работники, занятые особо тяжелым физическим трудом |
18—29 30—39 40—59 |
|
Регуляция энергетического обмена. Методы исследования энергообмена: прямая и непрямая калориметрия.
Регуляция энергетического обмена.
Высшие нервные центры регуляции энергетического обмена и обмена веществ находятся в гипоталамусе. Они влияют на эти процессы через вегетативную нервную систему и гипоталамо-гипофизарную систему. Симпатический отдел ВНС стимулирует процессы диссимиляции, парасимпатический ассимиляцию. В нем же находятся центры регуляции водно-солевого обмена. Но главная роль в регуляции этих базисных процессов принадлежит железам внутренней секреции. В частности, инсулин и глюкагон регулируют углеводный и жировой обмены. Причем инсулин тормозит выход жира из депо. Глюкокортикоиды надпочечников стимулируют распад белков. Соматотропин наоборот усиливает синтез белка. Минералокортикоиды натрий-калиевый. Основная роль в регуляции энергетического обмена принадлежит тиреоидным гормонам. Они резко усиливают его. Они же главные регуляторы белкового обмена. Значительно повышает энергетический обмен и адреналин. Большое его количество выделяется при голодании.
После приема пищи интенсивность обмена веществ и энерготраты организма увеличиваются по сравнению с их уровнем в условиях основного обмена. Увеличение обмена веществ и энергии начинается через час, достигает максимума через 3 ч после приема пищи и сохраняется в течение нескольких часов. Влияние приема пищи, усиливающее обмен веществ и энергетические затраты, получило название специфического динамического действия пищи.
При белковой пище оно наиболее велико: обмен увеличивается в среднем на 30 %. При питании жирами и углеводами обмен увеличивается у человека на 14—15 %.
Методы исследования энергообмена:
Соотношение между количеством энергии, поступившей в организм с пищей, и энергии, выделенной организмом во внешнюю среду называется энергетическим балансом организма. Существует 2 метода определения выделяемой организмом энергии.
Прямая калориметрия.
Прямая калориметрия. Принцип прямой калориметрии основан на том, что все виды энергии в конечном итоге переходят в тепловую. Поэтому при прямой калориметрии определяют количество тепла выделяемого организмом в окружающую среду за единицу времени. Для этого используют специальные камеры с хорошей теплоизоляцией и системой теплоообменных труб, в которых циркулирует и нагревается вода.
Непрямая калориметрия. Дыхательный коэффициент и калорический эквивалент кислорода.
Непрямая калориметрия. Она заключается в определении соотношения выделенного углекислого газа и поглощенного кислорода за единицу времени. Т.е. полном газовом анализе. Это соотношение называется дыхательным коэффициентом (ДК).
Величина дыхательного коэффициента определяется тем, какое вещество окисляется в клетках организма. Например, в молекуле углеводов атомов кислорода много, поэтому на их окисление кислорода идет меньше и их дыхательный коэффициент равен 1. В молекуле липидов кислорода значительно меньше, поэтому дыхательный коэффициент при их окислении 0,7. Дыхательный коэффициент белков 0,8. При смешанном питании его величина 0,85-0,9. Дыхательный коэффициент становится больше 1 при тяжелой физической работе, ацидозе, гипервентиляции и преобразовании в организме углеводов в жиры. Меньше 0,7 он бывает при переходе жиров в углеводы. Исходя из дыхательного коэффициента рассчитывается калорический эквивалент кислорода, т.е. количество энергии выделяемой организмом при потреблении 1 л кислорода. Его величина также зависит от характера окисляемых веществ. Для углеводов он составляет 5 ккал, белков 4,5 ккал, жиров 4,7 ккал. Непрямая калориметрия в клинике производится с помощью аппаратов "Метатест-2", "Спиролит".
Величина поступившей в организм энергии определяется количеством и энергетической ценностью пищевых веществ. Их энергетическую ценность определяют путем сжигания в бомбе Бертло в атмосфере чистого кислорода. Таким путем получают физический калорический коэффициент. Для белков он равен 5,8 ккал/г, углеводов 4,1 ккал/г, жиров 9,3 ккал/г. Для расчетов используют физиологический калорический коэффициент. Для углеводов и жиров он соответствует физическому, а для белков составляет 4,1 ккал/г. Его меньшая величина для белков объясняется тем, что в организме они расщепляются не до углекислого газа и воды, а да азотсодержащих продуктов.
Терморегуляция как фактор гомеостаза. Температура тела человека и его частей. Суточная динамика температуры тела.
Терморегуляция – это совокупность физиологических процессов, деятельность которых направлена на поддержание относительного постоянства температуры ядра в условиях изменения температуры среды с помощью регуляции теплопродукции и теплоотдачи. Терморегуляция направлена на предупреждение нарушений теплового баланса организма или на его восстановление, если подобные нарушения уже произошли, и осуществляется нервно-гуморальным путём
Постоянство температуры тела, и особенно жизненно важных органов, обязательное условие жизни для человека и теплокровных животных.
Для человека и теплокровных животных снижение или повышение температуры тела хотя бы на 1 °С означает резкое снижение уровня здоровья и работоспособности. Нормальной температурой тела для человека принято считать температуру при ее измерении в подмышечной впадине в пределах 36—37 °С. Регулируя гомеостаз по параметру температуры тела, организм использует для поддержания изотермии практически все системы и органы. Так, например, кровь, лимфа, тканевая жидкость выполняют функцию теплоносителей. Система кровообращения обеспечивает изменения объемной скорости кровотока и перераспределение крови между наружными покровами и внутренними органами, что меняет уровень теплоотдачи. Сокращения мышц увеличивают теплообразование. Потоотделение и дыхание способствуют испарению жидкости с поверхности тела и дыхательных путей.
Терморегуляцию можно разделить на два основных вида: химическую и физическую терморегуляцию.
Они, в свою очередь, также подразделяются на несколько видов:
Химическая терморегуляция
- Сократительный термогенез
- Несократительный термогенез.
Физическая терморегуляция
-Излучение.
-Теплопроведение (кондукция)
-Конвекция
-Испарение
Изотермия в процессе онтогенеза развивается постепенно. У новорожденного ребенка способность поддерживать постоянство температуры тела несовершенна. Вследствие этого может наступать охлаждение (гипотермия) или перегревание (гипертермия) организма при таких температурах окружающей среды, которые не оказывают влияния на взрослого челове¬ ка. Равным образом даже небольшая мышечная работа, например, связанная с актом сосания или длительным криком ребенка, может привести к повышению температуры тела. Температура тела детей раннего возраста, как правило, на 0,3—0,4 °С выше, чем у взрослого, постепенно приближается к последней и выравнивается с ней лишь к 5-му году жизни. В теле человека принято различать «ядро», температура которого сохраняется достаточно постоянной, и «оболочку», температура которой существенно колеблется в зависимости от температуры внешней среды. При этом область «ядра» сильно уменьшается при низкой внешней температуре и, наоборот, увеличивается при относительно высокой температуре окружающей среды. Поэтому справедливо говорить о том, что изотермия присуща главным образом внутренним органам и головному мозгу. Поверхность же тела и конечности, температура которых может изменяться в зависимости от температуры окружающей среды, имеют различную температуру в зависимости от удаленности от «ядра» и степени защищенности одеждой. Так, температура кожи туловища и головы равна 32-34 °С; на участках кожи, покрытых одеждой, 30—32 °С; на пальцах ног, кончике носа, ушной раковине 22 °С; на открытой тыльной стороне ладоней в холодное время года до 12—14 °С. Температура конечностей и кожи у гомойотермных является результирующей величиной между доставляемым теплом и интенсивностью его отдачи. В организме гомойотермных животных происходит постоянное выравнивание температуры горячего «ядра» и более холодной «оболочки» за счет смешивания потоков теплой и холодной крови от них. Температура тела человека, измеряемая в подмышечной впадине, колеблется в пределах 36—37 °С, а в прямой кишке 37,5—37,9 °С. У детей младшего возраста иногда измеряют температуру в полости рта. Она на несколько десятых градуса ниже, чем ректальная, и составляет в норме 37,2-37,5 °С. Температуру тела обычно измеряют максимальным ртутным термометром (удерживает отмеченную максимальную температуру после его извлечения из подмышечной впадины благодаря сужению капилляра над ртутным резервуаром). Температура тела у взрослого человека в течение суток не остается постоянной и колеблется в пределах 0,5—0,7 °С, в отдельных случаях до 1 °С. Покой и сон понижают, мышечная деятельность, эмоции повышают температуру тела. Максимальная температура тела наблюдается в 16—18 ч, затем она постепенно падает и к 3—4-м ч утра достигает минимума, возвращаясь к исходной величине опять в 16—18 ч. Эта суточная периодика определяется для животных факторами внешней среды, а для человека главным образом социальными, в частности ритмом общественной жизни, замирающей в ночное время. Суточные сдвиги физиологических функций определяются периодической активностью ЦНС, которая в свою очередь рефлекторно реагирует на изменения внешней физической и социальной среды. В опытах на обезьянах было показано, что при имитации по режиму питания и освещения 12 часовых суток температура их тела имела колебания с периодикой, соответствующей 12-часовым суткам. У человека при переезде на жительство, для участия в спортивных соревнованиях, на отдых в другие широты суточный ритм колебаний температуры тела соответственно изменяется. Каждый участок тела, каждый орган имеет свою температуру, отличающуюся от температуры тела. Самый «горячий» орган — печень. Температура ее ткани 38,5—39,5 °С, температура глубоких структур мозга 38—38,5 °С, поверхности коры большого мозга под твердой мозговой оболочкой 37,2-37,6 °С. В работающих тканях температура повышается в результате увеличения в них уровня обмена веществ. Так, в работающей скелетной мышце темпе¬ ратура увеличивается на 2—2,5 °С, в активно секретирующей околоушной железе на 0,8—1,0 °С, в корковых центрах двигательного условного рефлекса на 0,3 °С. Постоянство температуры тела у человека может сохраняться лишь при условии равенства теплообразования и теплопотери всего организма. Это достигается с помощью физиологических механизмов терморегуляции.
Теплообразование и теплоотдача. Центр терморегулции. Регуляция изотермии.
Химическая терморегуляция. Сократительный термогенез
Этот вид терморегуляции работает если нам холодно и необходимо поднять температуру тела. Заключается этот метод в сокращении мышц.
При сокращении мышц возрастает гидролиз АТФ, поэтому возрастает поток вторичной теплоты, идущей на согревание тела.
Произвольная активность мышечного аппарата, в основном, возникает под влиянием коры больших полушарий. При этом повышение теплопродукции возможно в 3–5 раз по сравнению с величиной основного обмена.
Обычно при снижении температуры среды и температуры крови первой реакцией является увеличение терморегуляционного тонуса (волосы на теле "встают дыбом", появляются "мурашки"). С точки зрения механики сокращения, данный тонус представляет собой микровибрацию и позволяет увеличить теплопродукцию на 25–40% от исходного уровня. Обычно в создании тонуса принимают участие мышцы головы и шеи.
При более значительном переохлаждении терморегуляционный тонус переходит в мышечную холодовую дрожь. Холодовая дрожь представляет собой непроизвольную ритмическую активность поверхностно расположенных мышц, в результате которой теплопродукция повышается. Считается, что теплопродукция при холодовой дрожи в 2,5 раз выше, чем при произвольной мышечной деятельности.
Описанный механизм работает на рефлекторном уровне, без участия нашего сознания. Но поднять температуру тела можно и при помощи сознательной двигательной активности.
При выполнении физической нагрузки разной мощности теплопродукция возрастает в 5–15 раз по сравнению с уровнем покоя. Температура ядра на протяжении первых 15–30 минут длительной работы довольно быстро повышается до относительно стационарного уровня, а затем сохраняется на этом уровне или продолжает медленно повышаться.
Несократительный термогенез
Этот вид терморегуляции может приводить, как повышению, так и к понижению температуры тела.
Он осуществляется путём ускорения или замедления катаболических процессов обмена веществ. А это, в свою очередь, будет приводить к снижению или увеличению теплопродукции. За счёт этого вида термогенеза теплопродукция может вырасти в 3 раза.
Регуляция процессов несократительного термогенеза осуществляется путём активации симпатической нервной системы, продукции гормонов щитовидной и мозгового слоя надпочечников.
Характеристика теплоотдачи (физическая терморегуляция).
Физическая терморегуляция
Под физической терморегуляцией понимают совокупность физиологических процессов, ведущих к изменению уровня теплоотдачи. Различают несколько механизмов отдачи тепла в окружающую среду.
Излучение – отдача тепла в виде электромагнитных волн инфракрасного диапазона. За счёт излучения отдают энергию все предметы, температура которых выше абсолютного нуля. Электромагнитная радиация свободно проходит сквозь вакуум, атмосферный воздух для неё тоже можно считать «прозрачным». Количество тепла, рассеиваемого организмом в окружающую среду излучением, пропорционально площади поверхности излучения (площади поверхности тела, не покрытой одеждой) и градиенту температуры. При температуре окружающей среды 20°с и относительной влажности воздуха 40–60% организм взрослого человека рассеивает путём излучения около 40–50% всего отдаваемого тепла.
Теплопроведение (кондукция) – способ отдачи тепла при непосредственном соприкосновении тела с другими физическими объектами. Количество тепла, отдаваемого в окружающую среду этим способом, пропорционально разнице средних температур контактирующих тел, площади соприкасающихся поверхностей, времени теплового контакта и теплопроводности.
Конвекция – теплоотдача, осуществляемая путём переноса тепла движущимися частицами воздуха (воды). Воздух, соприкасающийся с кожей, нагревается и поднимается, его место занимает «холодная» порция воздуха и т. д. В условиях температурного комфорта этим способом тело теряет до 15% всего отдаваемого тепла.
Испарение – отдача тепловой энергии в окружающую среду за счёт испарения пота или влаги с поверхности кожи и слизистых дыхательных путей. За счёт испарения организм в условиях комфортной температуры отдаёт около 20% всего рассеиваемого тепла. Испарение делится на 2 вида.
Неощущаемая перспирация – испарение воды со слизистых дыхательных путей (через дыхание) и воды, просачивающейся через эпителий кожного покрова (Испарение с поверхности кожи. Оно идёт даже в случае, если кожа сухая.). За сутки через дыхательные пути испаряется до 400 мл воды, т.е. организм теряет до 232 ккал в сутки. При необходимости эта величина может быть увеличена за счёт тепловой одышки. Через эпидермис в среднем за сутки просачивается около 240 мл воды. Следовательно, этим путём организм теряет до 139 ккал в сутки. Эта величина, как правило, не зависит от процессов регуляции и различных факторов среды.
Ощущаемая перспирация – отдача тепла путём испарения пота. В среднем за сутки при комфортной температуре среды выделяется 400–500 мл пота, следовательно, отдаётся до 300 ккал энергии. Однако при необходимости объём потоотделения может увеличиться до 12 л в сутки, т.е. путём потоотделения можно потерять до 7000 ккал в сутки. Эффективность испарения во многом зависит от среды: чем выше температура и ниже влажность, тем выше эффективность потоотделения как механизма отдачи тепла. При 100% влажности испарение невозможно.
Центр терморегулции. Регуляция изотермии.
Регуляторные реакции, обеспечивающие сохранение постоянства температуры тела, представляют собой сложные рефлекторные акты, которые возникают в ответ на температурное раздражение рецепторов кожи, кожных и подкожных сосудов, а также самой ЦНС. Эти рецепторы, воспринимающие холод и тепло, названы терморецепторами. При относительно постоянной температуре окружающей среды от рецепторов в ЦНС поступают ритмичные импульсы, отражающие их тоническую активность. Частота этих импульсов максимальна для Холодовых рецепторов кожи и кожных сосудов при температуре 20—30 °С, а для кожных тепловых рецепторов — при температуре 38—43 °С. При резком охлаждении кожи частота импульсации в Холодовых рецепторах возрастает, а при быстром согревании урежается или прекращается. На такие же перепады температуры тепловые рецепторы реагируют прямо противоположно. Тепловые и холодовые рецепторы ЦНС реагируют на изменение температуры крови, притекающей к нервным центрам.
Терморецепторы ЦНС находятся в передней части гипоталамуса — в преоптической зоне, в ретикулярной формации среднего мозга, а также в спинном мозге. Наличие в ЦНС температурных рецепторов доказывается многими экспериментами. Так, погружение в холодную воду денервированных задних конечностей собаки вызывает дрожь мышц головы, передних конечностей и туловища и усиление теплообразования. Терморегуляторные рефлексы, вызываемые раздражением холодовых рецепторов кожи, в данном опыте исключены перерезкой нервов, и эффекты охлаждения конечностей объясняются только понижением температуры крови и раздражением центральных холодовых рецепторов.
Дрожь и сужение кожных сосудов, а следовательно, повышение теплообразования и понижение теплоотдачи возникают также при охлаждении сонной артерии, приносящей кровь к головному мозгу.
Термочувствительность гипоталамуса была показана в экспериментах на ненаркотизированных кроликах. Животным в область гипоталамуса вживляли специальные термонагреватели. Оказалось, что повышение температуры на 0,41 °С вызывает выраженную тер-морегуляторную реакцию, проявляющуюся в расширении сосудов уха. Такая реакция возникала при температуре окружающей среды 22—27 °С. Когда же температуру среды снижали до 17—20 °С, то для получения сосудорасширяющей реакции нагревание гипоталамуса нужно было увеличить на 0,84 °С. Таким образом, понижение окружающей температуры, а следовательно, изменение характера температурного воздействия на экстерорецепторы уменьшает температурную чувствительность гипоталамуса. Участие гипоталамуса в терморегуляции обеспечивает взаимодействие восприятия сигналов об изменении температуры окружающей и внутренней среды.
Именно в гипоталамусе расположены основные центры терморегуляции, которые координируют многочисленные и сложные процессы, обеспечивающие сохранение температуры тела на постоянном уровне. Это доказывается тем, что разрушение гипоталамуса влечет за собой потерю способности регулировать температуру тела и делает животное пойкилотермным, в то время как удаление коры большого мозга, полосатого тела и зрительных бугров заметно не отражается на процессах теплообразования и теплоотдачи.
При изучении роли различных участков гипоталамуса в терморегуляции обнаружены ядра, изменяющие процесс теплообразования, и ядра, влияющие на теплоотдачу.
Питание. Физиологические основы формирования чувства голода и насыщения. Принципы организации рационального питания.
Питание. Физиологические основы формирования чувства голода и насыщения.
Потребление пищи организмом происходит в соответствии с интенсивностью пищевой потребности, которая определяется его энергетическими и пластическими затратами. Такая регуляция потребления пищи называется кратковременной. Долговременная возникает в результате длительного голодания или переедания, после которых объем потребляемой пищи возрастает или снижается. Пищевая мотивация проявляется чувством голода. Это эмоционально окрашенное состояние отражающее пищевую потребность. Появление чувства голода связано с формированием возбуждения в нервных центрах.
Субъективно чувство голода локализуется в желудке, так как движения пустого желудка вызывают раздражение его механорецепторов и поступление нервных импульсов в отделы пищевого центра. Его возникновению способствует и возбуждение хеморецепторов пустого кишечника. Однако главную роль играют глюкоре-цепторы желудка, кишечника, печени и промежуточного мозга. При снижении содержания глюкозы в крови они возбуждаются. Нервные импульсы от них поступают к центру голода гипоталамуса, а от него к лимбической системе и коре. Возникает чувство голода. При увеличении содержания глюкозы до определенного уровня развивается чувство насыщения, так как активируются нейроны центра насыщения гипоталамуса.
Центр голода находится в области латеральных ядрах гипоталамуса, а центр насыщения в вентромедиальных. Эти центры находятся в реципрокных отношениях. В них имеются нейроны чувствительные к недостатку или избытку глюкозы, жирных кислот, аминокислот. Они совместно с периферическими рецепторами участвуют в формировании пищевой мотивации, реагируя на изменение состава спинномозговой жидкости. Координируется активность этих центров нейронами миндалевидного ядра. В частности, оно определяет поведение на вкусную и невкусную пищу. Стадия насыщения, возникающая при раздражении рецепторов полости рта, желудка, кишечника называется сенсорной. Возникновение этой стадии обусловлено возбуждением определенных зон фронтальной коры. Кора формирует психологические наклонности. К ним относятся обычный аппетит, склонность к определенным блюдам и т.д. При поступлении продуктов гидролиза пищевых веществ в кровь развивается метаболическая стадия насыщения.
В клинике встречаются нарушения пищевой мотивации. Например, у девушек в период полового созревания может наблюдаться нервная анорексия, т.е. отказ от еды. Иногда нервная анорексия приводит к голодной смерти. Она же часто является следствием так называемого лечебного голодания. Наблюдаются случаи непреодолимого отвращения к пище и голодная смерть. Часты случаи патологического переедания.
Раздражение вентромедиальных зоны гипоталамуса приводит к отказу от принятия пищи. Эти ядра - центр насыщения. С гипоталамическим пищевым центром тесно связаны нейроны миндалин и корковые отделы лимбической системы, которые отвечают за эмоциональную окраску при испытании чувства голода. Одним из механизмов, вызывающих чувство голода, является сокращение пустого желудка, которое воспринимается механорецепторами стенки желудка.
Чувство насыщения связано с раздражением рецепторов органов пищеварения, в частности желудка и двенадцатиперстной кишки. Особенно заметную роль играет их наполнения, при котором подавляется центр голода. Нервные влияния передаются посредством афферентов блуждающего и симпатического нервов. Гормон холецистокинин также уменьшает чувство голода. Различают два вида насыщения - сенсорное (первичное) и обменное (вторичное). Первичное насыщение возникает вследствие раздражения вкусовых, обонятельных рецепторов, механорецепторов рта и желудка. Оно возникает еще во время еды. В это время повышается концентрация в крови глюкозы, свободных жирных кислот, которые поступают из депо.
Вторичное насыщения возникает несколько позже, только тогда, когда продукты гидролиза питательных веществ всасываются бы кровь и лимфу. В настоящее время некоторые гормоны (ХЦК-ПЗ, соматостатин, бомбезин, субстанция Р) усиливают насыщение и снижают чувство голода, наоборот, пентагастрин, инсулин, окситоцин активизируют потребления пищи.
Аппетит - ощущение, связанное со стремлением человека к определенной пище. Аппетит индивидуально вырабатывается и отражает не столько потребность в пище вообще, сколько потребность в связи со спецификой обмена веществ и дефицитом тех или иных компонентов пищи, индивидуальных и групповых привычек, особенностью национальной кухни и продуктов, которым отдается предпочтение.
Теоретические основы питания. Принципы организации рационального питания.
В зависимости от возраста, пола, профессии потребление белков, жиров и углеводов должно составлять: у мужчин I-IV групп Б: 96-108 г, Ж: 90-120 г, У: 382-552 г; у женщин I-IV групп Б: 82-92 г, Ж: 77-102 г, У: 303-444 г.
В прошлом веке Рубнер сформулировал закон изодинамии, согласно которому пищевые вещества могут взаимозаменяться по своей энергетической ценности. Однако он имеет относительное значение, так как белки, выполняющие пластическую роль, не могут синтезироваться из других веществ. Это же касается незаменимых жирных кислот. Поэтому требуется питание сбалансированное по всем питательным веществам. Кроме того, необходимо учитывать усвояемость пищи. Это соотношение всосавшихся и выделившихся с калом питательных веществ. Наиболее легко усваиваются животные продукты. Поэтому животный белок должен составлять не менее 50% суточного белкового рациона, а жиры не более 70% жирового.
Под режимом питания подразумевается кратность приема пищи и распределение ее калорийности на каждый прием. При трехразовом питании на завтрак должно приходится 30% калорийности суточного рациона, обед 50%, ужин 20%. При более физиологичном четырехразовом, на завтрак 30%, обед 40%, полдник 10%, ужин 20%. Интервал между завтраком и обедом не более 5 часов, а ужин должен быть не менее чем за 3 часа до сна. Часы приема пищи должны быть постоянными.
Общая характеристика органов выделительной системы.
Органы выделения:
- почки - удаляют избыток воды, неорганических и органических веществ, конечные продукты обмена;
- легкие — выводят углекислый газ, воду, некоторые летучие вещества, например пары эфира и хлороформа при наркозе, пары алкоголя при опьянении;
- слюнные и желудочные железы — выделяют тяжелые металлы, ряд лекарственных препаратов (морфий, хинин) и чужеродных органических соединений;
- поджелудочная железа и кишечные железы - экскретируют тяжелые металлы, лекарственные вещества;
- кожа (потовые железы) - выделяют воду, соли, некоторые органические вещества, в частности мочевину, а при напряженной работе — молочную кислоту.
Почки играют ведущую роль в экскреции азотсодержащих веществ, воды (в нормальных условиях более половины ее объема от суточного выделения), избытка большинства минеральных веществ (натрия, калия, фосфатов и др.), избытка питательных и чужеродных веществ.
Легкие обеспечивают удаление более 90% углекислого газа, образующегося в организме, паров воды, некоторых летучих веществ, попавших или образующихся в организме (алкоголь, эфир, хлороформ, газы автотранспорта и промышленных предприятий, ацетон, мочевина, продукты деградации сурфактанта). При нарушении функций почек усиливается выделение мочевины с секретом желез дыхательных путей, разложение которой приводит к образованию аммиака, что обусловливает появление специфического запаха из рта.
Железы пищеварительного тракта (включая слюнные железы) играют ведущую роль в выделении избытка кальция, билирубина, желчных кислот, холестерола и его производных. Они могут выделять соли тяжелых металлов, лекарственные вещества (морфин, хинин, салицилаты), чужеродные органические соединения (например, красители), небольшое количество воды (100-200 мл), мочевины и мочевой кислоты. Их выделительная функция усиливается при нагрузке организма избыточным количеством различных веществ, а также при заболеваниях почек. При этом значительно возрастает выведение продуктов обмена белков с секретами пищеварительных желез.
Кожа имеет ведущее значение в процессах отдачи организмом тепла в окружающую среду. В коже есть специальные органы выделения — потовые и сальные железы. Потовые железы играют важную роль в выделении воды, особенно в условиях жаркого климата и (или) интенсивной физической работы, в том числе в горячих цехах. Выделение воды с поверхности кожи колеблется от 0,5 л/сут в покое до 10 л/сут в жаркие дни. С потом выделяются также соли натрия, калия, кальция, мочевина (5-10% от общего выводимого из организма ее количества), мочевая кислота, около 2% углекислого газа. Сальные железы секретируют особое жировое вещество — кожное сало, которое выполняет защитную функцию. Оно состоит на 2/3 из воды и 1/3 из неомыляемых соединений — холестерола, сквалена, продуктов обмена половых гормонов, кортикостероидов и др.
Структурно-функциональная единица почек. Строение нефронов. Кровоснабжение почек и нефронов.


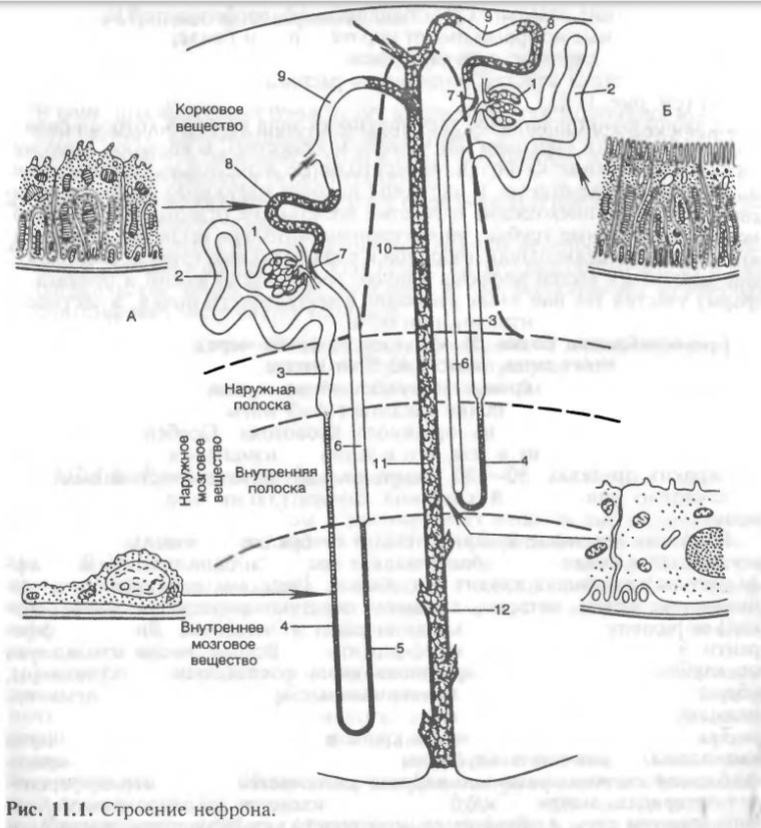

Кровоснабжения почек и нефронов. Юкстагломерулярный аппарат.
В обычных условиях через обе почки, масса которых составляет лишь около 0,43 % от массы тела здорового человека, проходит от 1 /5 до '/4 крови, поступающей из сердца в аорту. Кровоток по корковому веществу почки достигает 5 мл/мин на 1 г ткани; это наиболее высокий уровень органного кровотока. Особенность почечного кровотока состоит в том, что в условиях изменения системного артериального давления в широких пределах (от 90 до 190 мм рт. ст.) он остается постоянным. Это обусловлено специальной системой саморегуляции кровообращения в почке.
Короткие почечные артерии отходят от брюшного отдела аорты, разветвляются в почке на все более мелкие сосуды, и одна приносящая (афферентная) артериола входит в клубочек. Здесь она распадается на капиллярные петли, которые, сливаясь, образуют выносящую (эфферентную) артериолу, по которой кровь оттекает от клубочка. Диаметр эфферентной артериолы уже, чем афферентной. Вскоре после отхождения от клубочка эфферентная артериола вновь распадается на капилляры, образуя густую сеть вокруг проксимальных и дистальных извитых канальцев. Таким образом, большая часть крови в почке дважды проходит через капилляры — вначале в клубочке, затем у канальцев. Отличие кровоснабжения юкстамедуллярного нефрона заключается в том, что эфферентная артериола не распадается на околоканальцевую капиллярную сеть, а образует прямые сосуды, спускающиеся в мозговое вещество почки. Эти сосуды обеспечивают кровоснабжение мозгового вещества почки; кровь из околоканальцевых капилляров и прямых сосудов оттекает в венозную систему и по почечной вене поступает в нижнюю полую вену.
Клубочковая фильтрация. Механизм образования и состав первичной мочи. Регуляция скорости клубочковой фильтрации.
Фильтрация воды и низкомолекулярных компонентов из плазмы крови в полость капсулы происходит через клубочковый, или гломерулярный, фильтр. Гломерулярный фильтр имеет 3 слоя: эндотелиальные клетки капилляров, базальную мембрану и эпителий висцерального листка капсулы, или подоциты. Эндотелий капилляров имеет поры диаметром 50-100 нм, что ограничивает прохождение форменных элементов крови (эритроцитов, лейкоцитов, тромбоцитов). Основным барьером для фильтрации является базальная мембрана. Поры в базальной мембране составляют 3 - 7,5 нм. Эти поры изнутри содержат отрицательно заряженные молекулы (анионные локусы), что препятствует прохождению отрицательно заряженных частиц, в том числе белков. Третий слой фильтра образован отростками подоцитов, между которыми имеются щелевые отверстия, которые ограничивают прохождение альбуминов и других молекул с большой молекулой массой. Эта часть фильтра также несет отрицательный заряд. Легко фильтроваться могут вещества с молекулярной массой более 5500, абсолютным пределом для прохождения частиц через фильтр в норме является молекулярная масса 80 000. Таким образом, состав первичной мочи обусловлен свойствами гломерулярного фильтра. В норме вместе с водой фильтруются все низкомолекулярные вещества, за исключением большей части белков и форменных элементов крови. В остальном состав ультрафильтрата близок по составу к плазме крови.
Основным фактором, способствующим процессу фильтрации, является давление крови (гидростатическое) в капиллярах клубочков. К силам, препятствующим фильтрации, относится онкотическое давление белков плазмы крови и давление жидкости в полости капсулы клубочка, т.е. первичной мочи. Следовательно, эффективное фильтрационное дав-ление представляет собой разность между гидростатическим давлением крови в капиллярах и суммой онкотического давления плазмы крови и внутрипочечного давления:
Рфильтр. = Ргидр. - (Ронк. +Рмочи).
Таким образом, фильтрационное давление составляет:
70 - (30 + 20) = 20 мм рт.ст.
В полость капсулы из капилляров фильтруется вода и все растворенные в плазме вещества, за исключением крупномолекулярных соединений. Неорганические соли, органические соединения, такие, как мочевина, мочевая кислота, глюкоза, аминокислоты и др. свободно проходят в полость капсулы. Белки с высокой молекулярной массой в норме не проходят в полость капсулы и остаются в крови. Жидкость, профильтровавшаяся в полость капсулы, называется первичной мочой. Почки человека за сутки образуют 150 - 180 литров первичной мочи.
Регуляция скорости клубочковой фильтрации.
Скорость клубочковой фильтрации (СКФ) зависит от ряда факторов, в том числе от величины фильтрационного давления в капиллярах клубочка. Фильтрационное давление, в свою очередь определяется величиной гидростатического давления крови в клубочковых капиллярах, которое вследствие механизмов саморегуляции (гломерулотубулярного и миогенного) почечного кровотока поддерживается на относительно постоянном уровне при колебаниях системного артериального давления от 75 до 160 мм рт. ст. (см. выше).
В то же время системные нейроэндокринные воздействия влияют на величину гидростатического давления крови в капиллярах клубочка путем изменения тонуса приносящей и выносящей артериол. Так, при повышении тонуса приносящей ар- териолы, вызываемого эндотелинами или норадреналином и адреналином (в высоких концентрациях) через стимуляцию а-адренорецепторов, количество крови, поступающее в клубочковые капилляры, снижается, гидростатическое давление крови в капиллярах клубочка падает, уменьшается величина фильтрационного давления и СКФ. При уменьшении тонуса гладких мышц приносящих артериол под влиянием оксида азота, про- стагландинов (PGE2 и PGI2) и брадикинина, а также адреналина (действующего на [3-адренорецепторы в малых и средних концентрациях) увеличивается количество крови, поступающей в капилляры клубочков, и СКФ возрастает. При повышении тонуса выносящей артериолы отток крови из клубочковых капилляров замедляется, гидростатическое давление крови в капиллярах клубочка повышается, а фильтрационное давление и СКФ возрастают. Такое избирательное влияние на тонус гладких мышц выносящих артериол оказывает ангиотензин II.
Практически все кровеносные сосуды почек обильно иннервированы постганглионарными нервными волокнами симпатического отдела автономной нервной системы. Значительное повышение тонуса центров симпатической нервной системы (например, при испуге, других стрессовых состояниях) вызывает сужение почечных сосудов, включая приносящие артериолы, и резкое уменьшение кровоснабжения почек и СКФ. Этот механизм лежит в основе существенного снижения или даже угнетения мочеобразования при сильных болевых воздействиях на организм (болевая анурия). Небольшое или умеренное повышение тонуса симпатической нервной системы оказывает незначительное воздействие на кровоток и СКФ в почках.
Локализация реабсорбции веществ в почечных канальцах. Пороговые и беспороговые вещества. Механизмы канальцевой реабсорбции. Регуляция канальцевой реабсорбции.
Различные отделы почечных канальцев отличаются по способности всасывать вещества. С помощью анализа жидкостей из различных частей нефрона были установлены состав жидкости и особенности работы всех отделов нефрона.

Пороговые и непороговые вещества.
Реабсорбция веществ зависит от их концентрации в крови. Порог выведения - та концентрация вещества в крови, при которой оно не может быть полностью реабсорбировано в канальцах и попадает в конечную мочу. Порог выведения разных веществ различен.
Пороговые вещества - это вещества, которые полностью реабсорбируются в почечных канальцах и появляются в конечной моче, только если их концентрация в крови превышает определенную величину. Пороговые - глюкоза реабсорбируется в зависимости от концентрации ее в крови. Глюкоза при повышении ее в крови от 5 до 10 ммоль/л - появляется в моче, аминокислоты, белки плазмы, витамины, ионы Na+Cl_K+Ca+.
Непороговые вещества - которые выделяются с мочой при любой концентрации их в плазме крови. Это конечные продукты обмена подлежащие удалению из организма (н-р инулин, креатинин, диодраст, мочевина, сульфаты).
Механизмы канальцевой реабсорбции.
Обратное всасывание различных веществ в канальцах обеспечивается активным и пассивным транспортом. Если вещество реабсорбируется против электрохимического и концентрационного градиентов, процесс называется активным транспортом. Различают два вида активного транспорта: первично-активный и вторично-активный. Первично-активным транспорт называется в том случае, когда происходит перенос вещества против электрохимического градиента за счет энергии клеточного метаболизма. Примером служит транспорт ионов Na+, который происходит при участии фермента Na+,K+-АТФазы, использующей энергию АТФ. Вторично-активным называется перенос вещества против концентрационного градиента, но без затраты энергии клетки непосредственно на этот процесс; так реабсорбируются глюкоза, аминокислоты. Из просвета канальца эти органические вещества поступают в клетки проксимального канальца с помощью специального переносчика, который обязательно должен присоединить ион Na+. Этот комплекс (переносчик + органическое вещество + Na+) способствует перемещению вещества через мембрану щеточной каемки и его поступлению внутрь клетки. Движущей силой переноса этих веществ через апикальную плазматическую мембрану служит меньшая по сравнению с просветом канальца концентрация натрия в цитоплазме клетки. Градиент концентрации натрия обусловлен непрестанным активным выведением натрия из клетки во внеклеточную жидкость с помощью Na+,К+-АТФазы, локализованной в латеральных и базальной мембранах клетки.
Реабсорбция воды, хлора и некоторых других ионов, мочевины осуществляется с помощью пассивного транспорта —по электрохимическому, концентрационному или осмотическому градиенту. Примером пассивного транспорта является реабсорбция в дистальном извитом канальце хлора по электрохимическому градиенту, создаваемому активным транспортом натрия. По осмотическому градиенту транспортируется вода, причем скорость ее всасывания зависит от осмотической проницаемости стенки канальца и разности концентрации осмотически активных веществ по обеим сторонам его стенки. В содержимом проксимального канальца вследствие всасывания воды и растворенных в ней веществ растет концентрация мочевины, небольшое количество которой по концентрационному градиенту реабсорбируется в кровь. Достижения в области молекулярной биологии позволили установить строение молекул ионных и водных каналов (аквапоринов) рецепторов, аутакоидов и гормонов и тем самым проникнуть в сущность некоторых клеточных механизмов, обеспечивающих транспорт веществ через стенку канальца. Различны свойства клеток разных отделов нефрона, неодинаковы свойства цитоплазматической мембраны в одной и той же клетке.
Клеточный механизм реабсорбции ионов рассмотрим на примере Na+. В проксимальном канальце нефрона всасывание Na+ в кровь происходит в результате ряда процессов, один из которых - активный транспорт Na+ из просвета канальца, другой - пассивная реабсорбция Na+ вслед за активно транспортируемыми в кровь как ионами гидрокарбоната, так и Cl-. При введении одного микроэлектрода в просвет канальцев, а второго - в околоканальцевую жидкость было выявлено, что разность потенциалов между наружной и внутренней поверхностью стенки проксимального канальца оказалась очень небольшой — около 1,3 мВ, в области дистального канальца она может достигать - 60 мВ. Просвет обоих канальцев электроотрицателен, а в крови (следовательно, и во внеклеточной жидкости), концентрация Na+ выше, чем в жидкости, находящейся в просвете этих канальцев, поэтому реабсорбция Na+ осуществляется активно против градиента электрохимического потенциала. При этом из просвета канальца Na+ входит в клетку по натриевому каналу или при участии переносчика. Внутренняя часть клетки заряжена отрицательно, и положительно заряженный Na+ поступает в клетку по градиенту потенциала, движется в сторону базальной плазматической мембраны, через которую натриевым насосом выбрасывается в межклеточную жидкость; градиент потенциала на этой мембране достигает 70-90 мВ. Имеются вещества, которые могут влиять на отдельные элементы системы реабсорбции Na+. Так, натриевый канал в мембране клетки дистального канальца и собирательной трубки блокируется амилоридом и триамтереном, в результате чего Na+ не может войти в канал. В клетках имеется несколько типов ионных насосов. Один из них представляет собой Na+,К+-АТФазу. Этот фермент находится в базальной и латеральных мембранах клетки и обеспечивает транспорт Na+ из клетки в кровь и поступление из крови в клетку К+. Фермент угнетается сердечными гликозидами, например строфантином, уабаином. В реабсорбции гидрокарбоната важная роль принадлежит ферменту карбоангидразе, ингибитором которого является ацетазоламид - он прекращает реабсорбцию гидрокарбоната, который экскретируется с мочой.
Фильтруемая глюкоза практически полностью реабсорбируется клетками проксимального канальца, и в норме за сутки с мочой выделяется незначительное ее количество (не более 130 мг). Процесс обратного всасывания глюкозы осуществляется против высокого концентрационного градиента и является вторично-активным. В апикальной (люминальной) мембране клетки глюкоза соединяется с переносчиком, который должен присоединить также Na+, после чего комплекс транспортируется через апикальную мембрану, т.е. в цитоплазму поступают глюкоза и Na+. Апикальная мембрана отличается высокой селективностью и односторонней проницаемостью и не пропускает ни глюкозу, ни Na+ обратно из клетки в просвет канальца. Эти вещества движутся к основанию клетки по градиенту концентрации. Перенос глюкозы из клетки в кровь через базальную плазматическую мембрану носит характер облегченной диффузии, a Na+, как уже отмечалось выше, удаляется натриевым насосом, находящимся в этой мембране.
Аминокислоты почти полностью реабсорбируются клетками проксимального канальца. Имеется не менее 4 систем транспорта аминокислот из просвета канальца в кровь, осуществляющих реабсорбцию: нейтральных, двуосновных, дикарбоксильных аминокислот и иминокислот. Слабые кислоты и основания могут существовать в зависимости от рН среды в двух формах - неионизированной и ионизированной. Клеточные мембраны более проницаемы для неионизированных веществ. Если значение рН канальцевой жидкости сдвинуто в кислую сторону, то основания ионизируются, плохо всасываются и экскретируются с мочой. Процесс «неионной диффузии» влияет на выделение почками слабых оснований и кислот, барбитуратов и других лекарственных веществ.
Небольшое количество профильтровавшегося в клубочках белка реабсорбируется клетками проксимальных канальцев. Выделение белков с мочой в норме составляет не более 20-75 мг в сутки, а при заболеваниях почек оно может возрастать до 50 г в сутки. Увеличение выделения белков с мочой (протеинурия) может быть обусловлено нарушением их реабсорбции либо увеличением фильтрации.
В отличие от реабсорбции электролитов, глюкозы и аминокислот, которые, проникнув через апикальную мембрану, в неизмененном виде достигают базальной плазматической мембраны и транспортируются в кровь, реабсорбция белка обеспечивается принципиально иным механизмом. Белок попадает в клетку с помощью пиноцитоза. Молекулы профильтровавшегося белка адсорбируются на поверхности апикальной мембраны клетки, при этом мембрана участвует в образовании пиноцитозной вакуоли. Эта вакуоль движется в сторону базальной части клетки. В околоядерной области, где локализован пластинчатый комплекс (аппарат Гольджи), вакуоли могут сливаться с лизосомами, обладающими высокой активностью ряда ферментов. В лизосомах захваченные белки расщепляются и образовавшиеся аминокислоты, дипептиды удаляются в кровь через базальную плазматическую мембрану.
Регуляция канальцевой реабсорбции.
Регуляция канальцевой реабсорбции осуществляется как нервным, так и, в большей мере, гуморальным путем.
Нервные влияния реализуются преимущественно симпатическими проводниками и медиаторами через бета-адренорецепторы мембран клеток проксимальных и дистальных канальцев. Симпатические эффекты проявляются в виде активации процессов реабсорбции глюкозы, ионов натрия, воды и анионов фосфатов и осуществляются через систему вторичных посредников (аденилатциклаза — цАМФ). Нервная регуляция кровообращения в мозговом веществе почки увеличивает или уменьшает эффективность сосудистой противоточной системы и концентрирование мочи. Сосудистые эффекты нервной регуляции также опосредуются через внутри-почечные системы гуморальных регуляторов — ренин-ангиотензиновую, кининовую, простагландины и др.
Основным фактором регуляции реабсорбции воды в дистальных отделах нефрона является гормон вазопрессин, называвшийся ранее антидиуретическим гормоном. Этот гормон образуется в супраоптическом и паравен-трикулярных ядрах гипоталамуса, по аксонам нейронов транспортируется в нейрогипофиз, откуда и поступает в кровь. Влияние вазопрессина на проницаемость эпителия канальцев обусловлено наличием рецепторов к гормону, относящихся к V2-типу, на поверхности базолатеральной мембраны клеток эпителия. Образование гормон-рецепторного комплекса влечет за собой через посредство GS-белка и гуанилового нуклеотида активацию аденилатциклазы и образование цАМФ, активацию синтеза и встраивания аквапоринов 2-го типа («водных каналов») в апикальную мембрану клеток эпителия собирательных трубочек. Перестройка ультраструктур мембраны и цитоплазмы клетки ведет к образованию внутриклеточных специализированных структур, переносящих большие потоки воды по осмотическому градиенту от апикальной к базолатеральной мембране, не позволяя транспортируемой воде смешиваться с цитоплазмой и препятствуя набуханию клетки. Такой трансцеллюлярный транспорт воды через клетки эпителия реализуется вазопрессином в собирательных трубочках. Кроме того, в дистальных канальцах вазопрессин обусловливает активацию и выход из клеток гиалуронидаз, вызывающих расщепление гликозаминогликанов основного межклеточного вещества, тем самым способствуя межклеточному пассивному транспорту воды по осмотическому градиенту.

Канальцевая реабсорбция воды регулируется и другими гормонами (табл. 14.1). По механизму действия все гормоны, регулирующие реабсорбцию воды, делятся на шесть групп:
• повышающие проницаемость мембран дистальных отделов нефрона для воды (вазопрессин, пролактин, хорионический гонадотропин);
• меняющие чувствительность клеточных рецепторов к вазопрессину (паратирин, кальцитонин, кальцитриол, простагландины, альдостерон);
• меняющие осмотический градиент интерстиция мозгового слоя почки и, соответственно, пассивный осмотический транспорт воды (паратирин, кальцитриол, тиреоидные гормоны, инсулин, вазопрессин);
• меняющие активный транспорт натрия и хлорида, а за счет этого и пассивный транспорт воды (альдостерон, вазопрессин, атриопептид, прогестерон, глюкагон, кальцитонин, простагландины);
• повышающие осмотическое давление канальцевой мочи за счет нере-абсорбированных осмотически активных веществ, например глюкозы (контринсулярные гормоны);
• меняющие кровоток по прямым сосудам мозгового вещества и, тем самым, накопление или «вымывание» осмотически активных веществ из интерстиция (ангиотензин-П, кинины, простагландины, паратирин, вазопрессин, атриопептид).
Локализация секреции веществ в почечных канальцах. Механизмы канальцевой секреции. Регуляция канальцевой секреции.


Механизмы канальцевой секреции.
Канальцевая секреция представляет собой преимущественно активный процесс, происходящий с затратами энергии для транспорта веществ против концентрационного или электрохимического градиентов. В эпителии канальцев существуют разные системы транспорта (переносчики) для секреции органических кислот и органических оснований. Это доказывается тем, что при угнетении секреции органических кислот пробенецидом секреция оснований не нарушается.
Транспортные секретирующие механизмы обладают свойством адаптации, т.е. при длительном поступлении вещества в кровоток количество транспортных систем за счет белкового синтеза постепенно увеличивается. Данный факт необходимо учитывать, например, при лечении пенициллином. Так как очищение крови от него постепенно возрастает, требуется увеличение дозировки для поддержания необходимой терапевтической концентрации.
Так как при невысоких концентрациях в крови ПАГ или диодраста они полностью удаляются из крови при однократном прохождении через почку путем секреции клетками проксимальных канальцев, это позволило, определяя клиренс этих веществ, получить значение объема плазмы крови, которое протекает по сосудам коркового вещества почки, т.е. эффективного почечного плазмотока. Зная гематокрит, можно рассчитать и величину коркового кровотока в почке.
Кроме того, канальцевый эпителий синтезирует и секретируют вещества, образующиеся в самих клетках эпителия, например, аммиак (путем дезаминирования некоторых аминокислот), гиппуровую кислоту (из бензойной кислоты и гликокола), которые выделяются с мочой, а также ренин, простагландины, глюкозу почек, поступающие в кровь.
Регуляция канальцевой секреции.
Регуляция канальцевой секреции осуществляется с помощью гормонов и симпатической нервной системы. Эффекты нервной регуляции реализуются за счет изменений кровотока в постгломерулярных капиллярах почки, т. е. транспорта веществ кровью к секретирующим клеткам, и влияния на энергетический обмен в клетках эпителия канальцев. Гормонами, усиливающими проксимальную канальцевую секрецию органических веществ за счет метаболических эффектов, являются соматотропин аденогипофиза, йодсодержащие гормоны щитовидной железы и андрогены
Осмотическое разведение и концентрирование мочи. Функционирование поворотно-противоточной множительной системы.
Итак, после прохождения через проксимальные канальцы канальцевая жидкость поступает в петлю Генле и дистальный сегмент нефрона. С их участием связана одна из важнейших гомеостатических функций почки – осмотическое концентрирование мочи. Дело в том, что почки человека в нормальных условиях, как правило, производят гиперосмотическую по отношению к плазме крови мочу, т.е. работают в режиме концентрирования: осмолярность окончательной мочи колеблется от 600 до 900 мосм/л, т.е. в 3 раза может превышать осмолярность плазмы. Способность почки концентрировать мочу и экономить тем самым воду, возникла в эволюции с выходом животных на сушу, что позволило им перейти из водной среды обитания к наземному образу жизни и продолжить путь эволюционного развития в новом более перспективном направлении.
Рисунок 10 Взаимодействие петли Генле и собирательной
трубки при образовании концентрированной мочи.
В процессе осмотического концентрирования мочи принимают участие: петля Генле, дистальный каналец, собирательная трубка, сосуды и интерстиций мозгового вещества, которые функционируют как единая поворотно - противоточно-множительная система. Мы уже упоминали, что в концентрировании мочи участвуют юкстамедуллярные нефроны с длинными петлями Генле, которые, как и собирательные трубки, глубоко проникают в мозговой слой почки.
Сразу «раскроем карты» - процесс окончательного концентрирования мочи происходит в собирательных трубках, а условия для этого создаются работой всей поворотно – противоточно-множительной системы. Эта система создает гиперосмолярность мозгового вещества и при действии антидиуретического гормона (АДГ) заставляет воду переходить из собирательной трубки в интерстиций, а затем в кровеносные сосуды мозгового вещества, в результате чего образуется концентрированная моча. Ключевым вопросом при осуществлении концентрирования мочи является вопрос о том, каким образом интерстициальная жидкость мозгового вещества становится гиперосмолярной. Попытаемся ответить на него. Следите за нашими рассуждениями по рис.10: из проксимального канальца жидкость, изоосмотическая плазме крови, с концентрацией 300 мосм/л ,поступает в тонкое нисходящее колено петли Генле и, продвигаясь по нему, начинает терять воду; в результате ее осмотическая концентрация прогрессивно нарастает и на изгибе петли в сосочке достигает своего максимума (1400мосм/л). Затем она поворачивает и течет по восходящему колену в противоположном направлении (отсюда название поворотно-противоточная система), при этом происходит ее разбавление и уменьшение осмолярности до 100 мосм/л.Эти процессы обусловлены разными функциональными свойствами стенок этих участков петли: «маховиком» этой системы является толстый восходящий отдел петли, который совершенно непроницаем для воды, но активно реабсорбирует Nа и Cl. В апикальной мембране клеток этого отдела транспорт Nа осуществляется одновременно с ионами К и двумя ионами Cl с помощью Nа, К,2Cl, котранспортера. Через базальную мембрану клеток Nа переносится активно.
NаCl поступает в интерстиций и обуславливает выход воды из нисходящего колена петли, стенки которого, напротив, обладают высокой проницаемостью для воды, но не пропускает ионы Nа. Таким образом, реабсорбция хлорида натрия восходящей частью петли “отвечает” за реабсорбцию воды в нисходящей части. Давайте разберем это сначала на простой схеме (рис.11).
Представим себе, что петля Генле заполнена неподвижной жидкостью, которая поступила из проксимального канальца, тогда осмотическая концентрация в любой части петли Генле равна 300 мосм/л. (1). Теперь допустим (2), что активная транспортная система в восходящей части петли осуществляет реабсорбцию хлорида натрия в интерстициальное пространство до тех пор, пока не установится предельный градиент (скажем 200 мосм/л) между жидкостью, находящейся в восходящем колене петли Генле и жидкостью интерстициального пространства. Вспомните, что стенки этой части петли непроницаема для воды.
Обратите внимание на то, что теперь существует разница в осмолярности между жидкостью в нисходящем колене (300 мосм/л) и окружающей каналец интерстициальной жидкостью (400 мосм/л). Поскольку стенки нисходящего колена петли хорошо проницаемы для воды, вода пассивно выходит из его просвета в интерстициальное пространство, в котором существует более высокая осмолярность, возникшая вследствие реабсорбции хлорида натрия в восходящем колене, и осмолярность жидкости в нисходящем колене увеличивается до 400 мосм/л. (3).
Теперь усложним схему: пусть жидкость в петле не стоит на месте, а непрерывно движется, тогда по мере продвижения вниз по нисходящему колену из нее уходит все больше воды, концентрация внутриканальцевой жидкости все больше увеличивается и, поскольку устанавливается осмотическое равновесие, концентрация интерстициальной жидкости увеличивается на ту же величину (200 мосм/л). Градиент в 200 мосм/л, так называемый поперечный или горизонтальный градиент, поддерживается на каждом из «этажей» мозгового вещества.
Рисунок 11 Схема взаимодействия нисходящего и восходящего колена в процессе концентрирования канальцевой жидкости.
Таким образом, между соседними участками нисходящего и восходящего колена разность осмотической концентрации невелика, но по ходу петли и длине почечного сосочка – по вертикали – этот одиночный эффект нарастает, суммируется (умножается), и в результате формируется значительно больший перепад осмотического давления – так называемый корково-сосочковый вертикальный осмотический градиент.
300 мосм/л кора
60![]() 0
мосм/л
0
мосм/л
900 мосм/л
1200 мосм/л
1400 мосм/л сосочек
Теперь Вам понятно, почему система называется ещё и множительная. Таким образом, нисходящее и восходящее колено петли тесно соприкасаются друг с другом, расположены параллельно, оказывают друг на друга влияние и функционируют как единый сопряженный механизм – противоточно-поворотно-множительная система. Благодаря работе этой системы в интерстиции мозгового вещества создается корково-сосочковый осмотический градиент.
Следует отметить, что осмолярность интерстиция создается не только ионами хлорида натрия. Примерно половина осмолярности обусловлена присутствием в нем мочевины. У мочевины имеется свой кругооборот в почке, в частности из собирательной трубки она пассивно диффундирует в интерстиций мозгового вещества и тем самым, увеличивает его осмолярность.
Прямые сосуды мозгового вещества, подобно коленам петли Генле, тоже образуют поворотно-противоточную систему. Они расположены параллельно петлям Генле и в них происходят такие же изменения осмолярности, что и в петле. Это сохраняет продольный осмотический градиент в мозговом веществе, не позволяя ему вымываться.
Вернемся к нашим рассуждениям.
Приступая к изучению работы концентрирующего механизма почки, мы поставили перед собой задачу выяснить, каким образом в интерстиции мозгового вещества создается зона гиперосмолярности, и решили её. Но пока мы не решили проблему концентрирования мочи, которую поставили перед почкой: по мере того, как канальцевая жидкость двигалась по нисходящему колену, ее осмолярность нарастала и в районе изгиба достигала 1400 мосм/л, так же как и осмолярность интерстиция, но по мере движения по восходящему колену она вновь разбавилась до 100 мосм/л. Далее в дистальном канальце происходит реабсорбция NаCl, воды и др. веществ и осмотическая концентрация вновь становится – 300 мосм/л, но по-прежнему канальцевая жидкость изосмотична крови,т.е.,в петле концентрирование не произошло. А где же будет образовываться концентрированная моча?
Помните, мы вначале “раскрыли карты”. Да, решающим обстоятельством станет то, что из дистального канальца жидкость поступает в собирательную трубку, где и будет происходить формирование окончательной мочи и процесс ее концентрирования. Неслучайно собирательные трубки расположены параллельно петлям Генле и прямым сосудам. Они транзитом проходят через все зоны почки и на всем протяжении окружены интерстицием с прогрессивно нарастающим в направлении от коры к сосочку осмотическим давлением. Обратите внимание на рисунок 10, осмолярность интерстициальной жидкости на каждом уровне идентична этой величине в нисходящем колене и СТ. Другими словами вокруг СТ на каждом “этаже” мозгового вещества имеется горизонтальный осмотический градиент в 200 мосм/л, а по вертикали - мощный корково-сосочковый осмотический градиент, созданный поворотно - противочной системой петли Генле. Таким образом, можно сказать, что петля Генле «работает» на собирательную трубку, создавая в интерстиции мозгового вещества зону гиперосмии. Это и будет та сила, которая способна вытянуть воду из собирательной трубки и произвести концентрирование мочи. Когда канальцевая жидкость поступает в собирательную трубку, ее осмолярность находится на том же уровне, что и осмолярность интерстициальной жидкости в этой зоне почки. В районе сосочка величина осмолярности достигает максимума (у человека она равна 1400 мосм/л), поэтому максимальная осмотическая концентрация мочи у человека тоже может достигать 1400 мосм/л.
Система поворотно-противоточная
— физиологический механизм реабсорбции воды и ионов натрия в петле нефрона, основанный на различной проницаемости для них стенок восходящего и нисходящего колен петли и заключающийся в том, что реабсорбция воды в восходящем колене способствует реабсорбции натрия в нисходящем и наоборот.
Роль почек в осморегуляции и волюморегуляции.
Роль почек в осморегуляции.
Почки являются основным эффекторным органом системы осморегуляции. Они обеспечивают выделение избытка воды в виде гипотонической мочи при поступлении воды в организм или экономят воду и экскретируют мочу, гипертоническую по отношению к плазме крови, при обезвоживании. При избыточном содержании воды в организме концентрация растворенных осмотически активных веществ в крови снижается и ее осмотическое давление падает. Это уменьшает активность центральных осморецепторов, расположенных в области супраоптического ядра гипоталамуса, а также периферических осморецепторов, имеющихся в печени, почке, селезенке и ряде других органов. Уменьшение активности осморецепторов снижает секрецию антидиуретического гормона (АДГ) нейрогипофизом и приводит к возрастанию выделения воды почкой
При обезвоживании организма, при введении в сосудистое русло гипертонического раствора хлористого натрия увеличивается концентрация осмотически активных веществ в плазме крови, возбуждаются осморецепторы, стимулируются нейроны супраоптического ядра, усиливается секреция АДГ, возрастает реабсорбция воды в канальцах, уменьшается мочеотделение и выделяется осмотически концентрированная моча. Установлено, что у человека в норме при осмоляльности крови около 280 мосм/кг H2O полностью прекращается секреция АДГ и почка выделяет наибольшие количества воды. При обезвоживании когда осмоляльность крови возрастает до 295 мосм/кг Н2О, секреция АДГ достигает максимума и обнаруживается пик осмотического концентрирования мочи в почке. В эксперименте показано, что секреция АДГ возрастает при раздражении не только осморецепторов, но и специфических натриорецепторов. После введения в область III желудочка мозга гипертонического раствора NaСl наступает антидиурез, а после введения в ту же область гипертонических растворов сахара мочеотделение не уменьшается.
Осморецепторы реагируют на сдвиги концентрации осмотически активных веществ в плазме крови. При увеличении осмоляльности плазмы крови на 1% (около 3 мосм/л) концентрация аргинин—вазопрессина, являющегося антидиуретическим гормоном у человека и многих других млекопитающих, возрастает на 1 пг/мл плазмы. Повышение концентрации осмотически активных веществ в плазме на 1 мосм/кг воды вызывает благодаря выделению АДГ увеличение осмотической концентрации мочи почти на 100 мосм/кг H2O, а переход от состояния водного диуреза до максимального осмотического концентрирования мочи требует всего 10—кратного возрастания АДГ в крови — с 0,5 до 5 пг/мл.
Роль почек в волюморегуляции.
Помимо информации от осморецепторов и натриорецепторов уровень секреции АДГ зависит и от активности волюморецепторов, реагирующих на изменение объема внутрисосудистой и внеклеточной жидкости. Ведущее значение в регуляции секреции АДГ имеют те волюморецепторы, которые реагируют на изменение напряжения сосудистой стенки. В первую очередь это рецепторы левого предсердия, импульсы от которых передаются в ЦНС по афферентным волокнам блуждающего нерва. При увеличении кровенаполнения левого предсердия активируются волюморецепторы и угнетается секреция АДГ, тем самым усиливается мочеотделение. В предсердии вырабатывается гормон, увеличивающий выделение ионов Na+ почкой и получивший название атриальный натрийуретический пептид.
Рассмотрим особенности реакции почки при возбуждении волюморецепторов и осморецепторов. Активация только волюморецепторов возникает в ответ на увеличение объема внутрисосудистой жидкости при неизмененной концентрации в ней осмотически активных веществ. Это приводит к повышению экскреции солей натрия и воды. Одновременная активация волюморецепторов и осморецепторов может наступить при потреблении больших количеств воды, в этом случае в основном усиливается выведение воды. Ведущую роль в изолированном осморегулирующем рефлексе играет уменьшение секреции АДГ, в результате снижается реабсорбция воды и усиливается ее экскреция.
Увеличение объема внеклеточной жидкости, возрастание объема крови служат стимулом для волюморегулирующего рефлекса. В эксперименте адекватным раздражителем системы регуляции объема внеклеточной жидкости может служить введение в кровеносный сосуд больших количеств изотоничного плазме крови физиологического раствора. Возрастание притока крови к сердцу, растяжение стенки предсердия стимулируют волюморецепторы и секрецию из клеток предсердия атриального натрийуретического пептида. Под влиянием этого гормона усиливается выделение ионов натрия и воды почкой.
Стимуляция волюморецепторов рефлекторно изменяет характер импульсации иннервирующих почку симпатических нервов и снижает реабсорбцию натрия и воды в канальцах. Возрастание объема крови способствует растяжению афферентной артериолы клубочка. Это сопровождается изменением активности юкстагломерулярного аппарата, уменьшением секреции фермента ренина, благодаря чему снижается образование в крови из ангиотензиногена ангиотензина I. После отщепления от него двух аминокислот образуется ангиотензин II, который вызывает ряд эффектов, в том числе стимулирует секрецию альдостерона. Когда снижается количество ангиотензина, падает и поступление в кровь альдостерона, что приводит к уменьшению реабсорбции натрия в канальцах. Активация волюморегулирующего рефлекса снижает секрецию вазопрессина, тем самым уменьшается реабсорбция воды и повышается ее выделение почкой.
Роль почек в регуляции ионного состава и кислотно-основного состояния крови.
Роль почек в регуляции ионного состава крови.
Почки являются эффекторным органом системы ионного гомеостаза. В организме существуют системы регуляции баланса каждого из ионов. Рефлекторная регуляция транспорта ионов в почечных канальцах осуществляется как периферическими, так и центральными нервными механизмами.
Регуляция реабсорбции и секреции ионов в почечных канальцах осуществляется несколькими гормонами. Реабсорбция натрия возрастает в конечных частях дистального сегмента нефрона и собирательных трубочках под влиянием гормона коркового вещества надпочечника альдостерона. Этот гормон выделяется в кровь при уменьшении концентрации натрия в плазме крови и уменьшении объема циркулирующей крови. В усилении выделения натрия почкой участвует натрийуретический гормон, одним из мест образования которого является предсердие. При увеличении объема циркулирующей крови, повышении объема внеклеточной жидкости в организме усиливается секреция в кровь этого пептидного гормона.
Секрецию калия в дистальном сегменте и собирательных трубочках усиливает альдостерон. Инсулин уменьшает выделение калия. Алкалоз сопровождается усилением выделения калия, а при ацидозе калийурез уменьшается.
При уменьшении концентрации кальция в крови паращитовидные железы выделяют паратгормон, который способствует нормализации уровня кальция в крови, в частности благодаря увеличению его реабсорбции в почечных канальцах и высвобождению из кости. При гиперкальциемии стимулируется выделение в кровь клетками щитовидной железы кальцитонина, который способствует уменьшению концентрации Са2+ в плазме крови благодаря увеличению экскреции почкой и переходу Са2+ в кость.
Роль почек в регуляции кислотно-основного состояния .
Почки участвуют в поддержании постоянства концентрации Н+ в крови, экскретируя кислые продукты обмена. Активная реакция мочи у человека и животных может очень резко меняться в зависимости от состояния кислотно-основного состояния организма. Концентрация Н+ при ацидозе и алкалозе различается почти в 1000 раз, при ацидозе рН может снижаться до 4,5, при алкалозе — достигать 8,0. Это способствует участию почек в стабилизации рН плазмы крови на уровне 7,36. Механизм подкисления мочи основан на секреции клетками канальцев Н+.
Секреция Н+ создает условия для реабсорбции вместе с гидрокарбонатом равного количества Na+. Наряду с натрий-калиевым насосом и электрогенным натриевым насосом, обусловливающим перенос Na+ с С1- реабсорбция Na+ с гидрокарбонатом играет важную роль в поддержании натриевого баланса. Фильтрующийся из плазмы крови гидрокарбонат соединяется с секретированным клеткой Н+ и в просвете канальца превращается в СО2. Образование Н+ происходит следующим образом. Внутри клетки вследствие гидратации СО2 образуется Н2СО3 и диссоциирует на Н+ и НСО3-. В просвете канальца Н+ связываются не только с HCO3-, но и с такими соединениями, как двузамещенный фосфат (Na2HPO4), и некоторыми другими, в результате чего увеличивается экскреция титруемых кислот (ТА- ) с мочой. Это способствует выделению кислот и восстановлению резерва оснований в плазме крови.
При питании мясом образуется большее количество кислот и моча становится кислой, а при потреблении растительной пищи рН сдвигается в щелочную сторону. При интенсивной физической работе из мышц в кровь поступает значительное количество молочной и фосфорной кислот и почки увеличивают выделение «кислых» продуктов с мочой.
Инкреторная функция почек. Роль почек в регуляции эритропоэза и гемостаза.
Основным веществом, образующимся в эпителиоидных клетках юкстагломерулярного аппарата и обладающим гормональной активностью, является ренин. Он играет роль ключевого компонента ренин-ангиотензин-альдостероновой системы, обеспечивающей в физиологических условиях регуляцию артериального давления. Ренин имеет существенное значение в генезе артериальной гипертензии. Под влиянием ангиотензина в гипоталамусе повышается секреция АДГ.
В тесной связи с ренин-ангиотензин-альдостероновой системой в почках функционируют простагландины и калликреин-кининовая система. Терапия нестероидными противовоспалительными препаратами, блокирующими синтез простагландинов, сопровождается задержкой [Na+] в организме. Эффект ингибиторов синтеза простагландинов проявляется преобладанием вазоконстрикции приносящей артериолы и снижением клубочковой фильтрации. Имеются указания, что при патологии печени в почках продукция простагландинов снижена.
Кинины почек проявляют свой вазодилататорный эффект на уровне афферентных артериол, увеличивая почечный кровоток и гломерулярную фильтрацию. Суммарный эффект в почках проявляется увеличением диуреза и натрийуреза.
В организме человека эритропоэтин продуцируется только тканями почек и печени, причем в норме, в отсутствие анемии, он образуется только в почках (корковое вещество и наружная часть мозгового слоя). В печени (гепатоциты и клетки Купфера) продукция эритропоэтина происходит только при тяжелой гипоксии и снижении образования его в почках.
Основным стимулом для образования эритропоэтина является гипоксемия и гипоксия почечной паренхимы. Почечные хеморецепторы расположены в эндотелиальных клетках перитубулярных капилляров и венул проксимальных канальцев. Они реагируют на рО2 венозной крови в отличие от рецепторов синокаротидной зоны, контролирующих рО2 артериальной крови. При любом снижении рО2 венозной крови (повышение сродства кислорода к гемоглобину, низкое рО2 при анемиях и метгемоглобинемиях, высокая потребность тканей в кислороде при тиреотоксикозе) всегда активируется продукция эритропоэтина. Сигналом для повышения продукции эритропоэтина являются ПГ I2 и E2. Секреция эритропоэтина снижается при повышении рО2 венозной крови (нормобарическая или гипербарическая оксигенация, гипертрансфузионная полицитемия, снижение метаболизма у пациентов с гипопитуитаризмом и гипотиреозом).
Эритропоэтин облегчает переход унипотентных эритроидных предшественников в эритрон, стимулирует пролиферацию и созревание эритропоэтинчувствительных клеток. Степень чувствительности эритроидных предшественников к эритропоэтину обратно пропорциональна зрелости субпопуляции предшественников.
У больных с уремией в крови повышается содержание ингибитора эритропоэтина, а продукция самого эритропоэтина вследствие деструкции паренхимы почек резко снижается. Компенсаторно клетки печени начинают продуцировать эритропоэтин, поэтому снижение продукции эритропоэтина почками непропорционально степени анемии при уремии.
В почках вырабатывается тканевой активатор плазминогена урокиназа. Она расщепляет плазминоген до плазмина и тем самым определяет фибринолитическую активность канальцевой жидкости. Необходимость дополнительного фибринолитического фермента в почках обусловлена интенсивной перфузией и необходимостью предотвратить чрезмерное образование фибрина в сосудах почек. Содержание урокиназы в моче прямо пропорционально продукции ее в почках.
Роль почек в регуляции эритропоэза и гемостаза.
Эритропоэтин, секретируемый тубулярными и перитубулярными клетками почек, является гуморальным регулятором эритропоэза. Небольшое количество гормона (10—15 %) вырабатывается в макрофагах костного мозга, купферовских клетках и гепатоцитах. В почках синтез и секреция эритропоэтина определяются уровнем обеспечения кислородом их тканей. К уровню кислорода в почечной ткани чувствителен гемсодержащий белок- цитохром b , входящий составной частью в НАДФ-зависимую оксидазу пери- и тубулярных клеток. При нормальном уровне р02 в ткани почки радикалы кислорода, продукцируемые оксидазой, прежде всего перекись водорода, препятствуют формированию в почечной ткани «индуцируемого гипоксией фактора-1 (ИГФ-1)», стимулирующего транскрипцию эритропоэтиновой иРНК и синтез эритропоэтина. При снижении кислородного обеспечения ткани почек (р02 до 20—40 мм рт. ст.) продукция оксидазой перекиси водорода уменьшается. Нарастает активация ИГФ-1 в цитозоле и его перемещение в ядро клетки, где ИГФ-1 специфически связывается с ДНК, вызывая экспрессию гена эритропоэтина.
Гипоксия почечных структур активирует также ферменты (фосфолипаза А2), ответственные за синтез простагландинов (E1 и Е2), которые через систему «аденилатциклаза—цАМФ» также усиливают синтез эритропоэтина в пери- и тубулярных клетках почек. Адреналин и норадреналин через (b2-адренорецепторы синтезирующих эритропоэтин клеток почек и систему вторичных посредников в них — цАМФ и цГМФ — вызывают усиление синтеза и секреции эритропоэтина в кровь. При гипоксии почечной ткани количество эритропоэтина возрастает в 1000 раз и более при норме 0,01—0,08 ME (международных единиц)/мл плазмы. При гематокрите, равном 40—45, количество эритропоэтина составляет 5—80 мМЕ/мл, а при гематокрите, равном 10—20 (его уменьшение может быть вызвано острой кровопотерей, гемолизом эритроцитов),— 1—8 МЕ/мл плазмы. Эритропоэтин тормозит апоптоз, регулирует пролиферацию и дифференциацию КОК-Э, про- и эритробластов, ускоряет синтез гемоглобина в эритроидных клетках и ре-тикулоцитах, «запускает» в чувствительных к нему клетках синтез эритро-поэтиновой иРНК и энзимов, участвующих в формировании гема и глобина, цитоскелета эритроцитов, увеличивает кровоток в эритропоэтической ткани костного мозга и выход в кровь ретикулоцитов. Наконец, катехола-мины через b-адренорецепторы КОК-Э также усиливают пролиферацию эритроидных клеток-предшественниц.
Продукция эритропоэтина почками угнетается при повышенном образовании в организме человека опухоль-некротизирующего фактора а, интерлейкинов-1а и 1(3, интерферонов а, (3 и у, что имеет место, например, у больных с хроническими паразитарной и бактериальной инфекциями, при ревматоидном артрите, так как перечисленные вещества тормозят синтез эритропоэтина в клетках почек. В результате у больных развивается анемия вследствие сниженной продукции почками эритропоэтина.
Гемостаз
Почки имеют отношение к процессам свертывания крови и фибринолиза. Они синтезируют вещества, которые влияют на все звенья гемостаза: сосудисто-тромбоцитарный, свертывание крови и фибринолиз. Прежде всего, почки являются регуляторами сосудисто-тромбоцитарного гемостаза. Очевидно, это очень важно для деятельности самих почек. Они содержат (и могут выделять в кровоток) различные простагландины (в том числе и простациклин), имеющие непосредственное отношение, как активации, так и торможению агрегации тромбоцитов.
Их отношение к свертыванию крови связано как с непосредственной продукцией ее отдельных факторов (например, тромбопластина), так и в связи с выделением избытка факторов свертывания, накапливающихся в ней (например, продукты деградации фибрина и другие).
Особонно важное значение почек в регуляции фибринолиза. Из почек выделен естественный активатор плазминогена – урокиназа. Этот активатор плазминогена получают из мочи для лечения тромбозов, тромбоэмболических заболеваний, тромботической болезни.
Непроизвольная и произвольная регуляция мочеиспускания.
Мочеиспускание –рефлекторный процесс. Один из простейших рефлексов, регулируемый на уровне спинного мозга. Центр рефлекса мочеиспускания находится в нижней части спинного мозга. Реагирует на импульсы, идущие от рецепторов растяжения в стенках мочевого пузыря.
Растяжение стенок мочевого пузыря вызывает раздражение рецепторов, которые посылают импульсы в центр мочеиспускания. В результате его воздействия стенки мочевого пузыря сокращаются, сфинктеры расслабляются, и происходит акт мочеиспускания.
Спинномозговой центр находится под контролем ЦНС – коры больших полушарий. Поэтому человек способен сознательно задерживать мочеиспускание или сознательно его усиливать. Поэтому, говорят о непроизвольном и произвольном мочеиспускании.
