
- •Ферменты. Номенклатура. Классификация ферментов
- •6 Билет
- •3. Пигмент билирубин????
- •3) Молекулярные механизмы патогенеза острого панкреатита.
- •14 Билет
- •2) Функции сосудистого эндотелия, субэндотелия, тромбоцитов.
- •3) Диагностика панкреатита.
- •16 Билет.
- •3 Метаболические механизмы алкоголизма.
- •3) Моногенные заболевания.
- •3) Полиморфизм гена апобелка е, клиническое значение.
- •21 Билет
- •2. Особенности метаболизма и энергетического обмена в клетках поперечно-полосатой мускулатуры и миокарда.
- •2) Характеристика и роль фибриллярных и регуляторных белков в процессе мышечного сокращения. Механизм мышечного сокращения, этапы. Роль ионов кальция в реализации механизма мышечного сокращения.
- •2. Кальцитриол: химическая природа, этапы синтеза, механизм действия, органы-мишени, биологические эффекты. Представление о заболевании «рахит».
- •26 Билет
- •2) Адреналин- химическая природа, органы мишени, биологические эффекты.
- •3) Моноклональные антитела, препараты на их основе против опухолей.
- •27 Билет
- •1. Понятие о процессах катаболизма и анаболизма. Функции клеточного метаболизма. Стадии генерирования энергии по Кребсу.
- •2. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •3. Вектор иммуноконъюгата. Вещества, используемые в качестве векторов адресной доставки.
- •2.Типы переваривания*. Функции жкт как пищеварительно-транспортного конвейера*. Функции слюны*. Функции жёлчных кислот*.
- •3.Эпидермальнвй фактор роста и а-фетопротеин : их использование в качестве векторов.
- •1) Биосинтез триацилглицеринов (таг): последовательность реакций, субстраты, ферменты. Особенности синтеза в печени, жировой ткани, энтероцитах. Регуляция процесса.
- •3) Понятие о рекомбинантных днк.
- •2) Неферментативные системы антирадикальной защиты и их физиологическое значение.
- •2. Действие первичных и вторичных продуктов перекисного окисления на мембраны и другие структуры.
- •3. Действие наркотиков. Дофаминовая система.
- •1. Разобщители цпэ.
- •2. Пути обезвреживания аммиака.
- •3. Теломеразная активность.
- •38 Билет
3 Метаболические механизмы алкоголизма.
системные поражения, которые вызывает в организме алкоголь: расстройство метаболизма (углеводного, липидного и белкового) и расстройства в нейромедиаторной системе (изменения содержания ацетилхолина и катехоламинов).
В окисление включается никотинадениндинуклеотид (НАД), что влечет за собой нарушение равновесия во многих цепях метаболизма. Привлечение ацетил-Ко-А вызывает нарушение цикла Кребса, в котором коэнзим служит субстратом. Углерод из молекулы этанола включается в синтез углеводов, жиров и белков, нарушая естественное течение этого синтеза; кроме того, молекулы этанола замещают жиры и углеводы в энергетическом обмене, вторично тем самым нарушая метаболизм этих основных субстанций.
Задача: Больной, проживающий в местности с дефицитом йода, обратился с жалобами на зябкость, «отсутствие энергии» для занятий спортом. При обследовании зафиксирована брадикардия, обнаружено увеличение щитовидной железы (зоб). Химический элемент йод, в виде йодид-аниона, а также аминокислота тирозин необходимы для биосинтеза тиреоидных гормонов. Приведённый симптомы отражают их дефицит и попытку компенсации за счёт разрастания железистой ткани щитовидной железы (зоб).
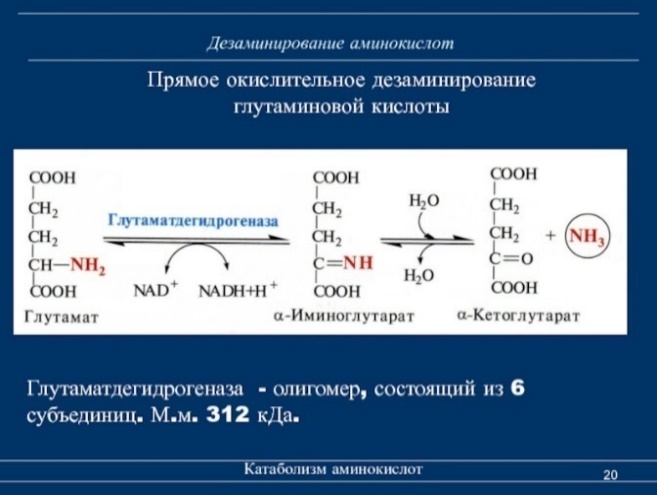
Билет 17 1) Окислительное дезаминирование (прямое, непрямое) аминокислот. Схема процесса, стадии, ферменты. Биологическое значение процесса.
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное).
Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН.
Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных).
В печени реакция используется для получения аммиака из его транспортной формы глутаминовой кислоты. Далее аммиак входит в реакции синтеза мочевины.
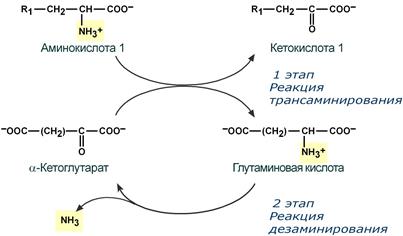
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз (трансаминирование). В качестве конечной кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат ("аминокислота 2"). В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О.
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование.
Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Этот этап осуществляется глутаматдегидрогеназой, которая имеется в митохондриях всех клеток организма, кроме мышечных.
 Учитывая
тесную связь обоих этапов, непрямое
окислительное дезаминирование называют
трансдезаминирование.
Учитывая
тесную связь обоих этапов, непрямое
окислительное дезаминирование называют
трансдезаминирование.
Если реакция прямого дезаминирования идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза. Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
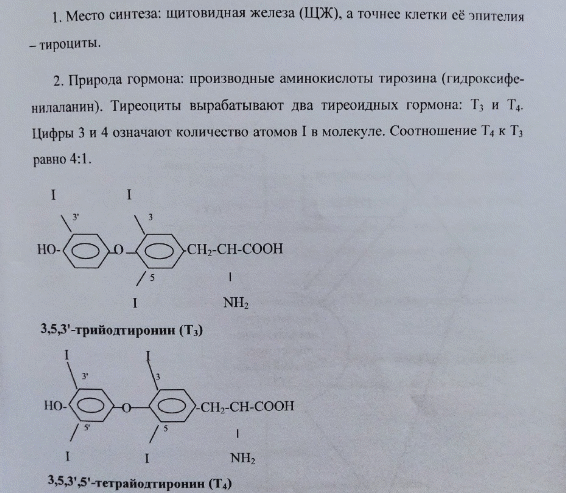
Гормоны щитовидной железы: химическая природа и структура, этапы биосинтеза.
*Место синтеза: щитовидная железа, клетки ее эпителия – тироциты. Природа гормона: производные аминок-ты тирозина (гидроксифенилаланина). Тиреоциты вырабатывают два тиреоидных гормона: Т4 и Т3 (соотношение 4:1).
** 1) Включение I- в Щит.Ж. I- поступает с пищей и водой. 25-30% захватывает ЩЖ. Транспорт I- в клетки происходит при участии Na+\K+-АТФазы против выского градиента концентрации. Непоглощенный из крови I- выводится с мочой.
2) Йодирование или органификация йода. Окисление I-: происходит при участии участии гемсодержащей тирпероксидазы и H2O2 в кач-ве окислителя.
Йодирование тирозина и образование йодтиронинов: сначала синтезируется белок тиреоглобулин, потом осуществляется йодирование радикалов тирозина этого белка. Тиреоглобулин синтезируется в тиреоцитах и путем экзоцитоза секретируется во внеклеточный коллоид, где происходит йодирование остатков тирозина и образование йодтиронинов. Гипойодит взаимодействует с остатками тирозина в молекуле тиреоглобулина с образованием йодтиреоглобулина.
Конденсация с образованием Т3 и Т4: конденсация 2 молекул дийодтирозина с образованием Т4 или МИТ и ДИТ с образованием Т3 происходит в составе молекулы йодтиреоглобулина (фермент – тиреопексидаза). Протеолиз и секреция тиреоидных гормонов: йодтиреглобулин транспортируется из коллоида в фолликулярную клтеку (тиреоцит) путем эндоцитоза. Там он гидролизуется ферментами лизосом с освобождением Т3 и Т4.
3) Метаболизм этанола.
![]() На
каждой стадии происходит отщепление
Н+ и восстанавливается НАД и НАДФ. Пир
высоких дозах алкоголя отношение НАД
+ Н+\НАД+ увеличивается. Ацетальдегид,
концентрация ктрг растет, ингибирует
НАДН+-дегидрогеназу митохондриальной
цепи переноса электронов. Снижается
окисление интермедиаторов цикла,
происходит ингибирирование трех
биохимических путей в печени (ЦПЭ, цикл
Кребса, глюконеогенез) и двух в сердце
(ЦПЭ, цикл Кребса).
Задача.
Больной
жалуется на неутолимую жажду. Суточный
объём мочи – 4,5 л, плотность – 1004
кг/м3.
Глюкоза и кетоновые тела в моче не
обнаружены. У
больного – несахарный диабет, при
котором нарушается концентрационная
функция почек вследствие нехватки
антидиуретического гормона (вазопрессина).
На
каждой стадии происходит отщепление
Н+ и восстанавливается НАД и НАДФ. Пир
высоких дозах алкоголя отношение НАД
+ Н+\НАД+ увеличивается. Ацетальдегид,
концентрация ктрг растет, ингибирует
НАДН+-дегидрогеназу митохондриальной
цепи переноса электронов. Снижается
окисление интермедиаторов цикла,
происходит ингибирирование трех
биохимических путей в печени (ЦПЭ, цикл
Кребса, глюконеогенез) и двух в сердце
(ЦПЭ, цикл Кребса).
Задача.
Больной
жалуется на неутолимую жажду. Суточный
объём мочи – 4,5 л, плотность – 1004
кг/м3.
Глюкоза и кетоновые тела в моче не
обнаружены. У
больного – несахарный диабет, при
котором нарушается концентрационная
функция почек вследствие нехватки
антидиуретического гормона (вазопрессина).
Билет 18.
1) Декарбоксилирование аминокислот*. Биологическое значение**. Продукты и их судьба.
*Декарбоксилирование – процесс отщепления карбоксильной группы аминокислот в виде СО2.

Альфа-декарбоксилирование: печень, почки, мозг, кишечник. Приводит к образованию биогенных аминов (биологических активных веществ, гистамин, гамма-аминомасляная кислота). Ферменты – декарбоксилазы аминокислот. Простетическая группа – пиридоксальфосфат (производное витамина В6).
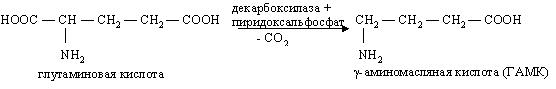
***Например, гамма-аминомасляная кислота принимает участие в обменных процессах, происходящих в головном мозге, является нейромедиатором.
** Реакции необратимы - приводят к необратимому распаду аминокислот. Образуется значительное количество СО2 - конечного продукта метаболизма, который выводится из организма. Образуются амины, которые обладают высокой биологической активностью. Поэтому такие амины называют биологически активными или биогенными аминами. Они являются медиаторами, с помощью которых сигнал передается от одной клетки к другой и от одной молекулы к другой.
2) Альдостерон: химическая природа, механизм действия, органы-мишени, биологические эффекты.
Гормон коры надпочечников. Мех.дей-я: внутриклеточный. Органы-мишени: почки, слюнные железы, желудочно-кишечный тракт, миокард. Стимулы биосинтеза и секреции А.: недостаток ионов Na\избыток ионов K в плазме крови, действие Адренокортикотропного г-на.
Биолог.эфф-ты: способность регулировать обмен Na; усиливает обратное всасывание его в почках, слюнных ж. и ЖКТ. Потенцирует эфф-ты катехоламинов и оказывает на сердце положительное инотропное дей-е. Высокие конц-ии А. в плазме крови вызывают снижение секреции ренина почками за счет угнетения баро- и натриевых рецепторов.
