
- •2. Инозитолтрифосфат и даг:
- •3.ЦГмф:
- •4.Проникновение гидрофобных гормонов в клетку:
- •3) Маркеры заболеваний бронхолёгочной системы. Механизмы повреждающего действия полимеров α1-антитрипсина.
- •2.Репарация днк. Этапы репарации. Дефекты репарации.
- •2.Катаболизм пиримидиновых нуклеотидов
- •Первый этап:
- •Второй этап:
- •Третий этап:
- •2.Рецепторзависимый сигнальный путь
Билет 20
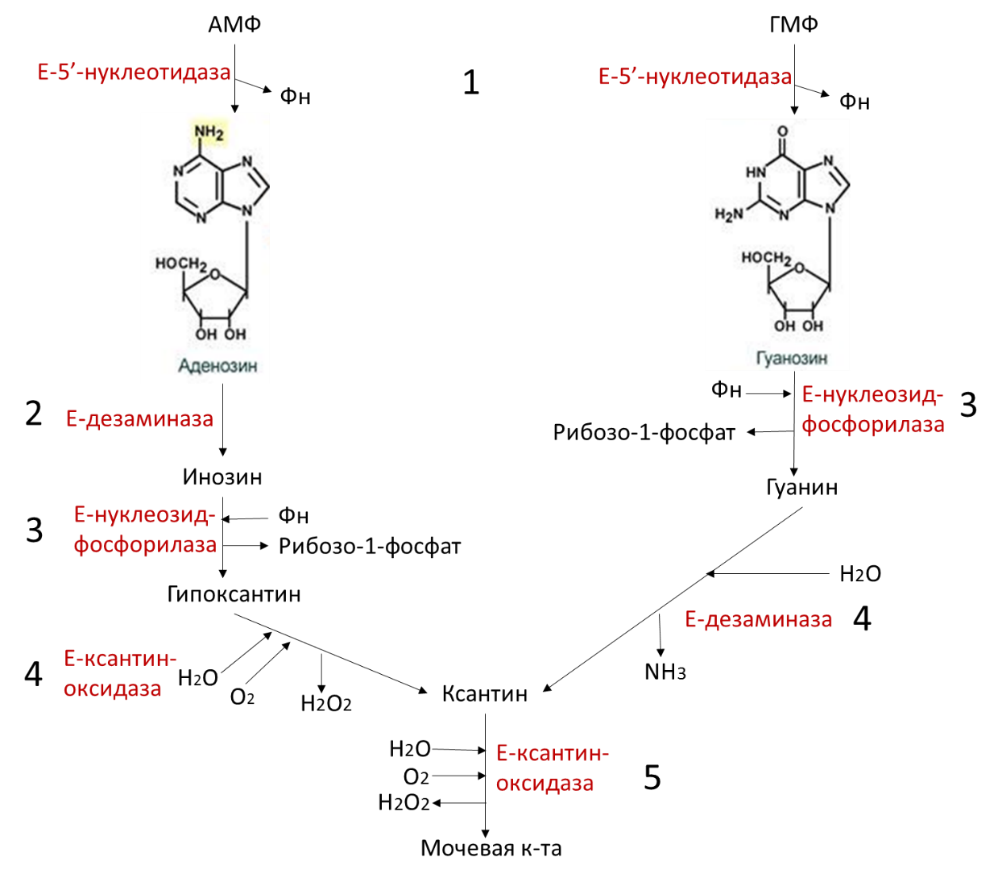
1) Катаболизм пуриновых нуклеотидов. Резервные пути реутилизации пуриновых нуклеотидов. Подагра. Пурины распадаются с образованием мочевой кислоты.
Наиболее активно катаболизм пуринов идет в печени, тонком кишечнике (пищевые пурины) и почках.
Реакции катаболизма пуринов:
5 стадий:
1. Дефосфорилирование АМФ и ГМФ – фермент 5'-нуклеотидаза.
2. Гидролитическое отщепление аминогрупы от С6 в аденозине – фермент дезаминаза. Образуется инозин.
3. Удаление рибозы от инозина (с образованием гипоксантина) и гуанозина (с образованием гуанина) с ее одновременным фосфорилированием – фермент нуклеозидфосфорилаза.
4. Окисление С2 пуринового кольца: гипоксантин при этом окисляется до ксантина (фермент ксантиноксидаза), гуанин дезаминируется до ксантина – фермент дезаминаза.
5. Окисление С8 в ксантине с образованием мочевой кислоты – фермент ксантиноксидаза.
Около 20% мочевой кислоты удаляется с желчью через кишечник, где она разрушается микрофлорой до CO2 и воды. Остальная часть удаляется через почки.
Реутилизация пуриновых оснований– это процесс повторного их использования. Он происходит во всех танях, но особенно актуален в быстрорастущих тканях (эмбриональная, регенерирующая, опухолевая), когда активно идет процесс синтеза нуклеиновых кислот и недопустима потеря их предшественников.
Первый способ реутилизации заключается в присоединении рибозо-5-фосфата к свободным основаниям аденину, гуанину или гипоксантину c образованием АМФ, ГМФ или ИМФ. Эту реакцию осуществляют соответствующие трансферазы.
Во втором способе реутилизируются пуриновые рибонуклеозиды и дезоксирибонуклеозиды. Для этого существуют ферменты с групповой специфичностью аденозинкиназа (для аденозина, гуанозина, инозина и их дезоксиформ) и дезоксицитидинкиназа, которая фосфорилирует дезоксигуанозин и дезоксиаденозин с образованием dГМФ и dАМФ.
Подагра:
Самым частым нарушением обмена пуринов является повышенное образование мочевой кислоты с развитием гиперурикемии. Особенностью является то, что растворимость солей мочевой кислоты (уратов) в плазме крови невелика и при превышении порога растворимости в плазме (около 0,7 ммоль/л) они кристаллизуются в периферических зонах с пониженной температурой (мелкие суставы стоп и пальцев ног).
Когда гиперурикемия принимает хронический характер, говорят о развитии подагры.
Накапливающиеся в межклеточном веществе ураты некоторое время фагоцитируются, но фагоциты не способны разрушить пуриновое кольцо. В результате это приводит к гибели самих фагоцитов, к выходу лизосомальных ферментов, активации свободнорадикального окисления и развитию острой воспалительной реакции – развивается подагрический артрит.
В 50-75% случаев первым признаком заболевания является мучительная ночная боль в больших пальцах ног.
Причины:
увеличение активности ферментов синтеза пуринов
уменьшение активности фермента для реутилизации пуриновых оснований.В результате возрастает количество разрушающихся пуринов и одновременно повышается их образование.
Оба ферментативных нарушения рецессивны и сцеплены с X-хромосомой. Подагрой страдает 0,3-1,7% взрослого населения земного шара, соотношение заболевших мужчин и женщин составляет 20:1.
Основы лечения:
Диета – снижение поступления предшественников мочевой кислоты с пищей и уменьшение ее образования в организме. Для этого из рациона исключаются продукты, содержащих много пуриновых оснований – пиво, кофе, чай, шоколад, мясные продукты, печень, красное вино. Предпочтение отдается вегетарианской диете с количеством чистой воды не менее 2 л в сутки.
 Лекарственные
препараты
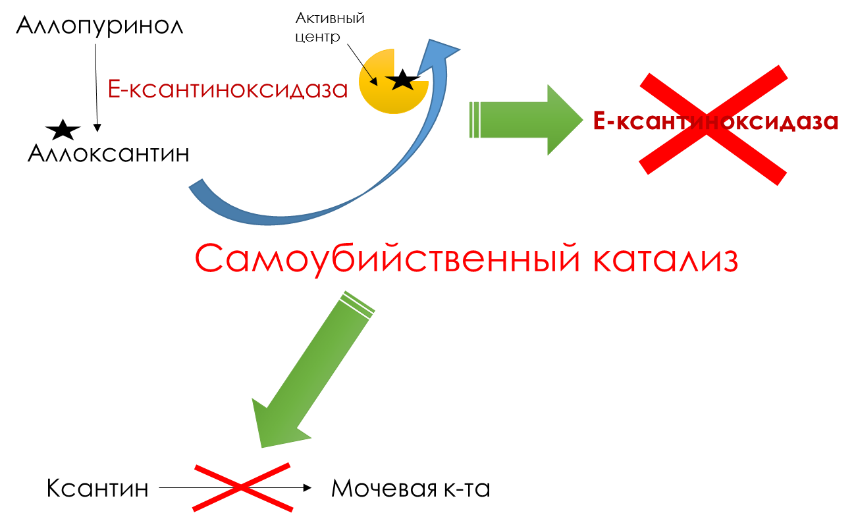
- аллопуринол
Лекарственные
препараты
- аллопуринол
Ксантиноксидаза окисляет аллопуринол в аллоксантин, и последний остается прочно связанным с активным центром фермента и ингибирует его. Фермент осуществляет, образно говоря, самоубийственный катализ. Как следствие, ксантин не превращается в мочевую кислоту.
Поскольку гипоксантин и ксантин лучше растворимы в воде, то они более легко выводятся из организма с мочой.
2) Инсулин: химическая природа, локализация биосинтеза, схема синтеза, механизм действия, органы-мишени, биологические эффекты. Инсулин – по химической природе полипептид, состоит из двух цепей А-21АК и В-30АК соединенных двумя дисульфидными мостиками. Инсулин может существовать в нескольких формах: мономера, димера и гексамера стабилизированного Zn+2. Синтезируется инсулин в ß-клетках островков Лангерганса поджелудочной железы из неактивного предшественника препроинсулина, который в результате частичного протеолиза превращается в активный гормон. Т1/2 - 5-10 мин. Концентрация инсулина в крови составляет 1,3 * 10-11 ммоль/л. Транспорт в крови осуществляется, как в свободном состоянии, так и связанный с белком. Клетки – мишени: мышцы, жировая и соединительная ткань. Механизм действия: мембранно-внутриклеточный, вторичные посредники: ИФ3, ДАГ, IRS-I, Ca+2 .
Катаболизм: под действием инсулиназы в печени, а так же в почках.
Инсулин – гормон синтеза, единственный гормон понижающий уровень глюкозы в крови, за счёт GLUT–4 – транспортера глюкозы из цитоплазмы в клеточную мембрану жировой ткани и мышцы. Инсулин активирует регуляторные ферменты гликолиза (глюкокиназа, гексокиназа, фосфофруктокиназа, пируваткиназа), синтеза гликогена (гликогенсинтаза), ускоряет пентозофосфатный путь (глюкозо-6-фосфатдегидрогеназа).
Инсулин ингибирует распад гликогена и глюконеогенез, инактивируя регуляторные ферменты. Инсулин стимулирует поступление аминокислот в клетку, синтез белков в печени, мышцах и сердце.
Инсулин активирует:
- Na+/K+ - AТФ-азу,
- усиливает синтез
ВЖК (активирую фермент: синтазу ВЖК, ацетил-КоА-карбоксилазу),
ТАГ (инактивирует ТАГ-липазу, активирует липопротеинлипазу),
фосфолипидов,
холестерина (активирует фермент: ГМГ-редуктазу)
желчных кислот.
Общий биологический эффект действия инсулина на организм: понижение уровня глюкозы, ВЖК, ХС и аминокислот в крови.



3) Полиморфизм гена апобелка Е, клиническое значение.
Задача.
У больного обнаружена глюкоза в моче, концентрация глюкозы в крови – 11 ммоль/л, содержание С-пептида – ниже нормы. О каких нарушениях в организме говорят эти данные?
Ответ:
С-пептид освобождается при образовании активной формы инсулина. Снижение содержания С-пептида говорит о снижении синтеза инсулина, т.е., сахарном диабете I типа.
Билет 23-2
1) Анаэробный распад глюкозы (анаэробный гликолиз). Судьба продуктов гликолиза в анаэробных условиях. Биологическое значение анаэробного распада глюкозы. Цикл Кори.
Анаэробный гликолиз-процесс расщепления глюкозы с образованием в качестве конечного продукта лактата.
Условия анаэробного окисления глюкозы:
• происходит при гипоксии клеток - при любых анемиях, при обезвоживании, нарушении кровообращения в тканях, бронхолегочных заболеваниях,
• усиливается при недостаточности железа, витаминов группы B и т.п.
• единственный источник энергии для эритроцитов и клетокмозгового слоя почек,
• в скелетной мускулатуре дает энергию для интенсивной мощнойработы (анаэробной).
Реакции гликолиза :
Происходят в цитозоле.
Включает 2 этапа из 11 ферментативных реакций.
Суммарное уравнение анаэробного процесса:
C6H12O6 + 2 АДФ + 2 Фнеорг → 2 Лактат + 2 H2O + 2 АТФ
Важно!(Именно 11-я реакция отличает анаэробный гликолиз от аэробного) Эта реакция необходима клетке, так как НАДН, образующийся в 6-й реакции, в отсутствие кислорода не может окисляться в митохондриях. Для стабильного протекания гликолиза в бескислородных условиях необходимы ряд простых условий:
• поступление глюкозы, • наличие минимальных количеств АТФ для активации процесса на первом этапе и АДФ как акцептора для фосфатов на втором этапе, • пополнение запасов окисленного НАД для шестой реакции.
Если первые два условия подразумеваются сами собой, то для решения третьего условия существует специальное решение:
• в анаэробных условиях образуемый в шестой, глицеральдегидфосфат-дегидрогеназной реакции, НАДН используется в одиннадцатой реакции для восстановления пирувата до лактата. Образуемый таким образом НАД опять возвращается в шестую реакцию. Следовательно, клетке не нужны дополнительные источники НАД и дополнительные способы уборки НАДН! Процесс поддерживается самостоятельно.
Процесс циклического восстановления и окисления НАД в реакциях анаэробного окисления глюкозы получил название гликолитическая оксидоредукция.
Судьба продуктов анаэробного гликолиза :
В анаэробном процессе пировиноградная кислота восстанавливается до молочной кислоты (лактата), поэтому в микробиологии анаэробный гликолиз называют молочнокислым брожением. Лактат является метаболическим тупиком и далее ни во что не превращается, единственная возможность утилизовать лактат – это окислить его обратно в пируват
Глюкозо-лактатный цикл (цикл Кори)
Глюкозо-лактатный цикл – это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани.
В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии.
В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата. Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы--5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5--1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой.
Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
Биологическое значение анаэробного распада глюкозы :
Образование 2х молекул АТФ
2) Характеристика и роль фибриллярных и регуляторных белков в процессе мышечного сокращения. Механизм мышечного сокращения, этапы. Роль ионов кальция в реализации механизма мышечного сокращения. Фибриллярные белки
1. миозин (толстые филаменты) – главный белок миофибрилл, обладающей АТФ-азной активностью. Молекула миозина состоит из двух тяжелый цепей-закручиваются относительно друг друга в а-спирали(хвост молекулы), каждая из которых заканчивается глобулярной миозиновой головкой . К головке присоединяется две легких цепи.
2. актин(тонкие филаменты) – существуетдве формыактина: мономерный, глобулярный белок – G белок. При физиологической концентрации ионов G-актин подвергается нековалентной полимеризации с образованием нерастворимой двойной нити спиральной формы –F белок . Они не обладают каталитической активностью.
Регуляторные белки
1. тропомиозин – это вытянутая молекула, состоящая из 2 цепей – альфа и бета и примыкающую к F- актину , в щели между двумя полимерами. Каждая молекула тропомиозина связывает 7 мономеро F актина, фрмируя протяженную нить в двух бороздках актина
2. тропонин I ингибирует взаимодействие между F актином и миозиномю
3. тропонин С – Ca связывающий белок, структуре и функциям аналогиен кальмодулину. Каждая молекула тропонина с связывает 4 молекулы Са
4. тропонин Т – связан с тропомиозином
Механизм мышечного сокращения
1. Когда мышца находится в покое, АТФ присоединяется к головке миозина и вызывает ее отделение
АТФ + Н2О = АДФ + Н3РО4
Выделившаяся энергия затрачивается на конформационные изменения головки – переход в напрженное состояние. Но продукты гидролиза АТФ остаются связанными с головкой.
2. При поступлении нервного импульса, срабатывает мостиковый механизм – головка миозина присоединяется к актиновой нити под углом 90, от образовавшегося актиномиозинового комплекса отщепляются продукты гидролиза АТФ
3. Головка миозина пассивно, за счет накопленной энергии, поворачивается на 45 градусов. Это происходит за счет конформационных изменений головки, вызванным силовым ударом, связанным м высвобождением АДФ. Таким образом, акт сокращения совершается не при гидролизе АТФ, а после отделения АДФ от миозина
4. Головка миозина связана с актином в расслабленной конформации до тех пор, пока ее не освободит новая порция АТФ в присутствии Mg, которая обеспечивает возвращение в первоначальное положение
5. Последняя стадия и есть расслабление, характеризуется отделением миозина и актина. Роль АТФ – отсоединение миозина от актина. Происходит практически без затрат энергии
Роль Са в мышечном сокращении
Каждая миофибрилла окружена мембранным мешочком каркоплазматического ретикулума, который Са, Mg, АТФ-азу, обеспечивающая перекачку Са из саркоплазмы в ретикулум против градиента концетрации. С помощью белка – кальсеквестрина Са активным транспортом попадает в ретикулум. Так же при поступлении нервного импульса открывается белок SR-Foot, и происходит пассивный транспорт Са из ретикулума в саркоплазму.
В процессе возбуждения вознкиает трансмембранный ток ионов, входящих в клетку. Быстрый вход Na вызывает формирование потенциала действия и последующий медленный вход Са – это деполяризация сарколеммы. При гидролизе 1 АТ в ретикулуме накапливается 2 иона Са.
При возбуждении мембраны саркомера Са быстро высвобождается из ретикулума в саркоплазму. При этом тропонин С насыщается Са, образуя с ним комплекс, который взаимодействует с тропонином I и тропонином Т, влияя на тропомиозин. При этом изменяется конформация актина так, что миозиновая головка с продуктами гидролиза АТФ соединяется с F-актином и происходит сократительный цикл.
В миокарде основным источником Са служит внеклеточная жидкость. При отсутствии Са сокращение прекращается в течение 1 минуты, а скелетная мышца может сокращаться в такой ситуации часами .
Актиновая регуляция
Характерна для миокарда и скелетных мышц .
Основным действующим механизмом регуляции сокращения является аллостерический механизм, представленный в мышце актином, тропомиозином, тропонин С,Т,I и Са. Са вызывает перемещение нити тропомиозина относительно актина путем увеличения его спирализации, что позволяет головке миозина соединится с актином. Таким образом, тропомиозин обладает способностью блокировать взаимодействие актина и миозина. Тропонин I предотвращает присодинение миозиновой головки к актину.
Регуляция уровня Са в саркоплазе принимает участие так же фермент Mg,Ca-АТФ-аза и система Na/Ca- обмена, которые поддерживают необходимую концентрацию Са,в ыкачивая его из клетки.
Миозиновая регуляция
Характерен для гладкой мускулатуры. Это свяазано с тем, что в гмк нет упорядоченности нитей миозина и нет тропониновой системы. Миозин имеет молекулярную структуру.
Для активации миозиновой АТФ-азы, с целью обеспечения взаимодействия с F-актином, необходимо фосфорилирование легкой цепи миозина, которое происходит с участием активированной комплексом кальмодулин х 4Са с АМФ-зависимой киназы. Таким образом, фосфорилирование миозина стимулирует его АТФ-азную активность и запускает сократительный цикл.
3) ПЦР: биомедицинское значение. ПЦР-это получение множества копий специфического фрагмента ДНК в пробирке invitro. Основу метода ПЦР составляет катализируемое ДНК-полимеразой многократное образование копий опред.участка ДНК. Реакция позволяет увеличить концентрацию заведомо известной послед.ДНК в пробе, за счет синтеза многочисленных копий invitro – этот процесс называется амплификацией.
Этапы
-денатурация-рекционную смесь нагревают при 93-95С в течение 30-40 сек, происходит расщепление двуцепочечной ДНК.
-гибридизация праймеров-это связывание праймеров с ДНК-матрицей, происходит при понижении температуры до 50-65С (10-40с). Праймеры-это синтезированный одноцепочечные участки ДНК, созданные для того чтобы детектировать определенный участок ДНК путем соединения с комплементарным участком исходной расплавленной ДНК (матрицей)
-элонгация цепи - происходит синтез новых цепей ДНК Tag-полимеразой путем удлинении прймеров в направлении от 5-конца к 3-концу при темп (68-72С)
А реплификация – это увеличение кол-ва ДНК, обеспечивающее точное копирование генетической инф и передачу ее от поколения к поколению. Общее между данными процессами то, что происходит увел количества ДНК в конечном счете, так же это происходит при помощи ДНК-полимерзы. А различия в том, что разрыв двуцепочеченой ДНК при амплификации происходит под действием высокой температуры, а при репликации под действием хеликазы;при амплификации используются химически синтезированные праймеры.
Задача.
Пациенту с жёлчнокаменной болезнью назначили препарат хенодезоксихолевой кислоты. С чем связано такое назначение? При каком составе жёлчных камней применение этого препарата будет наиболее эффективным?
Ответ:
Хенодезоксихолевая кислота – первичная желчная кислота, образующейся в гепатоцитах печени при окислении холестерина. В норме хенодезоксихолевая кислота составляет 20– 30% общего пула желчных кислот. Объём продукции хенодезоксихолевой кислоты у взрослого здорового человека 0,2-0,3 г/сут. В жёлчном пузыре хенодезоксихолевая кислота присутствуют главным образом в виде конъюгатов — парных соединений с глицином и таурином, называемых, соответственно, гликохенодезоксихолевой и таурохенодезоксихолевой кислотами.
Билет 17 1) Окислительное дезаминирование (прямое, непрямое) аминокислот. Схема процесса, стадии, ферменты. Биологическое значение процесса Прямое окислительное дезаминирование:
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное).
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В организме человека эти ферменты присутствуют, но практически неактивны.
2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования.
В печени реакция используется для получения аммиака из его транспортной формы глутаминовой кислоты. Далее аммиак входит в реакции синтеза мочевины.
Непрямое окислительное дезаминирование (трансдезаминирование):
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз. Этот перенос называется трансаминирование и его механизм довольно сложен.
В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат ("аминокислота 2").
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О.
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование.
Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Этот этап осуществляется глутаматдегидрогеназой, которая имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование.
Если реакция прямого дезаминирования идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Роль трансаминирования и трансдезаминирования
Реакции трансаминирования:
• активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
• обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
• начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
• необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
При патологиях (сахарный диабет, гиперкортицизм) реакции трансаминирования обусловливают появление субстратов для глюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
• является одной из транспортных форм аминного азота в гепатоциты,
• способна реагировать со свободным аммиаком, обезвреживая его.
Процесс трансдезаминирования идет в организме непрерывно, потому что:
• сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
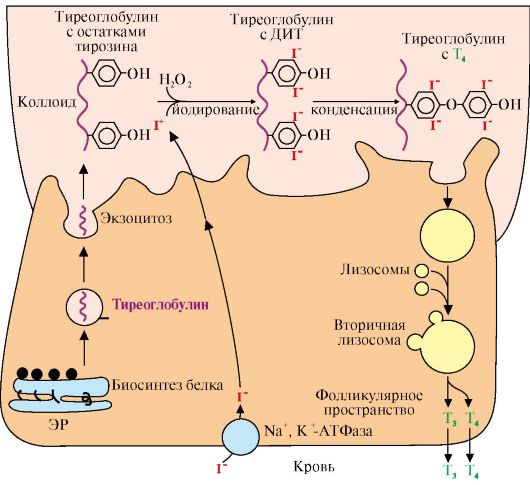
2) Гормоны щитовидной железы: химическая природа и структура, этапы биосинтеза.
Место синтез: щитовидная железа, точнее – тиреоциты.
Природа гормона: производные аминокислоты тирозина.Тиреоциты вырабатывают: Т3 и Т4, цифры обозначают количество атомов I в молекуле. Соотношение Т4:Т3 = 4:1.
Механизм действия – внутриклеточный. Этапы:
Проникновение гормонов в клетку.
Тиреоидные гормоны хорошо растворимы в липидах и поэтому способны проходить сквозь билипидный слой мембран. Однако, большая часть гормонов попадает другим путем. Клетки-мишени йодтиронинов имеют 2 типа рецепторов.
1й тип. Расположен на плазматической мембране. Он имеет низкое сродство к Т3 и Т4, обеспечивает узнавание горомнов, а также связывание для удержания гормон возле клетки. Гормон+рецептор погружается в клетку, где комплекс распадается и гормоны вновь высвобождаются.
2й тип. Ядро, митохондрии.
Периферическое дейодирование Т3 иТ4 происходит в цитозоле. 2 фермента: дейодиназанаружнего кольца (ДеНК) – катализирует прекращения Т4 в Т3; и дейодиназа внутреннего кольца (ДеВК) – катализирует превращение Т4 в реверсивный Т3 (рТ3). Образование рТ3 – путь уменьшения кол-ва Т3.
рТ3 обладает низким сродством в R-ру 2 типа -> дальнейшая деградация дейодированием.
Т3 большое сродство, Т4 меньшее сродство. Они также подвергаются дейодированию-> йод + АК тирозин. Йод из клетки в кровь активно – Na/K-АТФаза; тирозин – облегченная диффузия ч/з белковые каналы.
Биологические эффекты тиреодных гормонов.
Меняют активность генетического аппарата клетки.
Т4 и Т3 повышают активность РНК-полимеразы матричную активность хроматина -> синтез РНК.
Активируется синтез Na/K-АТФазы, НАДФ-зависимой малат-ДГ(малик-фермент), митохондриальный а-глицерофосфат-ДГ, сукцинат-ДГ.
Влияют на энергетический обмен. На митохондриях есть R-ры к Т3. Т3 увеличивает размер митохондрий > повышается интенсивность энергетического обмена >калоригенный эффект ( повышение основного обмена - возрастание потребления О2 > увеличение теплопродукции. Для оценки f-и ЩЖ измеряют скорость основного обмена (базальная скорость метаболизма) - мера потребления О2 организмом в состоянии полного покоя, спустя 12 часов после еды.
Т3 и Т4 регулируют микровязкость клеточных мембран, изменяя соотношение насыщенных и ненасыщенных жирных кислот в ее составе > меняют скорость поступления субстратов (АК, Na, K, Ca и тд) в клетку, для синтеза белков.
Тиреодные гормоны стимулирует синтез белков Что сопровождается увеличением мышечной массы.
Физиологических концентрациях увеличивают транскрипцию генов, координирующих ферменты липогенеза - НАДФ-зависимая малат-ДГ. Т3 и !Т4 косвенно стимулируют липолиз в жировой ткани. Т4 усиливает биосинтез ФЛ в печени.
Усиление всасывания и распада углеводов в ЖКТ. Т3 и Т4 в клетках печени ускоряют гликолиз. Т3 в физиологических условиях увеличивает в мышцах потребления глюкозы, Т4 мешает углеводам превращаться в жиры.
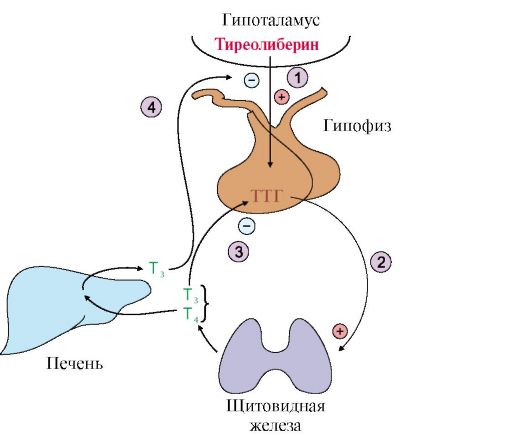
1 -
тиреотропин-либерин стимулирует
освобождение ТТГ; 2 - ТТГ стимулирует
синтез и секрецию йодтиронинов; 3, 4 -
иодтиронины тормозят синтез и секрецию
ТТГ
Гипотиреоз у новорожденных приводит к развитию кретинизма.
Наиболее тяжелая форма гипотиреоза, сопровождающиеся слизистым отёком кожи и подкожной клетчатки называется Микседема.
Причины у взрослых людей
1. Аутоиммунный тиреоидит (Поражение ионизирующем излучением, оперативные вмешательство в ней)
2. Недостаточное поступление йода в организм с пищей водой -> компенсаторное увеличение массы эпит.ткани щитовидной железы ->«Эндемичный зоб»
Снижение основного обмена, скорости гликолиза, мобилизация гликогена и Жиров, потребление глюкозы мышцами уменьшается мышечная масса, снижается теплопродукция. Повышение синтеза холестерина. Гипотиреоидная кома.
Гипертиреоз встречается при - диффузном токсическом зобе (Базедова болезни) или при токсической аденоме щитовидной железы. Стимулирует анаболические и катаболические, но в большей степени катаболические. Клинические проявления гипертиреоза: повышенная возбудимость, раздражительность, бессонница, влажная, тёплая кожа, повышение аппетита, непереносимость тепла, Субфебрилитет, тахикардия, гипертензия, снижение массы тела, эритроцитоз, склонность гипергликемии, зоб, экзофтальм.
3)
Метаболизм этанола
 Задача.
Задача.
Больной жалуется на неутолимую жажду. Суточный объём мочи – 4,5 л, плотность – 1004 кг/м3. Глюкоза и кетоновые тела в моче не обнаружены. При каком заболевании может быть такая клиническая картина? Какова возможная причина таких симптомов?
Ответ:
У больного – несахарный диабет, при котором нарушается концентрационная функция почек вследствие нехватки антидиуретического гормона (вазопрессина).
Билет 11 1) Синтез гликогена в печени и скелетных мышцах. Регуляция процесса Гликоген способен синтезироваться почти во всех тканях, но наибольшие запасы гликогена находятся в печени и скелетных мышцах.
В мышцах количество гликогена снижается обычно только во время физической нагрузки – длительной и/или напряженной. Накопление гликогена здесь отмечается в период восстановления, особенно при приеме богатой углеводами пищи.
Гликоген печени расщепляется при снижении концентрации глюкозы в крови, прежде всего между приемами пищи (постабсорбтивный период). Через 12-18 часов голодания запасы гликогена в печени полностью истощаются. Накапливается гликоген в печени только после еды, при гипергликемии. Это объясняется особенностями печеночной гексокиназы (глюкокиназы), которая имеет низкое сродство к глюкозе и может работать только при ее высоких концентрациях.
При нормальных концентрациях глюкозы в крови ее захват печенью не производится.
Непосредственно синтез гликогена осуществляют следующие ферменты:
1. Фосфоглюкомутаза – превращает глюкозо-6-фосфат в глюкозо-1-фосфат;
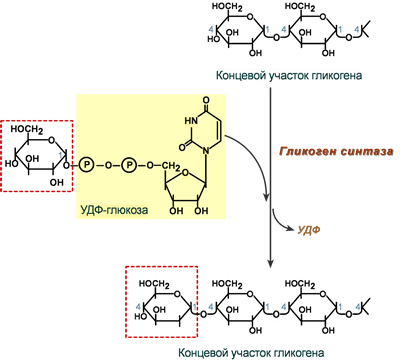
2. Глюкозо-1-фосфат-уридилтрансфераза – фермент, осуществляющий ключевую реакцию синтеза. Необратимость этой реакции обеспечивается гидролизом образующегося дифосфата:

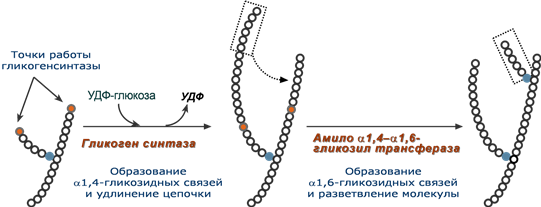
3. Гликогенсинтаза – образует α-1,4-гликозидные связи и удлиняет гликогеновую цепочку, присоединяя активированный С1 УДФ-глюкозы к С4 концевого остатка гликогена;
4. Амило-α1,4-α1,6-гликозилтрансфераза,"гликоген-ветвящий" фермент – переносит фрагмент с минимальной длиной в 6 остатков глюкозы на соседнюю цепь с образованием α1,6-гликозидной связи.
Регуляция синтеза:
Активность ключевых ферментов метаболизма гликогена гликогенфосфорилазы и гликогенсинтазы изменяется в зависимости наличия в составе фермента фосфорной кислоты – они активны либо в фосфорилированной, либо в дефосфорилированной форме.
Присоединение фосфатов к ферменту производят протеинкиназы, источником фосфата является АТФ:
фосфорилаза гликогена активируется после присоединения фосфатной группы,
синтаза гликогена после присоединения фосфата инактивируется.
Скорость фосфорилирования указанных ферментов повышается после воздействия на клетку адреналина, глюкагона и некоторых других гормонов. В результате адреналин и глюкагон вызывают гликогенолиз, активируя фосфорилазу гликогена.
Например:
во время мышечной работы адреналин вызывает фосфорилирование внутримышечных ферментов обмена гликогена. В результате фосфорилаза гликогена активируется, синтаза инактивируется. В мышце происходит распад гликогена, образуется глюкоза для обеспечения энергией мышечного сокращения.
при голодании в ответ на снижение глюкозы крови из поджелудочной железы секретируется глюкагон. Он воздействует на гепатоциты и вызывает фосфорилирование ферментов обмена гликогена, что приводит к гликогенолизу и повышению глюкозы в крови.
Способы активации синтазы гликогена:
Аллостерическая активация гликогенсинтазы осуществляется глюкозо-6-фосфатом.
Еще одним способом изменения ее активности является химическая (ковалентная) модификация. При присоединении фосфата гликогенсинтаза прекращает работу, т.е. она активна в дефосфорилированном виде. Удаление фосфата от ферментов осуществляют протеинфосфатазы. Активатором протеинфосфатаз выступает инсулин – в результате он повышает синтез гликогена.
Вместе с этим, инсулин и глюкокортикоиды ускоряют синтез гликогена, увеличивая количество молекул гликогенсинтазы.
Гормоны:
Гормоны (греч. hormao – привожу в движение) – это вещества, вырабатываемые специализированными клетками и регулирующие обмен веществ в отдельных органах и во всем организме в целом. Для всех гормонов характерна большая специфичность действия и высокая биологическая активность.
Классификация по строению:
Гормоны – производные аминокислот |
Адреналин Норадреналин Тироксин Трийодтиронин |
Пептидные гормоны |
Адренокортикотропный гормон (АКТГ) Соматотропный гормон (СТГ) Тиреотропный гормон (ТТГ) Лактотропный гормон (пролактин, ПЛГ) Лютеинизирующий гормон (ЛГ) Фолликулостимулирующий гормон (ФСГ) Меланоцитстимулирующий гормон (МСГ) Антидиуретический гормон (АДГ, вазопрессин) Окситоцин Кальцитонин Паратгормон Инсулин Глюкагон |
Стероидные гормоны
|
Кортизол Альдостерон Эстрадиол Прогестерон Тестостерон Кальцитриол |
Классификация по влиянию на обмен веществ:
Белковый обмен |
Инсулин, СТГ, АКТГ и кортизол, ТТГ и тироксин |
Липидно-углеводный обмен |
Инсулин, СТГ, АКТГ и кортизол, ТТГ и тироксин, адреналин, глюкагон |
Водно-солевой обмен |
Альдостерон, АДГ |
Обмен кальция и фосфора |
Кальцитонин, паратгормон, кальцитриол |
Репродуктивная функция |
Гонадотропные гормоны и эстрадиол, эстриол, прогестерон, тестостерон, пролактин, окситоцин |
Классификация по месту синтеза:
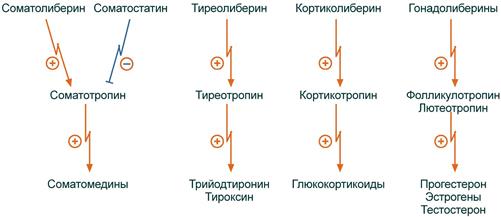
Гипоталамус |
Кортиколиберин, тиреолиберин, гонадолиберин, соматолиберин, меланолиберин, фоллиберин, пролактолиберин. Пролактостатин, соматостатин, меланостатин. АДГ (вазопрессин), окситоцин. |
Гипофиз |
СТГ (соматотропин), АКТГ (кортикотропин), ЛТГ (лактотропин), ТТГ (тиреотропин), МСГ (меланотропин), ФСГ (фоллитропин), ЛГ (лютеотропин). |
Периферические железы |
Инсулин, глюкагон, кортизол, тироксин, адреналин, альдостерон, эстрадиол, эстриол, тестостерон, кальцитонин, паратгормон. |
Эпифиз |
Мелатонин. Серотонин. |
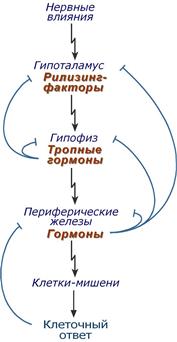 Иерархия
гормонов:
Иерархия
гормонов:
Механизм передачи сигнала:
Для регуляции деятельности клетки с помощью гормонов, находящихся в плазме крови, необходимо обеспечить возможность клетки воспринимать и обрабатывать этот сигнал. Эта задача усложняется тем, что сигнальные молекулы (нейромедиаторы, гормоны, эйкозаноиды) имеют разную химическую природу, реакция клеток на сигналы должна быть различной по направленности и адекватной по величине.
Механизмы действия сигнальных молекул по локализации рецептора:
1. Мембранный – рецептор расположен на мембране. Для этих рецепторов в зависимости от способа передачи гормонального сигнала в клетку выделяют три вида мембраносвязанных рецепторов и, соответственно, три способа передачи сигнала. По данному механизму работают пептидные и белковые гормоны, катехоламины, эйкозаноиды.
2. Цитозольный – рецептор расположен в цитозоле.
Виды мембраносвязанных рецепторов:
1. Рецепторы, обладающие ферментативной активностью – при взаимодействии лиганда с рецептором активируется внутриклеточная часть (домен) рецептора, имеющий каталитическую (тирозинкиназную или тирозинфосфатазную или гуанилатциклазную) активность. По этому механизму действуют СТГ, инсулин, пролактин, интерлейкины, ростовые факторы, интерфероны α, β, γ.
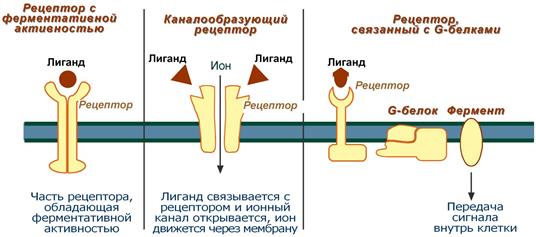
2. Каналообразующие рецепторы – присоединение лиганда к рецептору вызывает открытие ионного канала на мембране. Таким образом действуют нейромедиаторы (ацетилхолин, глицин, ГАМК, серотонин, гистамин, глутамат), вторичный мессенджер инозитолтрифосфат.
3. Рецепторы, связанные с G-белками – передача сигнала от гормона происходит при посредстве особого G-белка. G-белок влияет на ферменты, образующие вторичные мессенджеры (посредники),которые уже передают сигнал на внутриклеточные белки. К третьему виду относятся аденилатциклазный и кальций-фосфолипидныймеханизмы. По данному механизму действуют большинство белковых и пептидных гормонов, некоторые медиаторы.
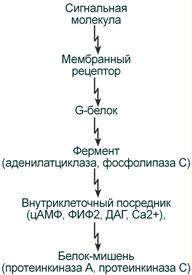
Мессенджеры:
1. Циклический АМФ(циклоАМФ, цАМФ) образуется в клетке, когда действуют гормоны гипофиза (ТТГ, ЛГ, МСГ, ФСГ. АКТГ), кальцитонин, соматостатин, глюкагон, паратгормон, адреналин (через α2- и β-адренорецепторы), вазопрессин (через V2-рецепторы).
Механизм наработки цАМФ связан с активацией фермента аденилатциклазы и называется аденилатциклазный механизм:
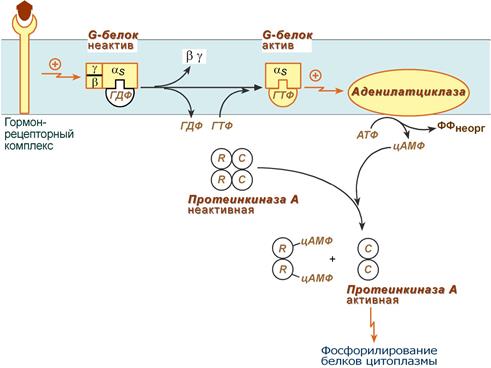
Этапы передачи сигнала:
 1.
Взаимодействие лиганда с рецептором приводит
к изменению конформации последнего. Это
изменение передается на G-белок (GTP,
ГТФ-зависимый), который состоит из трех
субъединиц (α, β и γ), α-субъединица
связана с ГДФ.
1.
Взаимодействие лиганда с рецептором приводит
к изменению конформации последнего. Это
изменение передается на G-белок (GTP,
ГТФ-зависимый), который состоит из трех
субъединиц (α, β и γ), α-субъединица
связана с ГДФ.
В составе G-белков α-субъединицы бывают двух типов по отношению к аденилатциклазе: активирующие αSи ингибирующие αI. Например, в случае действия адреналина с активирующей субъединицей αS взаимодействуют β-адренорецепторы, с ингибирующей – α2-адренорецепторы.
2. В результате взаимодействия с рецептором β- и γ-субъединицы отщепляются, одновременно на α-субъединице ГДФ заменяется на ГТФ.
3. Активированная таким образом αS-субъединица стимулирует аденилатциклазу, которая начинает синтез цАМФ. Если в действо была вовлечена αI-субъединица, то она ингибирует аденилатциклазу, все останавливается.
4. Циклический АМФ (цАМФ) – вторичный мессенджер – в свою очередь связывается с регуляторными (R) субъединицами протеинкиназы А и вызывает их диссоциацию от каталитических. В результате каталитические (C) субъединицы становятся активными..
Протеинкиназа А (ПК А) фосфорилирует ряд ферментов, среди которых киназа фосфорилазы гликогена, гликогенсинтаза, гормончувствительная липаза,транскрипционный фактор CREB (cAMP-response element-binding protein).
5. Наработка цАМФ продолжается некоторое время, пока α-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
6. Как только ГТФ превратился в ГДФ, то α-субъединица инактивируется, теряет свое влияние на аденилатциклазу, обратно соединяется с β- и γ-субъединицами.
7. Все возвращается в исходное положение.
Гормон отрывается от рецептора еще раньше:
если концентрация гормона в крови велика, то следующая его молекула присоединится к рецептору через малый промежуток времени и повторный запуск АЦ-механизма произойдет быстро – в клетке активируются соответствующие процессы.
если гормона в крови мало – для клетки наступает некоторая пауза, изменения метаболизма нет.
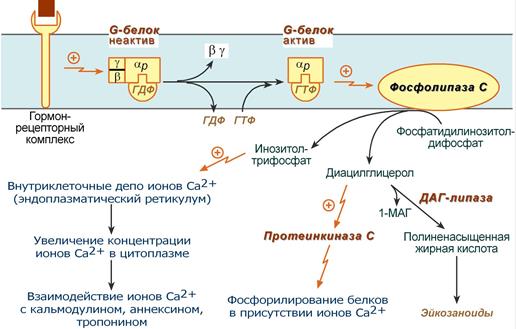
2. Инозитолтрифосфат и даг:
По этому механизму, который получил название кальций-фосфолипидный механизм, действуют вазопрессин (через V1-рецепторы), адреналин (через α1-адренорецепторы), ангиотензин II.
Принцип работы этого механизма совпадает с предыдущим, но вместо аденилатциклазы мишеневым ферментом для α-субъединицы служит фосфолипаза С(ФЛ С). Фосфолипаза С расщепляет мембранный фосфолипид фосфатидилинозитолдифосфат (ФИФ2) до вторичных мессенджеров инозитолтрифосфата (ИФ3) и диацилглицерола (ДАГ).
3.ЦГмф:
Обеспечивает гуанилатциклазный механизм, который в общих чертах схож с аденилатциклазным: после появления какой-либо сигнальной молекулы сигнал воспринимается ферментом гуанилатциклазой и далее передается при помощи вторичного мессенджера цГМФ. Последний воздействует на протеинкиназу G, которая фосфорилирует определенные белки, чем изменяет активность клетки.
4.Проникновение гидрофобных гормонов в клетку:
Некоторые гормоны, такие как стероидные гормоны и гормоны щитовидной железы, по свойствам являются гидрофобными. В плазме крови для их транспортировки используются специальные белки-транспортеры. В комплексе с этими белками они не способны взаимодействовать с мембранными рецепторами, но способны отрываться от них и диффундировать через клеточную мембрану внутрь клетки. После перехода в цитозоль гормоны немедленно подхватываются другими белками, которые уже являются рецепторами.
2) Антисвёртывающая и фибринолитическая системы крови. Антисвертывающая система крови
1) Тромбомодулин- гликопротеид, интегральный белок мембран эндотелиальных клеток. Содержится в эндотелии вен, артерий, капилляров и лимфатической системе большинства органов за исключением ГМ. Не требует протеометрической активации.
Основная функция:свзывание тромбина в присутствии Ca.
Синтез Тм стимулируется: тромбином, цАМФ, ретиноевой к-той
Синтез ингибируется: ИЛ-1, гипоксией , эндотоксином.
2) Система протеина – С– синтезируется в печени и активируется косплексом Тм-IIa(тромбин) –Ca. Образует комплекс акт. Пр С-протеин S- Ca, а он инактивирует 5 и 8 факторы.
3) Ингибиторы активированных факторов свертывания крови.
АнтитромбинIII–синтезируется в печении немного в эндотелии. Связыается с гепарином и образует комплекс, который обладает активностью.
Гепарин – мукополизахарид, синтезируется тучными клетками.
Комплекс антитромбин III – гепарин ингибирует 2,9,10,12,14 факторы
а2-макроглобулин – синтезируется в печени, ингибирует 2а-Ca
Антиконвертин – синтезируется эндотелием.
а1-антитрипсин – специфический ингибитор 2,11,14 факторов, ингибирует лейкоцитарную эластазу(синтезируется в нейтрофилах)-разрушает эластин.
Фибринолитическая система крови
Фибринолиз- это ферментативное расщепление волокон фибрина-полимера с образованием растворимых пептидов, далее они поступают в кровь и фагоцитируются
Плазминоген(синтезируется в печени, почках, ккм, кишечнике) превращается в плазмин
Эффекты плазмина:
• Тромболитический эффект. Когда сгусток сформирован, большое количество плазминогена захватывается в тромб .
• Инактивация плазменных факторов. 2,5,7,8,9,11 факторы
Активация плазмина
А)Внутрення активация происходит частично косплеком 12 с 14 факторами, частично комплексом протеинов G-S-Ca
Б)Внешняя активация происходит
• Тканевой активатор плазминогена-содержится в эндотелии сосудов, кроме печени. Поврежденные и сосудистый эндотелий постпенно выделяют ТАП.
В крови ТАП ингибируется ингибиторами тканевого активатора первого типа(синтезруется эндотелии сосудов, гепатоцитами, моноцитами, фибробластами)и второго типа(синтез в плацентой моноцитами и макрофагами)
• Уракиназа –синтезируется почками и секретируется в кровь. Ингибируется И-ТАП- 2
• Стрептокиназа – синтезируется в-гемолитическим стрептококкком
