
- •Ферменты. Номенклатура. Классификация ферментов
- •6 Билет
- •3. Пигмент билирубин????
- •3) Молекулярные механизмы патогенеза острого панкреатита.
- •14 Билет
- •2) Функции сосудистого эндотелия, субэндотелия, тромбоцитов.
- •3) Диагностика панкреатита.
- •16 Билет.
- •3 Метаболические механизмы алкоголизма.
- •3) Моногенные заболевания.
- •3) Полиморфизм гена апобелка е, клиническое значение.
- •21 Билет
- •2. Особенности метаболизма и энергетического обмена в клетках поперечно-полосатой мускулатуры и миокарда.
- •2) Характеристика и роль фибриллярных и регуляторных белков в процессе мышечного сокращения. Механизм мышечного сокращения, этапы. Роль ионов кальция в реализации механизма мышечного сокращения.
- •2. Кальцитриол: химическая природа, этапы синтеза, механизм действия, органы-мишени, биологические эффекты. Представление о заболевании «рахит».
- •26 Билет
- •2) Адреналин- химическая природа, органы мишени, биологические эффекты.
- •3) Моноклональные антитела, препараты на их основе против опухолей.
- •27 Билет
- •1. Понятие о процессах катаболизма и анаболизма. Функции клеточного метаболизма. Стадии генерирования энергии по Кребсу.
- •2. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •3. Вектор иммуноконъюгата. Вещества, используемые в качестве векторов адресной доставки.
- •2.Типы переваривания*. Функции жкт как пищеварительно-транспортного конвейера*. Функции слюны*. Функции жёлчных кислот*.
- •3.Эпидермальнвй фактор роста и а-фетопротеин : их использование в качестве векторов.
- •1) Биосинтез триацилглицеринов (таг): последовательность реакций, субстраты, ферменты. Особенности синтеза в печени, жировой ткани, энтероцитах. Регуляция процесса.
- •3) Понятие о рекомбинантных днк.
- •2) Неферментативные системы антирадикальной защиты и их физиологическое значение.
- •2. Действие первичных и вторичных продуктов перекисного окисления на мембраны и другие структуры.
- •3. Действие наркотиков. Дофаминовая система.
- •1. Разобщители цпэ.
- •2. Пути обезвреживания аммиака.
- •3. Теломеразная активность.
- •38 Билет
Билет 1
Ферменты. Номенклатура. Классификация ферментов
Ферменты, или энзимы, - это специфич. белки глобулярной природы, ктр присутствуют во всех живых организмах и играют роль биологических катализаторов (вещ-вы, ускоряющие хим.р-ию, но не расходуются). 1) после р-ии освобождаются вновь и могут реагировать с новыми молекулами субстрата; 2) оказывают свое дей-е в малых концентрациях; 3) только повышают скорость реакций (точку равновесия не сдвигают).
Классификация по типу катализируемой реакции:
1. Оксидоредуктазы. [различн. окис_но-восст_ные р-ии с участием 2 субстратов (перенос е- или атомов водорода с одн. субстрата на др-й)]. Назв-е:"донор: акцептороксидоредуктаза", рабочее - субстрат-подкласс оксидоредуктаз. Дегидрогеназы (катализируют р-ии дегидри-я (отщеп-я водорода); акцепторы электронов –коферменты НАД, НАДФ, ФАД; высокая субстратная специфичность. Оксидазы. Акцептор – молекулярный кислород. Оксигеназы (гидроксилазы) - атом кислорода из молекулы кислорода присоединяется к субстрату.
2.Трансферазы. Перенос функц-ных групп от одн. соед-я к др-му. Подразделяют в зав-ти от переносимой группы. Название: "донор: ацетрофэкспортируемая группатрансфераза". К классу трансфераз относят аминотрансферазы, ацилтрансферазы, метилтрансферазы.
3.Гидролазы. Реакции гидролиза (расщепления ковалент.связи с присоед-ем молекулы воды по месту разрыва). Подразделяют в зав-ти от расщепляемой связи. Название: "субстрат-гидролаза" или суффикс "аза", напр: протеаза, липаза.
4. Лиазы. Отщепляют от субстратов негидролитическим путём определённую группу (при этом могут отщепляться СО2, Н2О, NH2, SН2и др.) или присоединяют молекулу воды по двойной связи. Наименование ферментов: "субстрат-отщепляемая или присоединяемая группировка".
5. Изомеразы. Различные внутримолекулярные превращения. Подразделяют в зав-ти от типа р-ии изомеризации. Общее название: "изомеразы". Могут катализировать внутримолекулярные окис_но-восс_ные р-ии, осуществляя взаимопревращения альдоз и кетоз, кетонных и енольных групп, перемещения двойных связей внутри молекулы. Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют «мутазой»
6. Лигазы (синтетазы). Реакции присоединения др. к др. 2 молекул с образованием ковалент.связи. При использовании энергии гидролиза АТФ называют лигазами, или синтетазами. Если источник энергии — любое др. макроэргическое соед-е (не АТФ), ферменты называют синтазами. Номенклатура: название фермента = название его субстрата + обозначение типа катализирумеой реакции, заканчивается на -аза.
Глюкагон: химическая природа*, механизм действия, органы-мишени, биологические эффекты***.
Глюкагон – представляет собой пептид, состоящий из 29 аминокислот. Биосинтез глюкагона происходит в α-клетках островков Лангерганса поджелудочной ж, а также в нейроэндокринных клетках кишечника. В α-клетках образуется путем протеолиза из прогормона, ктр входит в состав более крупного препрогормона. После синтеза в шерхЭПС пре-последовательность отщепляется с образованием прогормона, ктр далее подвергается ограниченному протеолизу и образуется активный глюкагон. Глюкагон накапливается и пакуется в секреторных гранулах, где хранится в виде плотно упакованных кристаллов (форма равностороннего ∆).
Биосинтез и секреция глюкагона регулируется концентрацией глюкозы в крови по принципу обратной связи. Повышение концентрации аминок-т в крови стимулирует секрецию глюкагона в кровь; снижает процесс секреции глюкагона высокая концентрация глюкозы в крови.
***Механизм дей-я: мембранно-внутриклеточный; вторичные посредники – цАМФ. Основными клетками-мишенями явл. кл-ки печени и жировой клетчатки. Действуя на кл-ки печени, гл-гон усиливает распад гликогена, что приводит к повышению ур-ня глюкозы в крови. В кл-ах жир.ткани активирует гормончувствительную ТАГ-липазу и стимулирует липолиз.
Мутации митохондриальных генов. Примеры.
Митохондриальные гены передаются потомкам только от матери. Это связано с тем, что всю цитоплазму с митохондриями потомки получают вместе с яйцеклеткой, а в сперматозоидах цитоплазма практически отсутствует. По этой причине женщина с митохондриальным заболеванием передаёт его всем своим детям, а больной мужчина - нет.
Мутации митохондриального генома можно условно разделить на 2 типа: хромосомные (структурные перестановки - дупликации и делеции, которые обычно являются единичными) и генные (мутации белков, тРНК, рРНК, затрагивающие 1 нуклеотид, в свою очередь подразделяющиеся на микроделеции/инсерции и однонуклеотидные замены).
Хромосомные мутации (Непереносимость нагрузок, хронический прогрессивный паралич наружных мышц глазного яблока, миопатия)
Генные мутации (Рак желудка, Расстройства слуха, Сахарный диабет типа 2, Муковисцидоз); проявляются, если находятся в кодирующей части или в участке регуляции транскрипции митохондриального гена.
Задача: В крови пациента обнаружена повышенная концентрация билирубинглюкуронида. Конъюгированный, связанный или прямой («прямой»– данный метаболит даёт прямую реакцию с диазореактивом Эрлиха без предварительного осаждения метанолом) билирубин. На основании желтушной окраски слизистых оболочек и кожи па-циента. Повышение концентрации биолирубинглюкуронида имеет место при печёночной и подпечёночной желтухах.
Билет 2 1. Пути обезвреживания аммиака*. Механизмы транспорта аммиака в организме: глутаминовый и глюкозо-аланиновый циклы**.
Аммиак – конечный продукт обмена белков в организме человека. 60% аммиака образуется в печени, часть – в мышцах конечностей при физической нагрузке и в тонкой кишке в процессе метаболизма, кроме того микрофлора толстой кишки разлагает белок и мочевину, вследствие чего также образуется аммиак.
*Пути обезвреживания:
1) Восстановительное аминирование альфа-кетоглутарата с образованием глутамата при участии глутаматдегидрогеназы (обратная реакция окисления глутамата): α-кетоглутарат + NH3 + NADH + H+ ↔ Глутамат + NAD+
 2)
Образование амида глутаминовой кислоты
– глутамина при участии глутамисинтетазы:
Глутамат + NH3 + ATФ ↔ Глутамин +AДФ + H3PO4.
Происходит в митохондриях клеток. В
р-ии участвуют кофактор-ионы Mg2+.
Глутаминсинтетаза – регуляторный
фермент, его аллостерич. ингибитором
явл. АМФ.
2)
Образование амида глутаминовой кислоты
– глутамина при участии глутамисинтетазы:
Глутамат + NH3 + ATФ ↔ Глутамин +AДФ + H3PO4.
Происходит в митохондриях клеток. В
р-ии участвуют кофактор-ионы Mg2+.
Глутаминсинтетаза – регуляторный
фермент, его аллостерич. ингибитором
явл. АМФ.
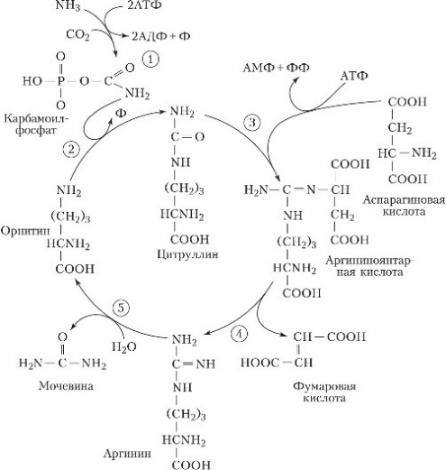
3) Образование карбамоилфосфата путем конденсации NH3, CO2 и АТФ, катализируемое карбамоилфосфатсинтетазой 1 (ф. действует в митохондриях). Реакция происходит в печени и явл. начальной стадией синтеза мочевины – конечного продукта метаболизма азота: NН3 + СО2 + 2АТФ + Н2О → H2N — СО — РО3Н2 + 2AДФ + Н3РО4.
4) Синтез мочевины – основной путь обезвреживания аммиака – орнитиновый цикл.
 **
Глюкозо-аланиновый
цикл. В мышцах
основным акцептором лишнего аминного
азота является пируват. При катаболизме
белков в мышцах происходят реакции
трансаминирования аминокислот, образуется
глутамат, который далее передает
аминоазот на пируват и образуется
аланин. Из мышц с кровью аланин переносится
в печень, где в обратной реакции передает
свою аминогруппу на глутамат. Образующийся
пируват используется как субстрат в
реакциях синтеза глюкозы (глюконеогенез),
а глутаминовая кислота дезаминируется
и аммиак используется в синтезе мочевины.
**
Глюкозо-аланиновый
цикл. В мышцах
основным акцептором лишнего аминного
азота является пируват. При катаболизме
белков в мышцах происходят реакции
трансаминирования аминокислот, образуется
глутамат, который далее передает
аминоазот на пируват и образуется
аланин. Из мышц с кровью аланин переносится
в печень, где в обратной реакции передает
свою аминогруппу на глутамат. Образующийся
пируват используется как субстрат в
реакциях синтеза глюкозы (глюконеогенез),
а глутаминовая кислота дезаминируется
и аммиак используется в синтезе мочевины.
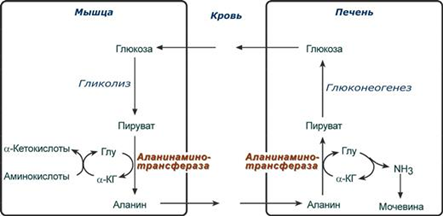
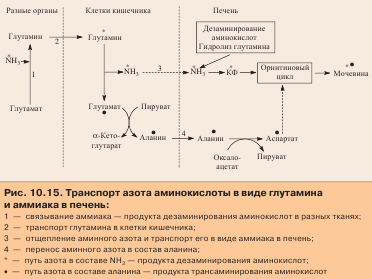 Глутаминовый
цикл. Глутамин
не только связывает и обезвреживает
аммиак, но также служит его транспортной
формой, так как легко проходит через
мембраны и поступает из клеток в кровь,
затем в основном в кишечник. В энтероцитах
отщепляется амидная группа глутамина
в виде аммиака, который с кровью воротной
вены, оттекающей от кишечника, поступает
в печень и там участвует в синтезе
карбамоилфосфата. Аминная группа
глутамата — продукта гидролиза глатамина,
переносится на пируват, затем в составе
аланина поступает в печень и, как показано
выше, участвует в синтезе аспартата.
α-кетоглутарат, образовавшийся из
глутамата, окисляется и служит источником
энергии для энтероцитов.
2.
Характеристика
плазменных факторов свёртывания крови*.
Роль витамина К и ионов Са2+ в
гемокоагуляции**. Внешний и внутренний
пути гемокоагуляции***.
Глутаминовый
цикл. Глутамин
не только связывает и обезвреживает
аммиак, но также служит его транспортной
формой, так как легко проходит через
мембраны и поступает из клеток в кровь,
затем в основном в кишечник. В энтероцитах
отщепляется амидная группа глутамина
в виде аммиака, который с кровью воротной
вены, оттекающей от кишечника, поступает
в печень и там участвует в синтезе
карбамоилфосфата. Аминная группа
глутамата — продукта гидролиза глатамина,
переносится на пируват, затем в составе
аланина поступает в печень и, как показано
выше, участвует в синтезе аспартата.
α-кетоглутарат, образовавшийся из
глутамата, окисляется и служит источником
энергии для энтероцитов.
2.
Характеристика
плазменных факторов свёртывания крови*.
Роль витамина К и ионов Са2+ в
гемокоагуляции**. Внешний и внутренний
пути гемокоагуляции***.
*Фибриноген (фактор I) синтезируется в печени и клетках костного мозга, селезенки, лимфатических узлов. В легких под действием фибриногеназы или фибринодеструктазы – происходит разрушение фибриногена. Под влиянием тромбина фибриноген превращается в фибрин, ктр образует сетчатую основу тромба, закупоривающего поврежденный сосуд.
Протромбин (фактор II) синтезируется в печени при участии витамина K. Уровень протромбина снижается при эндогенной или экзогенной недостаточности витамина K, когда образуется неполноценный протромбин.
Тканевой тромбопластин (фактор III) – термостабильный липопротеид, имеется – в легких, мозге, почках, сердце, печени, скелетных мышцах. В тканях содержится виде предшественника – протромбопластина, ктр при взаимодействии с плазменными факторами (VII, IV) способен активировать фактор X.
Ионы кальция (фактор IV) в процессе свертывания не расходуется, можно обнаружить в сыворотке крови. Участвуют во всех трех фазах свертывания крови: в активации протромбиназы (I фаза), превращении протромбина в тромбин (II фаза) и фибриногена в фибрин (III фаза). Кальций способен связывать гепарин, благодаря чему свертывание крови ускоряется. При отсутствии кальция нарушаются агрегация тромбоцитов и ретракция кровяного сгустка. Ионы кальция ингибируют фибринолиз.
Проакцелерин (фактор V) образуется в печени, но не зависит от витамина K. Необходим для образования внутренней (кровяной) протромбиназы (активирует фактор X) и для превращения протромбина в тромбин.
Акцелерин (фактор VI) – активная форма фактора V.
Проконвертин, конвертин (фактор VII) синтезируется в печени при участии витамина K. Конвертин – активная форма фактора – играет основную роль в образовании тканевой протромбиназы и в превращении протромбина в тромбин.
Антигемофильный глобулин А (фактор VIII) вырабатывается в печени, селезенке, клетках эндотелия, лейкоцитах, почках.
Антигемофильный глобулин B (фактор IX) образуется в печени при участии витамина K, термостабилен, длительно сохраняется в плазме и сыворотке крови.
Фактор X участвует в образовании протромбиназы.
Плазменный предшественник тромбопластина (фактор XI). Фактор XII, фактор контакта. Фактор XIII, фибриназа.
*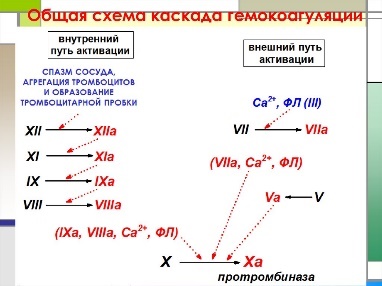 *
Роль витамина «К» в
гемокоагуляции. Витамин К (К1, К2, К3,
викасол и другие) явл. антигеморрагическим
фактором. Принимает участие в
посттрансляционном созревании факторов
II, VII, IX и Х свертывающей системы крови
(а также в созревании витамин К-зависимых
антикоагулянтов — протеинов С и S). В
свертывании участвуют ионы Са2+, котр
необходимы для всех фаз свертывания
крови.
*
Роль витамина «К» в
гемокоагуляции. Витамин К (К1, К2, К3,
викасол и другие) явл. антигеморрагическим
фактором. Принимает участие в
посттрансляционном созревании факторов
II, VII, IX и Х свертывающей системы крови
(а также в созревании витамин К-зависимых
антикоагулянтов — протеинов С и S). В
свертывании участвуют ионы Са2+, котр
необходимы для всех фаз свертывания
крови.
***
Состав и функции семейства клеточных рецепторов.
1) семейство 1: ацетилхолиновые (рецептор для глицина, гамма-аминомасляной кислоты (ГАМК) и серотонина), аденозиновые, ангиотензиновые, желчных кислот, брадикининовые, хемокиновые и хемотаксических факторов, гастриновые, дофаминовые, свободных жирных кислот, гликопротеиновые гормональные, гистаминовые.
2) семейство 2: кальцитонина, глюкагона, рилизинг-фактора гормона роста, паратиреоидного гормона вазоактивного интестинального пептида.
3) семейство 3: метаботропные глутаматные, вкусовые, протеина, индуцируемого ретиноевой кислотой. Задача: Туристы, заблудились в тайге и голодали в течение 1 недели. Ни у одного из них не развилась гипогликемическая кома. Они благополучно добрались до населённого пункта, где и были обследованы. Концентрация глюкозы у всех оказалась на нижней границе нормы.Какие процессы поддерживают концентрацию глюкозы при длительном голодании? Какие гормоны обеспечивают стимуляцию этих метаболических путей?
Распад гликогена, глюконеогенез. Глюкагон, кортизол, адреналин.
Билет 4 1. Механизмы регуляции активности ферментов. Примеры
Аллостерическая регуляция. Ф. может изменять активность в рез-те нековалентного взаимодействия с эффекторами. Связывание с эффектором происходит в участке, пространственно удаленном от активного (каталитического) центра, и вызывает конформационные изменения в молекуле белка и в каталитическом центре. Эти изменения могут как увеличивать активность фермента (эффектор явл. активатором), так и уменьшать (тогда эффектор играет роль ингибитора). При удалении активатора фермент вновь переходит в неактивную форму и «выключается». Аллостерическая регуляция явл. основным способом регуляции метаболических путей.
Регуляция активности ф. путем фосфорилирования-дефосфорилирования. Фермент изменяет активность в результате ковалентной модификации. Фосфатная группа OPO32- присоединяется к гидроксильным группам в остатках серина, треонина или тирозина. В зависимости от природы фермента фосфорилирование может его активировать или инактивировать. Пример: реакция присоединения фосфатной группы и ее отщепление катализируют специальные ферменты – протеинкиназы и протеинфосфатазы.
Регуляция путем ассоциации-диссоциации субъединиц в олигомерном ферменте. Пример: активация протеинкиназы при участии цАМФ.
Активация ферментов путем частичного протеолиза. Активация неактивного предшественника фермента, профермента, включает гидролитическое расщепление молекулы с одновременным изменением конформации. Пример: трипсиноген синтезируется в поджелудочной железе, а затем в кишечнике превращается в трипсин путем удаления гексапептида с N-конца. Реакцию катализируют энтеропептидаза – фермент, синтезируемый клетками кишечника. 2. Особенности метаболизма глюкозы в нервной ткани.
В покое энергетические потребности мозга почти полностью обеспечиваются глюкозой, интенсивно поглощаемой из крови. Глюкоза потребляется преимущественно по гликолитическому пути и в ЦТК, процесс сопровождается интенсивным потреблением кислорода. Способность клеток мозга интенсивно потреблять глюкозу обеспечена высокой активностью гексокиназы. Аэробный путь распада глюкозы делает его чувствительным к гипоксии. Транспорт глюкозы в клетки ГМ – инсулиннезависимый. При голодании дополнительный источник энергии – кетоновые тела. 3. ДОФАминовая система, влияние на формирование наркотической зависимости.
Дофамин – гормон и нейромедиатор. Создаёт сильное ощущение предвкушения от получения результата или нежелания его получения. Формирует чувство любви, в том числе материнской.
Многие наркотики увеличивают выработку и высвобождение дофамина в мозге в 5—10 раз, что позволяет людям, которые их употребляют, получать чувство удовольствия искусственным образом. Постепенно мозг адаптируется к искусственно повышаемому уровню дофамина, производя меньше гормона и снижая количество рецепторов в «системе поощрения». Это один из факторов, побуждающих человека, принимающего наркотики, увеличивать дозу для получения прежнего эффекта. Задача про рН 7,36??? ответ кетоацидоз из-за сахарного диабета. Связан с нарушением углеводного обмена, вследствие дефицита инсулина: высокой концентрацией глюкозы и кетоновых тел в крови, образованных в результате усиленного катаболизма жирных кислот (липолиза) и дезаминирования аминокислот.
5 билет 1. Стадии и схема катаболизма.
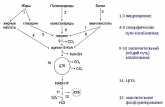 I
этап катаболизма
– гидролитический. Под воздействием
гидролаз в пищеварительном тракте
белки, жиры, углеводы распадаются на
соответствующие мономеры. \\\ II
этап – специфические
пути катаболизма. Мономеры основных
пищевых веществ при участии ферментов,
специфичных для каждого метаболита,
превращаются в основном в два метаболита
- пировиноградную кислоту (ПВК) и
ацетил-KоА (макроэргический продукт
конденсации КоА с уксусной кислотой).
Реакции специфических путей катаболизма
протекают внутри клеток, высвобождается
1/3 энергии питательных веществ. \\\ III
этап - общий путь
катаболизма. После образования ПВК
дальнейший путь распада веществ до СО2
и Н2О происходит одинаково в общем пути
катаболизма. Он включает два процесса:
1) окислительное декарбоксилирование
ПВК; 2) цикл Кребса (цикл трикарбоновых
кислот (ЦТК), цитратный цикл).
I
этап катаболизма
– гидролитический. Под воздействием
гидролаз в пищеварительном тракте
белки, жиры, углеводы распадаются на
соответствующие мономеры. \\\ II
этап – специфические
пути катаболизма. Мономеры основных
пищевых веществ при участии ферментов,
специфичных для каждого метаболита,
превращаются в основном в два метаболита
- пировиноградную кислоту (ПВК) и
ацетил-KоА (макроэргический продукт
конденсации КоА с уксусной кислотой).
Реакции специфических путей катаболизма
протекают внутри клеток, высвобождается
1/3 энергии питательных веществ. \\\ III
этап - общий путь
катаболизма. После образования ПВК
дальнейший путь распада веществ до СО2
и Н2О происходит одинаково в общем пути
катаболизма. Он включает два процесса:
1) окислительное декарбоксилирование
ПВК; 2) цикл Кребса (цикл трикарбоновых
кислот (ЦТК), цитратный цикл).
В общем пути катаболизма образуются первичные доноры водорода для цепи переноса электронов (дыхательной цепи). Реакции общего пути катаболизма происходят в матриксе митохондрий, и восстановленные коферменты передают водород непосредственно на компоненты дыхательной цепи, расположенные во внутренней мембране митохондрий, где образуется АТФ. На этом этапе высвобождается 2/3 энергии питательных веществ. 2. Стадии свободно-радикального окисления липидов.
1. Кислородная инициация СПОЛ: антикислородное дей-е – строение неповрежденной клеточной мембраны создает пространственное затруднение для проникновения кислорода в липидный слой мембран. Уменьшение содержания кислорода в цитоплазме клетки обеспечивается возрастающей его утилизацией в митохондриях.
2. Образование свободных радикалов липидов. Антирадикальное действие: супероксиддисмутаза катализирует взаимодействие супероксидных радикалов кислорода. Серосодержащие аминокислоты (метионин, цистеин) акцептируют супероксидные радикалы и препятствуют образованию H2O2. Экзогенные вещ-ва (феруловая к-та, аксорбиновая к-та) регаируют со свободными радикалами, обрывая цепь последующих реакций СПОЛ.
3. Образование перекисей липидов. Антиперекисное дей-е: глютатионпероксидаза, каталаза. Инактивация гидроперекисей липидов и пероксида водорода.
Свободные радикалы не только разрушают мембраны клеток, они подавляют активность восстановительных ферментов клетки. Благодаря этому окислительный потенциал клетки возрастает, ряд субстратов подвергается свободно-радикальному окислению и образуются первичные радиотоксины. Из фенолов образуются хиноны и семихиноны, из ненасыщенных жирных кислот мембран клеток и субклеточных структур - перекиси, эпоксиды и кетоны жирных кислот. Хиноны и семихиноны угнетают синтез ДНК, подавляют деление, рост и развитие клеток, а также вызывают в ядрах мутации. 3. Роль нейраминидазы и гемагглютининов в вирусной репликации.
Гемагглютинин прикрепляется к полисахаридным цепочкам на поверхности эритроцитов, содержащим остатки сиаловой кислоты. Нейраминидаза специфически отщепляет остаток сиаловой к-ты от полисахаридов мембраны эритроцита, разрушая рецепторы к вирусу на клетках организма-хозяина. Далее вирус проникает в клетку. Задача: у людей, длительно употребляющих алкоголь, снижается эфф-ть некоторых лекарств, в том числе средств для наркоза. У них повышена активность ферментов микросомальной системы, в связи с этим, при приёме ряда препаратов нет ожидаемого эффекта, т.к. они быстро окисляются и выводятся из организма.
