
Производные серы в живой природе
Органические соединения серы играют важную роль в живой природе. Атомы серы в их составе легко вступают в окислительно-восстановительные превращения, а соединения с тиольными и тиоэфирными группами отличаются высокой нуклеофильностью. Можно предположить, что реакции с переносом электронов с участием атомов серы и железа лежали в основе процессов, приведших к зарождению жизни. Первичная оболочка Земли содержала значительные количества сероводорода и двухвалентного железа. Образованные ими железосерные кластеры включались в белковые молекулы для осуществления требуемых для метаболических процессов окислительно-восстановительных превращений. И на современном уровне развития живой природы железосерные белки распространены во всех царствах, включая животных, растения, грибы, бактерии и археи. Они участвуют в переносе электронов в процессе окислительного фосфорилирования в мембранах митохондрий и хлоропластов, обеспечивают работу многих ферментов, в частности, такого важного фермента, как цис-аконитаза в цикле Кребса.
Атомы серы входят в состав двух из двадцати белковых аминокислот – цистеина и метионина:
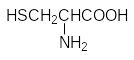
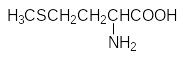
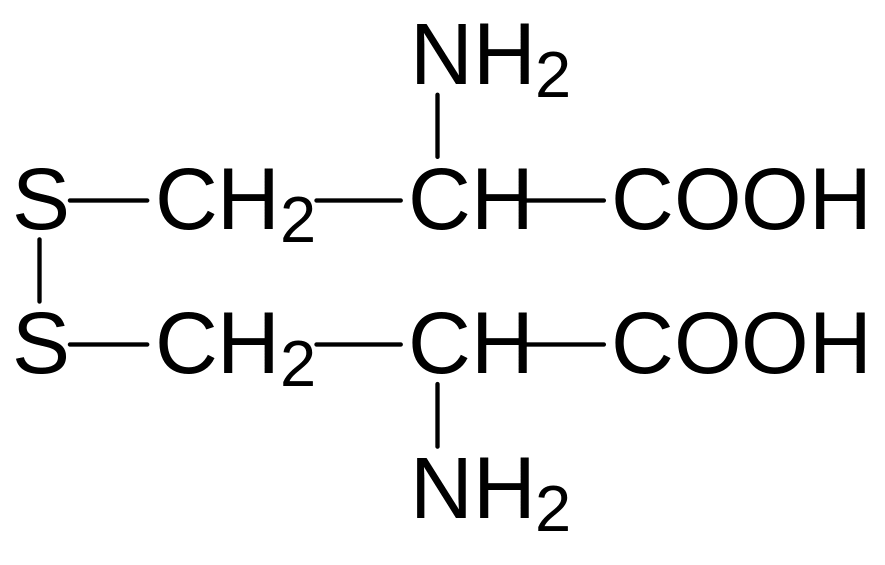
Дисульфидные мостики, образующиеся при окислении сульфгидрильных групп включенных в пептидную цепь молекул цистеина стабилизируют третичную структуру белков. При гидролизе белков две соединенные дисульфидной связью молекулы цистеина выделяются в виде ещё одной серосодержащей аминокислоты цистина:
Образование всех сероорганических соединений в живой природе начинается с биосинтеза белковой аминокислоты цистеина. Поступающий в клетки растений и микроорганизмов сульфат реагирует с аденозинтрифосфатом. Образующийся в этой реакции аденилсульфат переносит сульфатный остаток на сульфгидрильную группу в молекуле белка переносчика с образованием структурного элемента -S-SO3H, который восстанавливается ферредоксином, превращаясь в -S-SH. Такой механизм восстановления сульфата реализуется для того, чтобы исключить образование токсичного и подвижного сероводорода. Далее при катализе цистеинсинтазой функциональная группа -S-SH реагирует с ацетатом серина по схеме:


Из цистеина в растительных клетках образуется другая белковая аминокислота метионин. Для этого β-карбоксильная группа аспарагиновой кислоты восстанавливается с образованием гомосерина в цепочке превращений:


Образовавшаяся гидроксильная группа ацилируется ацилкоферментом А, а О-ацилированный гомосерин при катализе О-ацилгомосерин-(тиол)лиазой реагирует с цистеином с образованием цистатионина:


Далее цистатионин-β-лиаза разлагает цистатионин на гомоцистеин и пируват аммония:

Образовавшийся гомоцистеин метилируется по атому серы N5‑метилтетрагидрофолилтриглутаматом (N5-Me-H4Fol-TriGlu):
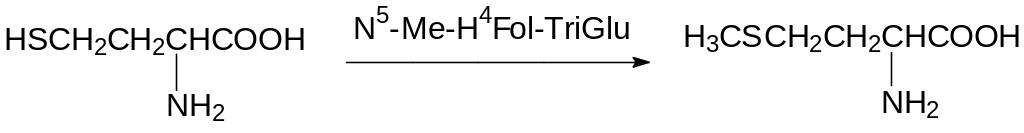
Содержания метионина в растениях, лежащих в начале пищевой цепи гетеротрофных представителей живого, чаще всего достаточно для покрытия потребности организмов животных в органических соединениях серы. Лишь при составлении комбикормов для птиц появляется потребность в добавлении метионина. В соответствии с этим протекающие в клетках животных метаболические процессы используют метионин в качестве основного исходного продукта для образования сернистых соединений, включая цистеин, а метионин является незаменимой аминокислотой.
При недостатке цистеина часть поступающего с пищей метионина превращается в эту аминокислоту. Ключевым соединением и в этом случае является цистатионин. Связанные с этим биохимические реакции включают образование из метионина и аденозинтрифосфата S‑аденозилметионина и его деметилирование с образованием гомоцистеина, который реагирует с серином с образованием цистатионина:

После этого по аналогии с представленной выше схемой биосинтеза цистеина в метаболизме растений цистатионин разлагается пиридоксальфосфатзависимым ферментом γ-цистатионазой, но в клетках животных он разлагается не на гомоцистеин и пируват, а на цистеин и α‑кетобутират:

Образующиеся из цистеина структурные элементы с сульфгидрильными группами участвуют в работе активных центров оксидоредуктаз (тиоредоксин), а также в работе мультиферментной системы, синтезирующей пальмитиновую кислоту, из которой образуются все другие жирные кислоты. В результате декарбоксилирования цистеина образуется цистеамин H2NCH2CH2SH, входящий в состав участвующего во всех превращениях жирных кислот и в синтезе пренильных соединений, терпенов и стероидов кофермента А (CoA-SH):
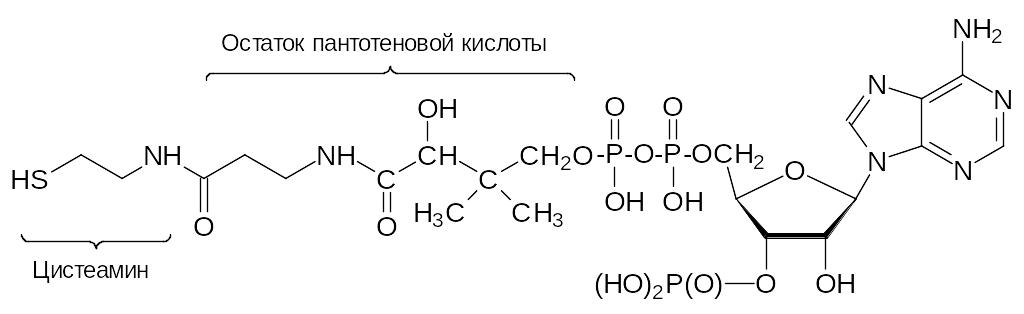
Окисление цистеамина приводит к образованию таурина H2NCH2CH2SO3H с самыми разными регуляторными функциями в биохимических процессах в живых системах.
В работе пируватдегидрогеназного мультиферментного комплекса участвует простетическая группа на основе липоевой кислоты с дитиолановым структурным элементом:
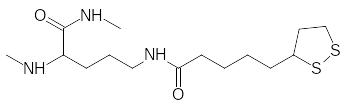
Дисульфидная связь в этом гетероцикле раскрывается в реакции с гидроксиэтильным остатком, связанным с тиаминпирофосфатным коферментом. Дитиолановый цикл при этом раскрывается, принимая образовавшуюся из гидроксиэтильного остатка ацетильную группу по одному из атомов серы. После переноса ацетильной группы на кофермент А соединенный с ферментом остаток липоевой кислоты оказывается в восстановленном виде, превращаясь в 1,3-дитиол. Обратное превращение дитиола в дитиолан протекает по схеме дегидрирования. Однако дитиольный структурный элемент в остатке дигидролипоевой кислоты может реагировать с ионами тяжёлых металлов, связываясь с ними двумя прочными связями. Эти соли уже не могут участвовать в окислительно-восстановительных превращениях, и работа пируватдегидрогеназного мультиферментного комплекса блокируется. Это лишает клетку важнейшего источника энергии. Тяжёлые металлы связываются и с другими сульфгидрильными группами в составе белков и ферментов, вызывая серьёзные отравления. Липоевая кислота легко образуется в организме из других серосодержащих соединений, но в свободном виде она в организме присутствует в ничтожных количествах. Понятно, что введение в организм малотоксичных дитиольных соединений может быть использовано для профилактики и лечения отравлений солями мышьяка, ртути, свинца, таллия и других тяжёлых металлов. Одним из таких соединений является входящая во все фармакопеи дигидролипоевая кислота:
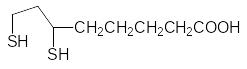
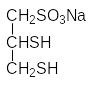
Синтетическими препаратами с аналогичным антидотным действием являются дитиоглицерин (БАЛ) и унитиол (натриевая соль 2,3-димеркапто-пропансульфокислоты):
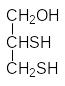
Простетическая группа ферментов, вводящих в молекулы метаболитов карбоксильную группу с образованием СС-связи, например, при превращении пировиноградной кислоты в щавелевоуксусную или пропионилкофермента А в метилмалонилкофермент А, основана на биотине (витамин Н), в состав которого входит тиолановый гетероцикл:

Ещё два кофермента с тиольными группами 2‑меркапто-этансульфокислота (кофермент М) и фосфат N-ω-меркаптогептаноил-треонина (кофермент В) принимают участие в образовании метана анаэробными метанобразующими бактериями:
-
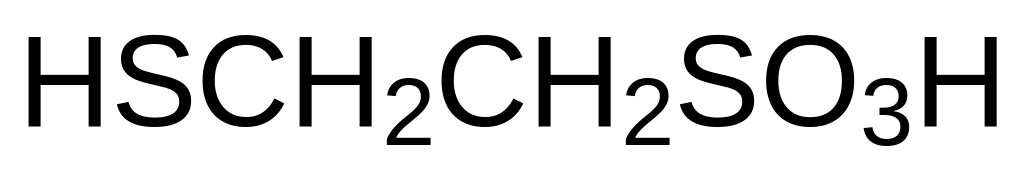
и

2-Меркаптоэтансульфокислота используется в качестве лекарственного средства Месна (стр. ).
Важную роль в обеспечении нормального функционирования клеток организма играет глютатион — γ-глютамил-цистеинил-глицин:
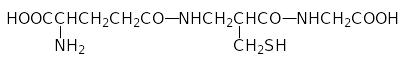
Молекула этого достаточно простого вещества состоит из трёх белковых аминокислот (в биохимии его обозначают GSH, где SH – это участвующая в превращениях глютатиона сульфгидрильная группа). Глютатион считается трипептидом, хотя в его составе есть только одна пептидная связь, образованная карбоксильной группой остатка цистеина и аминогруппой остатка глицина. Многие бактерии, все грибы, растения и животные могут синтезировать глютатион из глютаминовой кислоты, цистеина и глицина в двухстадийном процессе с участием двух молекул аденозинтрифосфата (АТФ, АТР), при этом скорость его образования лимитируется содержанием в цитозоле свободного цистеина. Глютатион является главным антиоксидантом в водных средах и регулятором окислительно-восстановительных процессов. Окисление глютатиона активными формами кислорода протекает по сульфгидрильной группе с образованием дегидроглютатиона GSSG с дисульфидной связью. Фермент глютатионредуктаза с участием NADH восстанавливает дисульфидную связь в этом соединении, регенерируя GSH. Повышенное содержание в биологических средах организма дегидроглютатиона свидетельствует о наличии оксидативного стресса.
Глютатион также является ингибитором свободнорадикальных процессов, защищая, например, организм от ионизирующего излучения. Он поддерживает в активном состоянии такие поступающие с пищей антиоксиданты, как аскорбиновая кислота и витамин Е (токоферол). Нуклеофильный характер атома серы в сульфгидрильной группе глютатиона используется живой природой для нейтрализации ксенобиотиков с алкилирующей способностью, например:
![]()
Из образующегося при этом сульфида глютатион не регенерируется. С N-конца от него гидролазами отщепляется глютаминовая кислота и с С‑конца глицин, а замещенный по атому серы цистеин выводится из организма после ацетилирования по атому азота в виде растворимой в воде соли соответствующего производного меркаптуровой кислоты, например, для S-бензильного производного:
![]()


Уникальные функциональные и регуляторные свойства глютатиона позволяют использовать его для лечения онкологических, сердечнососудистых и нейродегенеративных заболеваний. Так, например, развитие злокачественных опухолей может быть заторможено комплексным препаратом Реканкостат, в состав которого входят цистеин, глютатион и антоциановые красители из таких ягод, как черника, черноплодная рябина и смородина. Глютатион в составе лекарственных сред должен поступать в организм в неокисленном виде, т.е. как GSH, для защиты его от окисления можно использовать ацетильную защиту по атому серы, которая легко снимается в организме ацетилазами. В соответствии с этим в продажу уже поступает в качестве биодобавки S-ацетилглютатион от компании Эвалар.
Важную роль в реализации сигнальных функций монооксида азота играют S-нитрозотиольные соединения, главным из которых является S‑нитрозоглютатион (GSNO). Эти эндогенные соединения, образующиеся из легко окисляющегося и слишком лабильного NO и тиолов, служат достаточно стабильным и быстро мобилизуемым источником монооксида азота, кроме того, они участвуют в детоксикации пероксидных соединений, а S‑нитрозоглютатион ингибирует также агрегацию тромбоцитов. Механизм образования S‑нитрозоглютатиона неизвестен, но он может образовываться в результате нитрозирования глютатиона азотистым агидридом N2O3, образующимся при окислении монооксида азота.
Nitrosoglutathione (GSNO) is an endogenous S-nitrosothiol (SNO) that plays a critical role in nitric oxide (NO) signaling and is a source of bioavailable NO. NO coexists in cells with SNOs that serve as endogenous NO carriers and donors. SNOs spontaneously release NO at different rates and can be powerful terminators of free radical chain propagation reactions, by reacting directly with ROO• radicals, yielding nitro derivatives as end products.[1] NO is generated intracellularly by the nitric oxide synthase (NOS) family of enzymes: nNOS, eNOS and iNOS while the in vivo source of many of the SNOs is unknown. In oxygenated buffers, however, formation of SNOs is due to oxidation of NO to dinitrogen trioxide (N2O3).[2] Some evidence suggests that both exogenous NO and endogenously derived NO from nitric oxide synthases can react with glutathione to form GSNO.
Тиоэфирные группы в составе белков и аминокислот могут окисляться с образованием сульфоксидных групп предназначенными для биотрансформации ксенобиотиков неизбирательными монооксигеназами. Восстановление окисленных тиоэфиров соответствующими S- и R‑сульфоксидредуктазами возможно в том случае, когда сульфоксидная функциональная группа достаточно свободна для включения её в активный центр фермента. В белках метионин участвует в образовании внутренней гидрофобной сферы и поэтому восстановление его окисленной формы становится невозможным. Это отражается в том, что старение организма человека сопровождается увеличением содержания окисленного метионина в составе его белков.
Активное участие в образовании холина — соли триметил-2- гидроксиэтиламмония — принимает образующийся из метионина S‑метилметионин:
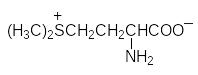
Холин является структурным элементом таких биомолекул, как нейромедиатор ацетилхолин и мембранные липиды.
Кроме этого, S‑метилметионин нормализует обмен жиров и защищает от эрозии стенки желудка. Это его свойство использовалось для лечения язвы желудка, из-за чего его даже называли витамином U (от лат. ulcer — язва). Известно также антигистаминное и антидепрессантное действие S‑метилметионина. Это вещество содержится в сырых овощах, в частности, для лечения язвы желудка использовали свежеприготовленный сок из капустных листьев. Недостаток в этом эндогенном биоактивном веществе, проявляющем к тому же антитоксикантные свойства, испытывают курильщики и те, кто злоупотребляет алкоголем. С этим, очевидно, связан повышенный риск появления у них гастрита и язвы желудка.
В водорослях и в фитопланктоне S-метилметионин подвергается декарбоксилированию и окислительному дезаминированию. Конечным продуктом этих метаболических превращений становится диметилсульфониопропионат (диметил-2-карбоксиэтилсульфоний):
![]()
Предполагается, что это вещество участвует в осмотических эффектах в клетках водных организмов. Диметилсульфониопропионат не имеет ни вкуса, ни запаха. Он накапливается в морских организмах, питающихся фитопланктоном (моллюски, коралловые полипы). Его влияние на человеческий организм пока не стало объектом детального изучения, но именно с ним, очевидно, связано хорошее самочувствие тех, кто употребляет в пищу сырые морепродукты. При нагревании диметилсульфониопропионат разлагается с выделением диметилсульфида, неприятный запах которого сопровождает процесс термической обработки морепродуктов.
Превращения диметилсульфониопропионата в природе приводят к образованию диметилсульфоксида, который восстанавливается до диметилсульфида ДМСО-редуктазой — ферментом с атомом молибдена в активном центре. Летучий диметилсульфид поступает в атмосферу и здесь окисляется до гигроскопичной метансульфокислоты. Образовавшиеся в результате сорбции воды метансульфокислотой микрокапли служат центрами конденсации влаги воздуха над океанами. Образующиеся при этом облака играют важную роль в поддержания теплового режима Земли, т. к. над океанами нет пыли, способствующей образованию облаков над континентами. Увеличенная облаками отражающая способность Земли (альбедо) является определяющим погоду климатическим фактором.
Сернистые соединения определяют бактерицидные, фунгицидные и противовирусные свойства лука и чеснока. Лечебные свойства этого растения упоминаются во всех дошедших до наших времён древних медицинских трактатах. В цитоплазме интактных клеток этих растений содержится производное цистеина аллиин (от лат. allium - чеснок). Он представляет собой замещенный по атому серы аллильной группой цистеин, образующийся из γ-глютамилцистеина в результате ферментативных превращений, сопровождающихся укорочением углеродного скелета структурного элемента глютаминовой кислоты:

При разрушении клеток аллиин входит в контакт с находившимся в вакуолях ферментом аллииназой, которая разлагает две молекулы аллиина на аллицин и пируват аммония

Аллицин представляет собой тиоэфир, образованный пропентиолом и пропенсульфиновой кислотой. Именно это вещество, образующееся при разрушении клеток чеснока, определяет резкий запах и жгучий вкус, которые ощущаются во рту во время еды пищи с добавлением чеснока.
Ajoene
Кроме аллицина из аллиина в меньших количествах образуются и другие сераорганические соединения, определяющие вместе с ним лечебные свойства чеснока. При измельчении головок чеснока число низкомолекулярных серасодержащих соединений в образующейся массе возрастает в несколько раз. Кроме того, в чесноке содержатся повышенные количества селенорганических соединений, образующихся по аналогии с сераорганическими. Во всём этом комплексе активных веществ, очевидно, проявляется эффект синергизма, поскольку получить такой же лекарственный эффект с отдельными выделенными из прошедшего естественную ферментацию сока чеснока не удается.
В растениях семейства крестоцветных содержится широкий спектр S‑глюкозидов, которые гидролизуются тиогликозидазой (мирозиназой) с образованием сульфатов оксиминотиокислот:

Эти неустойчивые соединения разлагаются различными путями. В частности, в кислых средах они превращаются в нитрилы RCN, тогда как в нейтральных из них образуются изотиоцианаты RNCS.
Самым известным тиогликозидом является тиогликозид синигрин (R = CH2CH=CH2).

Он содержится в растениях горчицы, хрена, рапса. Особенно много его в семенах горчицы и в корне хрена. Мирозиназа разлагает синигрин с образованием аллилизотиоцианата (CH2=CHCH2NCS), известного как аллилгорчичное масло. Это вещество с резким запахом и жгучим вкусом защищает растения от поедания травоядными животными.
Съеденная в сыром виде капуста брокколи защищает от заболеваний некоторыми видами злокачественных опухолей. Считается, что это связано с образованием в разрушающихся растительных клетках сульфорафана (4‑метилтиоксобутилизотиоцианата). Сульфорафан, как и аллилизотиоцианат, представляет собой продукт ферментативного превращения содержащегося в растениях семейства капустных S‑глюкозида:
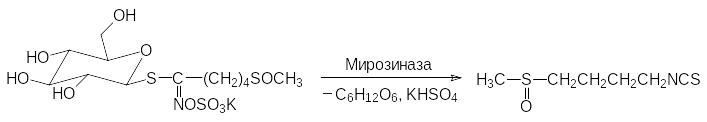
В сваренной брокколи это вещество содержится в ничтожном количестве, поскольку нагревание денатурирует фермент мирозиназу и ускоряет гидролиз изотиоцианатных групп. Интересно, что полученный синтетическим путём сульфорафан лишён противораковой активности.
Противораковая активность обнаружена у ещё одного S-глюкозида – глюкобрассицина:

В разных концентрациях это вещество содержится практически во всех растениях семейства капустных, но максимальным содержанием глюкобрассицина отличается вайда красильная. Ферментация листьев вайды использовалась древними кельтами для получения синего красителя, известного сейчас как индиго. Глюкобрассицин снижает риск заболевания раком молочной железы, раком лёгкого и других видов злокачественных опухолей. Действие мирозиназы на глюкобрассицин должно приводить к образованию индол-3-илметилизотиоцианата, но это вещество неустойчиво и в продуктах ферментативного разложения глюкобрассицина обнаруживается в основном индол-3-илкарбинол. Он уже поступает в продажу в качестве биоактивной пищевой добавки, но опыты по использованию его в качестве противоракового средства, антиоксиданта и противосклеротического средства продолжаются.
Понятно, что образующиеся при разрушении растительных клеток сернистые соединения с резким запахом и жгучим вкусом, предназначены прежде всего для пассивной защиты растений от поедания их травоядными животными, а положительный эффект, оказываемый ими в отдельных случаях на здоровье человека, вовсе не означает, что природа специально приготовила их для использования нами в качестве лечебных средств. Так, например, все плесневые грибы выделяют в субстрат, на котором они развиваются, микотоксины, предназначенные для защиты этой среды обитания от других плесневых грибов и бактерий. Многие из микотоксинов токсичны и для человека. Так, например, построенные из аминокислот с участием цистеина токсины бледной поганки вызывают отравления с летальным исходом. Но всё же широкие исследования биологической активности микотоксинов привели к обнаружению бактерицидных веществ с невысокой токсичностью для теплокровных. Нам такие соединения известны как антибиотики. В качестве примера серасодержащих антибиотиков можно привести формулы пенициллинов и цефалоспоринов, например:


Из морских многощетинковых червей нереид выделен токсин с дитиолановым структурным элементом нереистоксин:
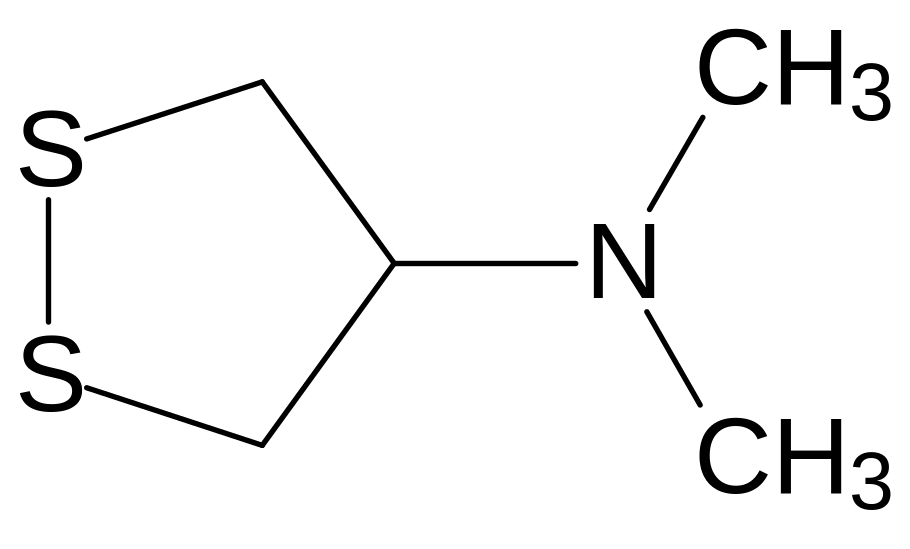
Он показал хорошие инсектицидные свойства при достаточно низкой токсичности для теплокровных. По механизму действия нереистоксин представляет собой антагонист ацетилхолина на холинорецепторах, блокирующий передачу нервных импульсов. Его структура была использована для дизайна более эффективных и безопасных инсектицидов, в числе которых, например, тиоциклам (эвисект, 5-диметиламино-1,2,3-тритиан) и бенсултап (банкол, 1,3-бис(бензолсульфонилтио)-2-диметиламинопропан):
 и
и
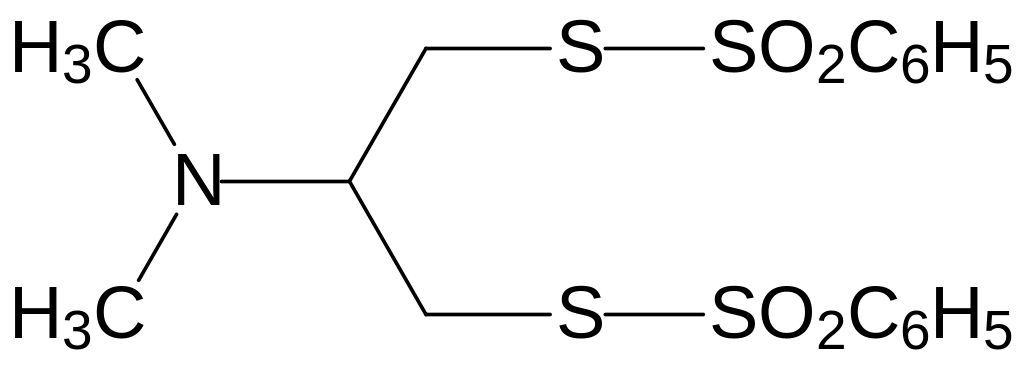
Важное преимущество этих соединений в сравнении с фосфорорганическими и карбаматными инсектицидами состоит в том, что они не взаимодействуют с холинэстеразой и поэтому не вызывают необратимых изменений в работе холинэргических синапсов.
Представленными примерами биологически активных соединений с атомами серы, выделенных из животных, растений и микроорганизмов, конечно, не исчерпывается всё многообразие использования особенностей этого элемента живой природой для биосинтеза защитных веществ.
