
Органические производные серы
В учебной литературе по органической химии достаточно много внимания уделяется химии органических производных серы, представленных в основном сульфокислотами и тиолами (меркаптанами). Есть также многочисленные монографии, в которых детально рассматриваются способы получения и свойства других органических соединений с атомами серы. В качестве примера можно привести работы Оаэ Сигеру, «Химия органических соединений серы», 1975 г., 512 с., и «Химия органических соединений серы» под ред. Л. И. Беленького, 1988 г., 320 с., включающей даже такие разделы, как исследование органических реакций с помощью соединений с радиоактивными изотопами серы, квантово-химические расчеты молекул с атомами серы и др., однако те, кто специализируется в области химии биологически активных соединений, вряд ли обратятся к этим всеобъемлющим и малодоступным трудам.
Большое практическое и теоретическое значение имеют производные тиофена, тиазола, тиадиазола, фенотиазина и других серосодержащих гетероароматических соединений. В молекулах этих гетероциклов электроны атома серы включены в ароматические системы и в связи с этим изучение таких веществ относится, конечно же, к специальным разделам химии ароматических соединений.
В серосодержащих органических соединениях, как и в неорганических, степень окисления серы составляет от –2 до +6. Это подразумевает большое разнообразие элементорганических соединений с атомом серы, однако в практическом отношении наибольший интерес представляют
тиолы R-SH
сульфиды R-S-R
дисульфиды R-S-S-R
сульфоксиды R-SO-R
сульфеновые кислоты R-SOН
сульфиновые кислоты R-SO2Н
сульфоновые кислоты R-SO2OH
сульфоны R-SO2-R
Особенность
номенклатуры сероорганических соединений
состоит в том, что в основе названия
соединения с одной SС-связью
лежит углеводород или его производное,
например, СН3SН
– метантиол, СН3С6Н4SО3Н
– толуолсульфокислота, а в названия
соединений с двумя SС-связями
органические остатки входят как радикалы:
СН3SСН3
– диметилсульфид. Часто названия
сероорганических соединений образуются
из названий соответствующих кислородных
производных с префиксом тио,
например, это тиоэфиры R2S,
тиофенол (фенилмеркаптан), тиоанизол
(метилфенилсульфид) и т.д. Префикс тио
используется также для названий аналогов
кислородсодержащих соединений с атомами
серы, для которых другие варианты были
бы слишком сложными. Например, это
окрашенные в цвета от жёлтого до синего
тиокетоны R2C=S,
тиокислоты RCSOH и тиоэфиры RC(S)OR' и RC(O)SR'
(О- и S-эфиры тиокарбоновых кислот).
Для циклических соединений с атомом серы используются названия:
![]()
![]()
![]()

Тииран Тиетан Тиолан Тиан
Соединения двухвалентной серы
Тиолы, называющиеся также меркаптанами (от лат. corpus mercurio captum — связывающие ртуть вещества), представляют собой тиоаналоги спиртов. В природе встречается достаточно много тиольных соединений. Одна из белковых аминокислот цистеин представляет собой меркаптоаланин НSСН2СН(NН2)СООН, цистеин входит также в состав трипептида глютатиона (γ-Glu-Cys-Gly). В состав кофермента А входит ацилированный по атому азота тиоэтаноламин (цистеамин), а бутантиол является одной из дурно пахнущих компонент секрета, выделяющегося при опасности из специальных желез скунса. Неприятный запах меркаптанов распознается в очень низких концентрациях (10-7-10-8 моль/л). Поэтому этилмеркаптан и третбутилмеркаптан используют для одорирования подаваемого в жилые помещения природного газа для того, чтобы можно было обнаружить его утечку. Однако в низкой концентрации некоторые тиолы могут иметь и приятный запах, в частности, в состав ароматических веществ жареного кофе входит фурфурилтиол, а следовые концентрации 4‑меркапто-4-метилпентан-2-она придают характерный аромат винам сорта Совиньон.
Способы получения тиольных соединений включают прямое алкилирование гидросульфидов щелочных металлов алкилгалогенидами, диалкилсульфатами или алкилсульфонатами. Так, например, из диметилсульфата и гидросульфида натрия можно получать метантиол:

Эта реакция сопровождается образованием значительного количества диметилсульфида в результате алкилирования диметилсульфатом соли образовавшегося метилмеркаптана, находящейся в равновесии с гидросульфидом натрия:
![]()

Более избирательно протекает образование меркаптанов в двухстадийном процессе, когда на первой стадии проводят алкилирование тиосульфата:

Полученные соли моноэфиров тиосерной кислоты (их иногда называют солями Бунте) гидролизуются в присутствии кислот с образованием алкантиолов:

Аналогичный способ получения тиолов представлен алкилированием и последующим гидролизом моноэфиров дитиоугольной кислоты (ксантогенатов), образующихся по реакции сероуглерода с алкоголятами:

![]()
Образующийся в этой реакции серооксид углерода представляет собой очень токсичный и легко воспламеняющийся газ.
Тиолы образуются также при щелочном гидролизе тиурониевых солей, которые получают алкилированием тиомочевины алкилгалогенидами:
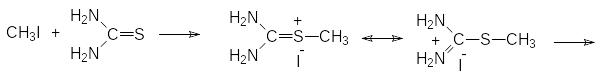
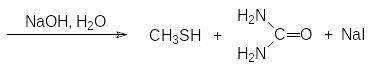
Однако промышленное производство газообразного метантиола, используемого, в частности, в производстве аминокислоты метионина, основано на алкилировании сероводорода метанолом в газовой фазе при катализе оксидом алюминия при температуре 300-350 °С:

Метантиол конденсируется в жидкость при температуре 5,9 °С Тиольные соединения образуются также в результате присоединения сероводорода к двойным связям олефинов. В присутствии генераторов свободных радикалов или при облучении УФ светом присоединение протекает против правила Марковникова. Так, например, в кварцевом реакторе гидрохлорид аллиламина реагирует с избытком сероводорода в спиртовой среде в свете ртутной лампы с образованием гидрохлорида 3‑меркаптопропиламина:
![]()
Олефины, легко образующие карбокатионы, присоединяют сероводород в присутствии кислот:

Побочными продуктами в реакциях присоединения сероводорода к олефиновым соединениям являются соответствующие тиоэфиры, а при недостатке сероводорода это направление реакции становится основным.
Против правила Марковникова в присутствии оснований сероводород и тиольные соединения присоединяются к активированным электроноакцепторными группами двойным связям. В частности, так из метилмеркаптана и акролеина при катализе третичным амином в промышленном масштабе получают 3‑метилтиопропионовый альдегид (метиональ) – промежуточный продукт в производстве D,L‑метионина:

Интересно, что при катализе ацетатом меди выход целевого продукта в этой реакции может достигать 97 %.
На этой реакции основан, очевидно, и защитный эффект лекарственного средства на основе 2-меркаптоэтансульфокислоты (Месна):
![]()
Этот препарат принимают при химиотерапии онкологических заболеваний циклофосфамидом и ифосфамидом. Превращения этих цитостатиков в организме приводят к образованию акролеина, оказывающего токсический эффект на ткани мочевого пузыря и почек. Сопровождение лечения этими препаратами приёмом Месны значительно снижает риск геморрагического цистита и гематурии. Присоединяясь по активированной двойной связи акролеина сульфгидрильной группой по аналогии с представленным выше уравнением реакции с метантиолом, Месна значительно снижает токсический эффект акролеина. Известно также применение Месны в качестве муколитического средства по аналогии с ацетилцистеином (АЦЦ, АСС).
Присоединение сероводорода по тройным связям протекает неселективно. Продуктами реакции становятся цис- и транс-изомеры соответствующих дивинилсульфидов.
1,3-Диацетиленовые соединения реагируют с сероводородом в слабощелочной среде с образованием тиофенов, например:

Хлорангидриды ароматических сульфокислот достаточно устойчивы в кислых водных средах при комнатной температуре. В соответствии с этим их можно использовать для синтеза тиолов ароматического ряда (тиофенолов) восстановлением цинком в соляной кислоте:
![]()
Еще один способ получения тиофенолов основан на реакции солей арилдиазония с гидросульфидом натрия, например:
![]()
Побочным продуктом в этой реакции становится дифенилсульфид, образующийся в результате взаимодействия соли диазония с первичным продуктом этой реакции тиофенолом. Более избирательный способ получения тиофенолов основан на реакции солей диазония с ксантогенатами. Продуктами этой реакции становятся S‑ариловые эфиры О-алкилдитиоугольных кислот, которые, как это было представлено выше в схеме получения алкантиолов, гидролизуются с образованием тиофенолов:
![]()
Тиольные соединения образуются также в реакциях магнийорганических соединений с элементной серой. Этим способом удобно получать тиофенолы:
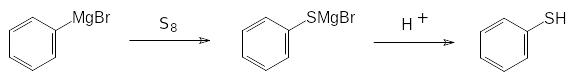
В реакцию с металлорганическими соединениями вступают дисульфиды, легко образующиеся из тиольных соединений даже при окислении кислородом воздуха. В качестве примера можно привести получение несимметричных тиоэфиров в результате взаимодействия дисульфида с литийорганическим соединением:
![]()
Понятно, что образовавшуюся в качестве побочного продукта литиевую соль этантиола также можно перевести в тиоэфир действием, например, бутилбромида:
![]()
Как отмечалось выше, тиоэфиры образуются в качестве побочных продуктов при получении тиолов алкилированием и арилированием сульфидов.
К олефиновым двойным связям присоединяются хлориды серы. Так, например, один из способов получения 2,2´-дихлордиэтилсульфида, использовавшегося в качестве боевого отравляющего вещества, известного как иприт, горчичный газ и др., представлен реакцией дихлорида серы с этиленом:
![]()
При взаимодействии с алкилгалогенидами тиоэфиры превращаются в сульфониевые соединения:
![]()
Сульфониевые соединения переносят алкильные группы на нуклеофильные центры. Эта реакция используется живой природой для метилирования различных субстратов. В роли метилирующего средства в метаболических превращениях выступает S-аденозилметионин, образующийся при алкилирования метионина аденозинтрифосфатом:

Тиольные соединения значительно легче чем спирты образуют с карбонильными соединениями тиоацетали и, соответственно, тиокетали. В качестве примера можно привести взаимодействие глюкозы с этантиолом. Карбонильная группа глюкозы участвует в образовании циклического полуацеталя (пиранозная форма глюкозы). При нагревании с метанолом в присутствии кислоты с сохранением пиранового цикла этерифицируется аномерная гидроксильная группа и образуется метилглюкозид, представляющий собой полный ацеталь, тогда как взаимодействие глюкозы с этилмеркаптаном приводит к раскрытию цикла и к образованию дитиоацеталя глюкозы линейного строения:

При действии оксида ртути дитиоацетали снова превращаются в карбонильные соединения, а в реакции с никелем Ренея оба атома серы в дитиоацеталях заменяются на атомы водорода. В соответствии с этим образование дитиоацеталя и последующее превращение его в реакции с никелем Ренея можно использовать для перевода карбонильной группы кетона в группу СН2 и альдегидной функциональной группы в метильную группу:

Атом серы активирует атомы водорода в соседних СН‑связях. Тиоэфиры легко хлорируются в α‑положение к атому серы. Образующиеся продукты хлорирования легко гидролизуются водой с образованием полутиоацеталей:

Активированные атомы водорода СН-связей в тиоэфирах могут замещаться атомами лития в реакциях, например, с бутиллитием. Это свойство можно использовать в синтезе самых разных соединений. В качестве примера можно привести получение α‑гидроксизамещенного альдегида по схеме:


Один из способов образования СS-связи представлен реакцией неорганических роданидов с алкилгалогенидами, например:
![]()
Полученное в соответствии с представленной схемой соединение используется в качестве инсектицида Летан 384 (Регулар) с токсичностью для мышей около 90 мг/кг. При выделении органических роданидов из реакционной массы следует принимать во внимание, что при нагревании они изомеризуются в изотиоцианаты:
![]()
Ароматические соединения с гидроксильными и аминными группами реагируют с роданом (тиоцианогеном) с замещением атома водорода в пара- или орто-положении на роданогруппу, при этом 2-аминороданиды могут циклизоваться с образованием тиазольного цикла:

Более универсальный способ введения тиоцианатных групп в ароматические соединения представлен реакцией солей диазония с неорганическими роданидами в присутствии роданида меди или медного порошка (реакция Зандмейера):

