
Сульфоксиды
Первичными продуктами окисления тиоэфиров являются сульфоксиды. В качестве окислителей тиоэфиров может использоваться пероксид водорода в кислой среде, элементный иод и другие окислители. Многотоннажное производство диметилсульфоксида основано на окислении азотной кислотой диметилсульфида, образующегося наряду с другими сернистыми соединениями при сульфатном способе делигнизации древесины.
Сульфоксиды ароматического ряда могут быть получены по реакции соответствующих ароматических соединений с диоксидом серы при катализе кислотами Льюиса или сильными кислотами:
![]()
Для получения дифенилсульфоксида используют реакцию тионилхлорида с бензолом при катализе безводным хлоридом алюминия:

Хлорид алюминия берут в избытке; после окончания взаимодействия реакционную массу осторожно приливают к разбавленному раствору соляной кислоты при охлаждении.
Сульфоксиды имеют пирамидальное строение и поэтому сульфиды с разными заместителями у атома серы прохиральны – их окисление в сульфоксиды приводит к образованию рацемической смеси пространственных изомеров, которую можно разделить на стереомеры, так как рацемизация их при комнатной температуре идёт очень медленно. Так, например, одним из лекарственных препаратов с сульфоксидной функциональной группой является нейролептик модафинил:
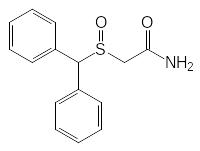
Его применяют для лечения сонливости и в качестве мягкого психостимулятора. При этом оказалось, что R-изомер модафинила (армодафинил) заметно превосходит по активности рацемическую смесь изомеров. Правда, во многих странах модафинил внесен в список потенциальных наркотических средств и запрещен ВАДА к использованию спортсменами.
Сульфоксидная функциональная группа содержится также в молекулах средств для лечения язвы желудка омепразола, лансопразола и их аналогов, действие которых основано на ингибировании протонного насоса (К+,Н+-АТФазы), генерирующего кислотную среду в желудке. И в этом случае пространственные изомеры различаются по активности. Так, например, более эффективными оказались лекарственные средства на основе S-изомера омепразола по сульфоксидной группе (эзомепразол):

Высокая полярность сульфоксидной группы и пирамидальная структура молекулы делают сульфоксиды хорошими лигандами для комплексообразования. Диметилсульфоксид считается апротонным растворителем, т.к. анионы с невысокой основностью (цианидный, фенолятный, енолятный и подобные им) на сольватируются им с образованием водородных связей, а несольватированные анионы значительно легче вступают в реакции нуклеофильного замещения. Важную роль в ускорении реакции играет также специфическая сольватация катионов таким полярным растворителем. В соответствии с этим диметилсульфоксид является одним из самых распространенных апротонных полярных растворителей в лабораторной практике. К тому же у него невысокая цена и он менее токсичен, чем другие растворители с аналогичными свойствами (диметилформамид, гексаметапол и др.).
Под названием димексид диметилсульфоксид используется в фармакологии в качестве местного противовоспалительного и обезболивающего средства. Его вводят также в состав лекарственных средств, предназначенных для трансдермального введения активных начал. В смеси с водой в концентрации от 10 до 50 % он значительно ускоряет поступление лекарств через кожу.
При использовании диметилсульфоксида в качестве растворителя надо учитывать достаточно высокую реакционную способность этого вещества. Так, например, диметилсульфоксид может выступать в роли окислителя. При перегонке при атмоферном давлении (т. кип. 189 °С) идёт частичное диспропорционирование диметилсульфоксида на диметилсульфид и диметилсульфон:
![]()
Диметилсульфоксид может реагировать с галогенводородами по схеме:
![]()
В реакции с первичными алкилгалогенидами или сульфонатами диметилсульфоксид образует сульфоксониевые соли, которые разлагаются действием третичных аминов на альдегид и диметилсульфид (реакция Корнблюма), а п‑толилсульфонат (тозилат) вторичного спирта в реакции с диметилсульфоксидом и триэтиламином превращается в кетон:


Ещё один способ превращения первичных и вторичных спиртов в альдегиды и кетоны с участием диметилсульфоксида представлен окислением по Сверну. В этом случае диметилсульфоксид реагирует с оксалилхлоридом с образованием хлорида диметилхлорсульфония, который далее в присутствии основания реагирует со спиртом по схеме:
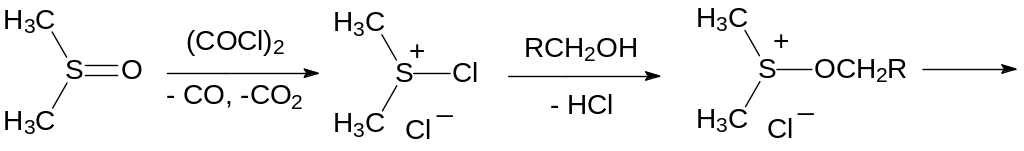

Окислительным превращением алкильного остатка в хлорформиатах сопровождается их реакция с диметилсульфоксидом в присутствии оснований:

Диметилсульфоксид реагирует также с другими ацилирующими реагентами. При этом атом серы восстанавливается, а в одной из связанных с атомом серы алкильных групп повышается степень окисления. В качестве примера приводится реакция метилэтилсульфоксида с уксусным ангидридом (R. Pummerer, 1909), в результате которой происходит окислительное превращение связанной с атомом серы этильной группы, протекающее с образованием ацетильного производного S‑метилполутиоацеталя:
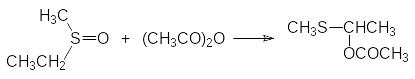
С гидридом натрия диметилсульфоксид реагирует с выделением водорода:
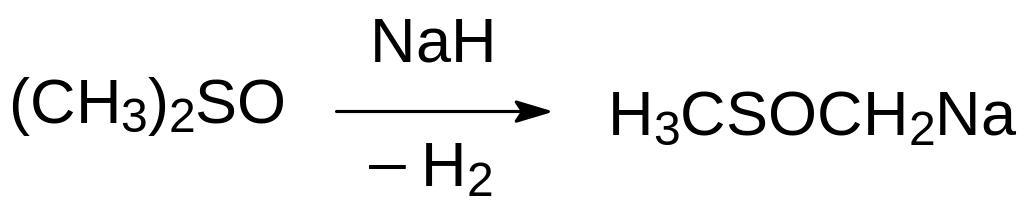
Образующееся при этом натриевое производное диметилсульфоксида (димсилнатрий) представляет собой сильное основание.
Диметилсульфоксид нельзя использовать в качестве растворителя при проведении реакций с участием первичных аминов, так как он реагирует с ними с образованием сульфимидов:

В реакции сульфоксидов с алкилаторами образуются соли сульфоксония. Так, например, метилиодид переводит диметилсульфоксид в иодид триметилсульфоксония:

Важная область применения сульфониевых и сульфоксониевых солей, образующихся при алкилировании тиоэфиров и сульфоксидов, представлена реакциями, известными как реакции Джонсона-Кори-Чайковски (Johnson-Corey-Chaykovsky), которую чаще всего называют реакцией Кори-Чайковски. При действии сильных оснований на соли сульфония и, соответственно, сульфоксония они превращаются в илидные соединения:


Диметилсульфид и диметилсульфоксид являются хорошими уходящими группами, и поэтому в реакциях с непредельными соединениями илиды на основе серы встраивают алкилиденовые группы по двойным связям с образованием трёхчленных циклов. При этом метилид диметилсульфония используется преимущественно для получения оксиранов (эпоксидов). Так, например, в производстве эффективного фунгицида тебуконазола на предпоследней стадии получают эпоксидное соединение действием на 2‑(4-хлорфенилэтил)третбутилкетон метилида диметилсульфония, образующегося из бромида триметилсульфония и третбутилата калия:


В смеси диметилсульфоксида с тетрагидрофураном метилид диметилсульфоксония, полученный из иодида триметилсульфоксония и гидрида натрия, реагирует преимущественно с этиленовыми двойными связями с образованием циклопропанового структурного элемента, например:
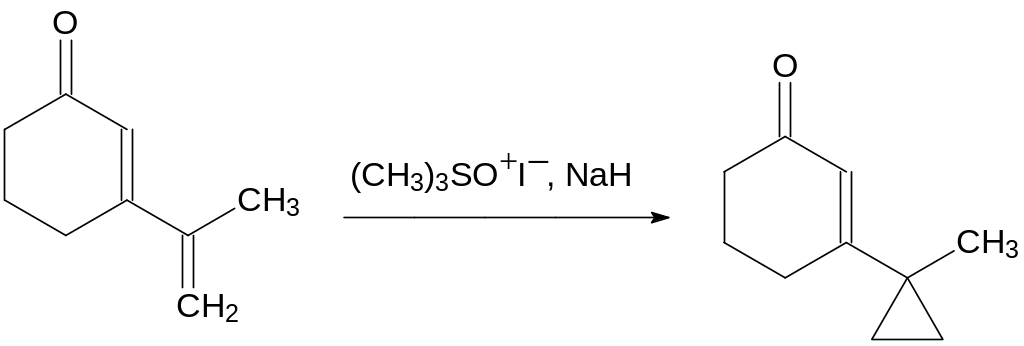
Если в реакции циклопропанирования должен участвовать алкилиденовый фрагмент, отличный от метиленовой группы, реакцию проводят с илидом, образующимся из галогенида алкилдифенил- сульфоксония или алкилдифенилсульфония. Так, например, один из способов получения эфира хризантемовой кислоты, используемой для получения пиретроидных инсектицидов, включает взаимодействие изопропилида дифенилсульфоксония с эфиром 5-метилгекса-2,4-диеновой кислоты:

Вторым продуктом этой реакции становится дифенилсульфоксид, который можно возвращать в процесс для получения соли изопропилсульфоксония.
Метилид диметилсульфоксония реагирует также с оксиранами. Так, например, глицидиловые эфиры реагируют с ним с образованием оксетанов в третбутаноле при температуре 50 °С в течение времени около 4 суток, превращаясь в замещенные оксетаны:

По аналогичной схеме можно переводить азиридины в азетидины.
