
Сульфоновые кислоты
Сульфоновым кислотам, чаще всего называемым сульфокислотами, соответствует общая формула RSO2ОH. Они представляют собой гигроскопичные кристаллические вещества с нечёткой температурой плавления.
Эти вещества можно получать исчерпывающим окислением любых сероорганических соединений — тиолов, дисульфидов или даже роданидов RSCN. Однако чаще всего для их получения используют реакцию сульфирования исходных продуктов концентрированной серной кислотой или олеумом. В эту реакцию вступают соединения как алифатического, так и ароматического ряда. Сульфирование алифатических углеводородов идёт неизбирательно, но алканкарбоновые кислоты достаточно легко сульфируются в α‑положение к карбоксильной группе. Так, например, получают сульфоянтарную кислоту, используемую в качестве исходного соединения в производстве поверхностноактивных веществ:

В более мягких условиях идёт сульфирование алифатических соединений хлорсульфоновой кислотой или аддуктами триоксида серы с диоксаном или пиридином, например:

Интересно, что с помощью таких реагентов можно даже избирательно сульфировать алифатические структурные элементы в составе ароматических соединений:

Алифатические сульфокислоты можно получать алкилированием солей сернистой кислоты. Так, например, в реакции бисульфита калия с этиленоксидом образуется соль 2‑гидроксиэтансульфокислоты:
![]()
Ароматические соединения сульфируются значительно легче алифатических. В качестве сульфирующего реагента используются концентрированная серная кислота или олеумы с содержанием триоксида серы от 5 до 70 %. В реакции сульфирования серной кислотой выделяется вода, замедляющая или даже блокирующая замещение. Поэтому для получения сульфокислот из ароматических соединений берут большой избыток концентрированной серной кислоты или добавляют триоксид серы (олеум), реагирующий с водой с образованием серной кислоты. Можно также удалять образующуюся в реакции сульфирования воду в вакууме или азеотропной отгонкой с растворителем, который не реагирует с серной кислотой.
Скорость сульфирования и направление реакции зависят от строения реагирующего ароматического соединения. Понятно, что электронодонорные заместители значительно ускоряют реакцию сульфирования, тогда как даже такой слабый ориентант второго рода, как карбоксильная группа, значительно замедляет реакцию сульфирования. Ориентация замещения в общем случае соответствует известным правилам нуклеофильного замещения ароматических соединений, но соотношение доли замещения в орто- или пара-положения в значительной мере определяется природой сульфирующего реагента, его концентрацией, температурой реакции и средой, в которой протекает реакция. Так, например, при сульфировании нафталина при температуре около 60 °С основным продуктом реакции является α-нафталинсульфокислота, тогда как при повышении температуры реакции до 150 °С основным продуктом реакции становится β-нафталинсульфокислота. Известны также катализаторы реакции сульфирования, одним которых является металлическая ртуть.
Для сульфирования чувствительных к действию серной кислоты соединений можно использовать в качестве растворителей ацетонитрил, ледяную уксусную кислоту и уксусный ангидрид, жидкий диоксид серы, петролейный эфир и четырёххлористый углерод.
Ароматические сульфокислоты гидролизуются по СS-связи при нагревании с разбавленной серной или соляной кислотой при температуре до 200 °С под давлением. Эту реакцию можно использовать для введения в состав ароматического соединения функциональных групп в такие положения, в которые их нельзя ввести прямым замещением. В качестве примера можно привести получение 2,6-динитроанилина. Синтез этого вещества начинают с сульфирования хлорбензола. Полученную 4‑хлорбензолсульфокислоту нитруют, замещают атом хлора на аминогруппу и отщепляют сульфогруппу нагреванием с разбавленной соляной кислотой:
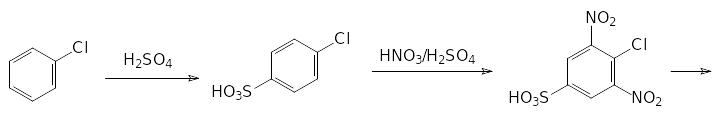
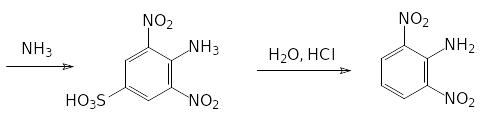
Скорость гидролитического отщепления сульфонатных групп зависит от заместителей в ароматическом кольце. В общем случае действует правило — чем легче идёт сульфирование — тем легче гидролизуется образовавшая сульфокислота. Известен, например, способ выделения м‑дихлорбензола из смеси продуктов хлорирования бензола. При сульфировании смеси о-, м- и п-дихлорбензола образуется в первую очередь 2,4-дихлорбензолсульфокислота, её отделяют и гидролизуют, если нужно получить чистый м‑дихлорбензол.
С разрывом CS-связи соли ароматических сульфокислот реагируют при сплавлении с гидроксидами щелочных металлов. Эта реакция представляет собой один из способов получения фенолов:

При сплавлении с цианидами щелочных металлов сульфонатная группа замещается на цианогруппу. Так, например, из образующейся при сульфировании пиридина пиридин-3-сульфокислоты получают нитрил никотиновой кислоты:

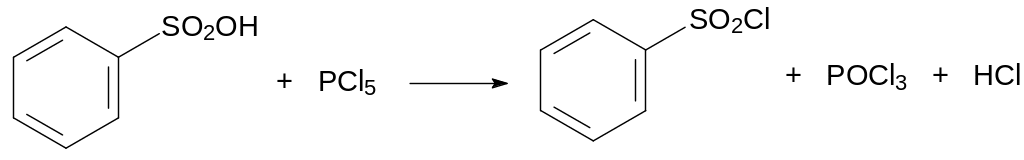
Синтез эфиров и амидов сульфокислот прямым замещением кислотных гидроксильных групп на алкоксигруппы (этерификация) или на амидные группы не реализуем, поэтому для их получения используют хлорангидриды сульфокислот. Синтез сульфохлоридов можно проводить по реакции тионилхлорида или пентахлорида фосфора с сульфокислотами:
Сульфохлориды образуются также при взаимодействии ароматических соединений с избытком хлорсульфоновой кислоты:

Ещё один способ получения сульфохлоридов представлен взаимодействием солей диазония с диоксидом серы, которое, как и все реакции Зандмейера, проводят в присутствии солей одновалентной меди:

Обычно эту реакцию используют для получения из образовавшихся сульфохлоридов амидов сульфокислот. Для этого, не выделяя из реакционной массы достаточно устойчивый к действию воды в кислой среде сульфохлорид, к реакционной массе добавляют соответствующий амин и отделяют образовавшийся амид:

Сульфохлориды образуются также при хлорировании тиольных соединений в воде:
![]()
Важное место в арсенале бактерицидных средств занимают сульфаниламидные препараты. Механизм их действия основан на ингибировании биосинтеза дигидрофолиевой и тетрагидрофолиевой кислот вследствие блокировки фермента дигидроптероатсинтетазы. Простейший представитель этого класса антимикробных препаратов амид сульфаминовой кислоты является антиметаболитом 4-аминобензойной кислоты, которая участвует в образовании фолиевой кислоты. Сульфаниламид, известный под названием стрептоцид, синтезируют из ацетанилида по схеме:


В качестве примера других соединений этого ряда с широким спектром антибактериальной активности можно привести структуры сульфодиметоксина и норсульфазола:


Сульфокислоты находят широкое применение в лабораторной практике, в производстве лекарственных средств и в промышленности. Метансульфокислота (её соли и эфиры часто называют мезилатами) и п‑толуолсульфокислота (её соли и эфиры – тозилаты) используются в качестве катализаторов протекающих в присутствии кислот химических реакций. Так, например, первый способ получения диэтилового эфира был основан на катализируемом серной кислотой взаимодействии двух молекул этилового спирта с отщеплением воды (поэтому его называют серным эфиром), однако в этой реакции серная кислота выступает также в качестве окислителя. Это приводит к непроизводительному расходованию серной кислоты и загрязнению серного эфира продуктами восстановления серной кислоты и окисления этанола. В отличие от серной кислоты п‑толуолсульфокислота не является окислителем и практически не расходуется при катализе превращения этанола в диэтиловый эфир.
Очень сильной кислотой (суперкислотой) является трифторметан-сульфокислота (её соли и эфиры - трифлаты). Современный способ получения трифторметансульфокислоты основан на электрохимическом фторировании метансульфокислоты во фтористоводородной кислоте. Трифторметансульфокислота термически и химически стабильна, что отличает её от других суперкислот, например, от хлорной кислоты HClO4, которая является сильным окислителем.
Сульфокислотные функциональные группы входят в состав многих красителей и ионобменных смол. Многие анионогенные синтетические поверхностноактивные вещества также являются солями сульфокислот.
