
- •Введение
- •Методика исследования
- •Результаты и их обсуждение
- •Заключение
- •От источников тепловых излучений
- •Для серых тел формула (2) имеет вид
- •Кристаллическая структура
- •1. «Жидкий мешок» помогает бороться с терроризмом.
- •2. Применение в медицине
- •3. Жидкий бронежилет
- •4. Применение в спорте
- •5. Применение в косметологии
- •6. Применение в транспорте
- •З аключение
- •Содержание
- •394026 Воронеж, Московский просп., 14
6. Применение в транспорте
Группа студентов Западного резервного университета Кейза (Кливленд, США) предлагает латать дорожное покрытие водонепроницаемыми мешками, наполненными неньютоновской жидкостью. Когда на неё не действуют внешние силы, она течёт, как жидкость, когда же ей приходится иметь дело с телом большой массы (или движущимся на значительной скорости) – превращается в нечто твёрдое. Авторы получили за эту разработку первый приз на инженерном конкурсе, спонсируемом французской материаловедческой компанией Saint-Gobain. Следующая цель изобретателей – коммерциализация продукта. По словам разработчиков, неньютоновская жидкость пришла им в голову из-за своей дешевизны (обычная грязь с водой и крахмалом – и та ведёт себя как неньютоновская жидкость) и особых физических свойств. Когда к ней не прилагают никаких сил, она течёт подобно жидкости, заполняя все щели и неровности. Когда же на неё попадает колесо (или воздействует иная нагрузка) – ведёт себя как твёрдое тело. И главное: в такой «дорожной заплатке» нечему ломаться, а распределение нагрузки на подстилающую поверхность стремится к идеальному (даже лучше, чем в обычном асфальте) и максимально близко к распределению в жидкостях. Дождь не размоет эту заплатку, поскольку она в водонепроницаемом мешке. И колёса машины, естественно, ничего не смогут сделать: от мешка-заплатки нельзя отделить ни частички. Для неньютоновских заплаток нужно просто добавить в мешок воды и запаять затем маленькое входное отверстие. Теоретически после этого состав может и храниться (почти вечно), и немедленно использоваться. «Неньютоновские мешки» можно возить в багажнике, а весь ремонт сводится к метанию мешка в район ямы, после чего он сам сползёт в неё, занимая весь свободный объём. Смесь тяжелее воды, поэтому установку можно проводить даже в сильнейший дождь, она не требует ни значительного времени, ни квалификации. Поверхность таких мешков будут делать чёрной, с тем, чтобы водители не избегали таких «латок». Разработчики уже проверили своё детище на настоящих весенних кливлендских дорогах. Несмотря на то, что общая длительность экспериментов пока не превышает недели, даже в самых напряжённых в транспортном отношении местах никаких проблем использование мешков-заплаток не вызвало. Содержащаяся в них жидкость подобрана устойчивой как к зимним температурам, так и к солям дорожных реагентов. Более того, по расчётам, мешки можно использовать сотни раз, а для их удобного хранения можно слить воду, перед следующим употреблением просто добавив туда порошок-основу (состав которого патентуется) и воду.
литература
1. Уилкинсон У. Л. Неньютоновские жидкости, пер. с англ. М.: 1964. 103 с.
2. Астарита Дж., Марруччи Дж. Основы гидромеханики неньютоновских жидкостей, пер. с англ., М.: 1978, 92 с.
3. Шульман 3. П. Беседы о реофизике. Минск. 1976. 85 с.
Бибик Е. Е. Реология дисперсных систем. Л.-1981. 97 с.
http://www.drivebike.ru/d3o_protection
http://www.narodsobor.ru/events/science/10770-qzhidkaya-sumkaq-obezvredit-bomby#.U0Yrq9KHzQf
http://topwar.ru/13531-zhidkaya-bronya-dlya-zaschity-lyudey.html
Воронежский государственный технический университет
УДК 541. 183
А.В. Рыльков, Е.А. Круцких, В.П. Горшунова
Кинетические исследования поглощения аммиака на основе активных углей и силикагелей
Проведены кинетические исследования поглощения аммиака хемосорбентами на основе активных углей и силикагелей. Выявлено, что лучшими сорбционными свойствами по отношению к аммиаку обладают мелкопористый силикагель КСМГ и уголь АГ-3
Аммиак, являющийся исходным сырьем для производства азотной кислоты и минеральных удобрений, обладает токсическими свойствами. Предельно допустимая концентрация аммиака составляет: в воздухе рабочей зоны 20 мг/м3, в воздухе населенных пунктов максимально разовая и среднесуточная ПДК составляет 0,2 мг/м3.
Кроме того, он применяется в качестве хладагента в аммиачных холодильных установках (АХУ) на предприятиях пищевой промышленности, на которых возможны утечки газа в результате разгерметизации отдельных систем и блоков установки. В целях экологической безопасности выбросы аммиака необходимо улавливать. Это можно осуществить с помощью подходящих адсорбентов, находящихся в специальных контейнерах и помещенных в систему газоотвода.
Нами ставилась задача изучить поглотительную способность наиболее доступных сорбентов - активного угля и силикагелей – по отношению к аммиаку. Мы использовали угли марок АГ-3 и БАУ-А и силикагели разной пористости КСКГ и КСМГ. Угли перед исследованиями обрабатывали «острым паром» в течение 1 часа. В процессе активации развивается необходимая пористость и удельная поверхность. Далее сорбенты импрегнировали 0,1 М раствором CuSO4. При этом использовали наиболее оптимальный способ обработки сорбентов в соответствии с работой [1] – выдерживание в активирующем растворе при периодическом перемешивании в течение 24 ч. Расход раствора составлял 50 мл на 5 г сорбентов.
Далее проводили кинетические исследования поглощения аммиака полученными хемосорбентами. Адсорбция изучалась в статических условиях из одного и того же объема газа вплоть до установления равновесия. Адсорбционная емкость сорбентов определялась количеством адсорбата, поглощенного единицей массы хемосорбента при установлении равновесия. Использовался классический метод гравиметрии при стандартной температуре [2]. Для изучения процесса адсорбции создавались атмосферы с содержанием аммиака по объему, равным 20, 50,100,200 и 400 мг/м3 Получали кинетические зависимости в координатах а, мг/г адсорбента – время (рис.1).
Подобные зависимости позволяют провести сравнительный анализ поглотительной активности различных сорбентов в конкретной атмосфере.
Из рис.1 видно, что лучшими поглотительными свойствами по отношению к аммиаку при объемной концентрации 100 мг/м3 обладает хемосорбент на основе силикагеля марки КСМГ (кривая 4). Далее следует активный уголь АГ-3. Меньшие поглотительные свойства имеет крупнопористый силикагель КСКГ.
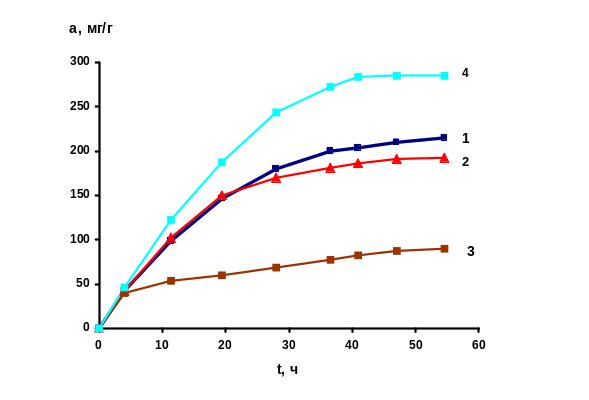
Рис. 1. Зависимость адсорбции аммиака от времени при его объемной концентрации в атмосфере 100 мг/м3: 1 – уголь АГ-3; 2 – уголь БАУ – А , 3 – силикагель КСКГ, 4 – силикагель марки КСМГ
На
основании кинетических кривых получали
графические зависимости а, мг/г
–
![]() ,
мг/м3
(изотерму адсорбции) для изученных
сорбентов (рис.2), которые имеют вид:
,
мг/м3
(изотерму адсорбции) для изученных
сорбентов (рис.2), которые имеют вид:
Изотерма адсорбции показывает распределение хемосорбентов по поглотительной способности по отношению к аммиаку для всех изученных объемных концентраций газа.
Обращает на себя внимание то обстоятельство, что при одинаковых условиях эксперимента лучшими поглотительными свойствами по отношению к аммиаку обладает мелкопористый силикагель. Адсорбция КСМГ больше адсорбции КСКГ в 2,7 – 3 раза, а угля АГ-3 в 1,5 раз. Это согласуется с теми механизмами адсорбции, которые наблюдаются у сорбентов.

Рис. 2. Зависимость поглотительной способности сорбентов от объемной концентрации аммиака: 1 – уголь АГ-3; 2 – уголь БАУ – А;
3 – силикагель марки КСКГ, 4 – силикагель марки КСМГ
У активных углей преобладают мелкие поры, в которых возможна физическая адсорбция, а также после насыщения раствором сульфата меди - донорно-акцепторное взаимодействие с катионами меди по реакции:
[Cu(H2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ + 4H2O. (1)
У силикагелей хемосорбция аммиака протекает по другому механизму. Общим для силикагелей является то, что на их поверхности имеются активные структурные группы (силанольные и вицинальные), которые могут удерживать полярные молекулы аммиака за счет образования водородной связи [3]. Концентрация этих групп в микропорах выше, чем в макропорах, так как сама удельная поверхность микропор превышает удельную поверхность макропор. Удельная поверхность микропор составляет 550 – 900 м2/г, а удельная поверхность макропор значительно меньше, а именно – от 210 до 350 м2/г. Макропоры играют роль крупных транспортных артерий в зернах адсорбентов, так как их эффективные радиусы составляют 100 – 200 нм. Этим можно объяснить тот факт, что адсорбция аммиака силикагелем марки КСКГ проявляется заметно слабее, чем адсорбция силикагелем марки КСМГ и угля АГ-3.
Кроме того, в результате пропитки силикагелей раствором медного купороса их поры содержат аква - комплексы [Cu(H2O)4]2+. Характерный голубой цвет появляется после обработки раствором CuSO4 на гранулах крупнопористого силикагеля. Что касается мелкопористого силикагеля, то голубой цвет слабее. После проведения процесса сорбции аммиака на силикагеле марки КСКГ наблюдается интенсивный синий цвет, характерный для амминокомплексов меди [Cu(NH3)4]2+. У мелкопористого силикагеля цвет изменяется в меньшей степени, преимущественно при больших объемных концентрациях аммиака.
Это свидетельствует о том, что в процессе поглощения аммиака силикагелями наряду с образованием водородной связи аммиака с силанольными и вицинальными группами происходит образование донорно-акцепторной связи с катионом меди. Прочность этого комплекса сравнительно велика. Она определяется на основании расчета константы диссоциации аммиачного комплекса меди.
Константа диссоциации комплекса ионов меди с аммиаком равна 9,33∙10-13, а рК = - lg Kнест. = 12,03 [4], что свидетельствует о большей прочности аммино-комплекса по сравнению с аква-комплексом. Реакция (1) более вероятна в порах крупнопористого силикагеля, так как в процессе пропитки активирующим раствором габаритным аквакомплексам легче перемещаться в крупных порах, чем в более мелких. Значит, у силикагеля КСКГ преобладающими силами, удерживающими аммиак, является донорно-акцепторная связь.
Все вышесказанное позволяет объяснить результаты кинетических исследований процесса хемосорбции аммиака, а именно то обстоятельство, что из силикагелей большими поглотительными свойствам обладает мелкопористый силикигель, а из активных углей – уголь БАУ-А.
Литература
1. Рыльков А.В. Исследование способов получения хемосорбентов аммиака на основе активных углей и силикагелей. [Текст] / А.В. Рыльков // Сб. трудов победителей конкурса на лучшую научную работу студентов и аспирантов ВГТУ. – 2014. – с. 105-107.
2. Кельцев Н.В. Основы адсорбционной техники [Текст]: монография / Н.В. Кельцев. – М.: Химия, 1981. – 592 с.
3. Горшунова В.П. Влияние природы поверхностных гидроксильных групп на сорбционные свойства кремнеземных сорбентов [Текст]. / В.П. Горшунова, А.В. Рыльков, О.В. Чибисова, В.А. Небольсин // Химия, новые материалы, хим. технологии: межвуз. сб. науч. тр.- Воронеж: ФГБОУ ВПО «Воронежский государственный технический университет» , 2011.- С.66-70.
4. Рабинович В.А. Краткий химический справочник [Текст] / В.А. Рабинович, З.Я. Хавин. – С.- Пб.: Химия, 1997. – 392 с.
Воронежский государственный технический университет
УДК 621.315.61
И.В. Винокуров, С.С. Тарасов, И.М. Винокурова
Зависимость скорости распространения пламени от содержания горючего газа
Представлены сведения о жидкостных реактивных топливах, приведены параметры определения изменения концентрации компонентов
Большинство практически применяемых в настоящее время ракетных двигателей (РД) использует химическую энергию -химическое топливо. Источником энергии является реакция горения (экзотермическая, идущая с выделением тепла). Химическая энергия топлива преобразуется в камере сгорания в тепловую энергию продуктов реакции (продуктов сгорания (ПС)). Работа камеры ЖРД (жидкостные ракетные двигатели) зависит от комплекса обслуживающих систем. Рабочий процесс в камере ЖРД можно представить в следующем виде. Горючее и окислитель впрыскиваются под давлением в камеру через форсунки, дробятся на мелкие капли, перемешиваются, испаряются и воспламеняются. После воспламенения топливо горит. Сгорание топлива в камере происходит при высоких давлениях, при горении образуются газообразные продукты сгорания (рабочее тело), нагретые до высоких температур (3000 4500 К), которые истекают из камеры сгорания в окружающее пространство через сопло. Чем больше масса и скорость газа на выходе из сопла, тем больше тяга, создаваемая камерой.
Если реакция двух веществ х и у, при которой образуется вещество z, протекает в одном направлении, то ее можно записать в виде х + у z. Это уравнение определяет динамику процесса, т. е. отсутствие равновесия. Если реакция закончится полностью, то наступило бы классическое равновесие одного вещества z. В случае прекращения реакции, по какой-либо из причин на одной из стадий, классическое равновесие состава обозначалось бы суммой, включающей три вещества: х + у + z.
В химически активных газах реакции диссоциации не прекращаются, а всегда протекают одновременно как в прямом, так и в обратном направлениях с образованием конечных продуктов и одновременным распадом их на составные части, т. е. х + у z. Если в камере сгорания ЖРД только одна реакция диссоциации
 (1)
(1)
где а, b, с, d — коэффициенты, определяющие число молей реагирующих веществ, то по закону действующих масс скорости прямой vn и обратной vo6 реакций выразятся формулами:
uп
=
kn
![]() ;
uоб
= koб
;
uоб
= koб![]() .
(2)
.
(2)
Здесь Сх, Су, Cz, Cw - концентрации веществ, выраженные в молях на единицу объема; kn, koб — коэффициенты скорости прямой и обратной реакций.
Под скоростью реакции понимается изменение концентрации реагирующих веществ во времени:
u = dCi/d. (3)
В связи с принятыми допущениями о химическом равновесии состав газов при достижении динамического равновесия не зависит от путей реакций, по которым устанавливается это равновесие. Поэтому для расчетов равновесного состава газов можно использовать такие цепочки реакций и записывать уравнения диссоциации в такой форме, которые наиболее удобны для расчетов.
Рассмотрим пример определения состава (ПС) при сгорании молекулярного газообразного водорода Н2 в кислороде О2 при динамическом химическом равновесии.
В продуктах сгорания могут быть Н2О, ОН, Н2, О2, Н и О. Молекулы Н2О, ОН--, Н2 и О2 сложны и могут диссоциировать на более простые молекулы и атомы.
Для расчетов часто используют следующие цепочки реакций:
Н2О
Н2
+
![]() О2;
Н2О
ОН--
+
Н2;
Н22Но;
О22Оо.
О2;
Н2О
ОН--
+
Н2;
Н22Но;
О22Оо.
Возможна также запись реакций диссоциации каждой сложной молекулы до получения атомов:
Н2О 2Н+ + О-2; ОН-- Н+ + О-2; H22H+ ; О220о.
С точки зрения принципов определения химического равновесия обе системы уравнений диссоциации равноправны. Поэтому в дальнейшем условимся использовать запись реакций диссоциации сложных молекул на атомы. Такая форма записи проще и удобнее.
В общем виде реакция диссоциации i сложной молекулы газа на атомы запишется так:
Aai Вbi Сci ai A + biВ + ciС, (4)
или при равновесии
Aai Вbi Сci - ai A - biВ - ciС = 0, (5)
где Aai Вbi Сci — диссоциирующая насыщенная i-я молекула; А, В, С — атомы, на которые диссоциирует молекула; ai, bi, ci – коэффициенты уравнения, показывающие число атомов, получающихся при диссоциации.
При написании этого уравнения предполагается, что ПС — гомогенная газовая смесь. При наличии конденсированных фаз эти уравнения записывают так же, но с указанием конденсированной фазы с соответствующим индексом хж, хТВ, который означает, что отмеченное вещество в рассчитываемых условиях (при заданной температуре) находится в жидком или твердом состоянии, например
В2О3Ж - 2ВТВ – 3О = 0; СО2 + Ств — 2СО = 0.
Если какое-либо вещество при данной температуре может существовать в конденсированной фазе, то необходимо убедиться в том, будет ли оно действительно присутствовать в ПС в такой фазе при ощутимых концентрациях, которые необходимо учитывать в расчете. Об этом можно судить по величине константы химического равновесия рассматриваемой реакции, в которую входит конденсированная фаза.
Применение некоторых топлив в двигательных установках ЖРД может привести к тому, что в ПС наряду с преобладающими газообразными веществами появляются жидкие или твердые компоненты, такие как В2О3Ж; А12О3ТВ и др., имеющие относительно высокие температуры плавления и кипения.
При некоторых условиях сжигания углеводородных топлив может появиться твердый углерод .
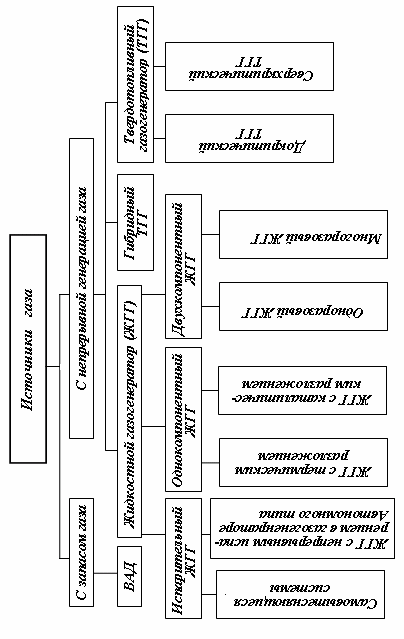
Рис. 1. Классификация источников газа
При расчетах состава химически реагирующих газовых смесей в ЖРД (рис. 1) используются различные способы определения концентрации компонентов:
1. По числу молей Ni каждого I - го компонента в объеме смеси. Для идеальных газов Ni =i[V/R T];
Ni pi = N1p1 = N2/p2 = • • • = N/p .
2. По парциальным давлениям pi компонентов газовой смеси.
3. По молекулярной концентрации Сi, определяющей содержание числа молей i - гo компонента в единице объема смеси:
Ci = Ni/V = pi/(R T).
4. По объемной (молярной) концентрации ri определяющей без размерное отношение числа молей i-гo компонента к числу молей всей смеси N. Для идеальных газов ri = Ni/N = Vi V = pi /p.
При использовании констант химического равновесия необходимо правильно применять их в соответствии с принятым способом задания концентрации компонентов реагирующих газов.
Учитывая уравнения равновесия при диссоциации сложных молекул до атомов по формуле (5), константа равновесия, выраженная через концентрацию сложной молекулы по уравнению
KCi
=
Ci
/![]() .
(6)
.
(6)
При определении равновесного состава справедливы и другие выражения констант равновесия, учитывающие перечисленные выше способы определения концентрации реагирующих компонентов: по парциальному давлению
KPi
=
pi
/![]() ;
(7)
;
(7)
по числу молей
КNi
=
Ni
/![]() ;
(8)
;
(8)
по объемной молярной концентрации
Кri
= ri
/![]() ;
(9)
;
(9)
В практике термохимических расчетов состава газов для ЖРД отдают предпочтение константе равновесия Kpi, выраженной через парциальные давления компонентов по уравнению (7), так как для газов, подчиняющихся уравнению состояния pV = RT, величина этой константы не зависит от давления, а определяется типом реакции и температурой газа рис. 2. Поэтому будем применять только эту константу химического равновесия и условимся записывать ее без индекса:
К
= Кр
= pi
/![]() ....
(10)
....
(10)
Если при расчетах необходимо использовать константы Кс, КN или Кr то пользуются выражениями:
Кс(R T) = К; (11)
КN=К(N/p ) . (12)
где Кr p = К; - изменение числа молей. В соответствии с (5)
=(l - a – b - ….. (13)
Необходимо отметить, что исследования рабочего процесса в камере позволили снизить потери удельного импульса из-за несовершенствова процессов, протекающих в камере сгорания и сопле.

Рис. 2. Зависимость плотности и давления насыщенных паров жидкого кислорода от температуры
Практика показывает, что без достаточных знаний рабочего процесса в камере трудно с успехом использовать энергетические возможности современных все более мощных топлив. Большое внимание уделяется проблеме устойчивости горения топлив в камере ЖРД: разрабатываются новые теории, учитывающие многие факторы гидродинамической и химической природы, применяются новые методы испытаний натуральных двигателей с целью экспериментального определения их характеристик.
Воронежский государственный технический университет
УДК 541. 183
В.П. Горшунова, А.В. Рыльков, Е.А. Круцких
ПОЛУЧЕНИЕ ХЕМОСОРБЕНТОВ АММИАКА
НА ОСНОВЕ АКТИВНЫХ УГЛЕЙ АГ-3 И БАУ-А
Исследованы способы получения хемосорбентов аммиака на основе углей АГ-3 и БАУ-А и предложен наиболее эффективный вариант обработки сорбентов активирующим раствором
Аммиак используется в химической промышленности при производстве минеральных удобрений и азотной кислоты. Кроме того, он применяется в качестве хладагента в аммиачных холодильных установках (АХУ) на предприятиях пищевой промышленности, на которых возможны утечки газа в результате разгерметизации отдельных систем и блоков установки, что является опасным как для персонала, работающего на предприятии, так и для населения близлежащих районов. Наличие стационарных вытяжных вентиляционных систем на некоторых предприятиях приводит к очистке помещений рабочей зоны. Однако эти выбросы необходимо улавливать, чтобы они не попадали в жилую зону. Это можно осуществить с помощью подходящих адсорбентов, находящихся в специальных контейнерах и помещенных в систему газоотвода.
Нами ставилась задача изучить поглотительную способность наиболее доступного сорбента - активного угля – по отношению к аммиаку. Мы использовали угли марок АГ-3 и БАУ-А, которые перед исследованиями обрабатывали «острым паром» в течение 1 часа. Активация водяным паром представляет собой окисление карбонизованных продуктов до газообразных в соответствии с реакцией С + Н2О = СО + Н2 или при избытке водяного пара С + 2Н2О = СО2 + 2Н2. В процессе активации развивается необходимая пористость и удельная поверхность. Происходит значительное уменьшение массы твердого вещества, именуемое обгаром.
Далее угли насыщали активирующим раствором, в качестве которого использовали 0,1 М раствор CuSO4 , при этом обработку вели тремя различными способами:
обработка в ультразвуковом поле;
обработка на вибраторе;
обработка при периодическом перемешивании в течение 24 часов.
В ходе исследований использовали ультразвуковую установку ULTRASONIC CLEANER (WAH LUEN ELTRTRONIC TOOLS. CO. LTD)., вибратор марки ZAKEADY APARATURY PRECYZYJNO MEDYCZNEJ. Высушивание сорбентов до постоянной массы производили в сушильном шкафу марки ШC - 80 СПУ. Использовали разный объем 0,1 М раствора CuSO4 – 25 мл и 50 мл. В ультразвуковой установке выдерживали сорбенты в течение 100 и 300 с, встряхивание на вибраторе производили 20 и 40 мин.
Обработанные в различных условиях сорбенты испытывали на поглотительную способность (адсорбцию) по отношению к аммиаку. Для этого в бюксах взвешивали по 1 г каждого сорбента и помещали в эксикатор, в котором создавали атмосферу аммиака с концентрацией 100 мг/м3 (5 ПДК). В этих условиях хемосорбенты выдерживали 24 часа при комнатой температуре.
Результаты опытов представлены на рис.1,2,3,4.
Проанализировав все способы получения хемосорбентов, установили, что самым эффективным способом является выдерживание изучаемых сорбентов – активных углей марок АГ-3 и БАУ-А - в 0,1 М растворе CuSO4 в течение 24 часов при периодическом перемешивании, при этом расход раствора составляет 50 мл на 5 г сорбента

Рис.1 . Зависимость адсорбции сорбентов от способа их химической обработки: 1 – уголь АГ-3; 2 – уголь БАУ-А
Все эти особенности сорбентов, выявленные при импрегнировании 0,1 М раствором медного купороса, обусловлены различием адсорбционно-структурных характеристик. Нами определены наиболее важные характеристики сорбентов по методикам, приведенным в [1], которые представлены в таблице.

Рис. 2. Адсорбция в зависимости от объема активирующего раствора: левый столбец – 25 мл, правый - 50 мл (1 –АГ-3; 2 – БАУ-А)

Рис.3. Влияние времени обработки сорбентов в ультразвуковом поле на поглотительные свойства: левый столбец – 100 с, правый столбец – 300 с (1 – уголь АГ-3; 2 – уголь БАУ-А)
Рис. 4. Влияние времени обработки сорбентов на вибраторе на поглотительные свойства: левый столбец – 20 мин, правый столбец – 40 мин. (1 – уголь АГ-3; 2 – уголь БАУ-А)
Адсорбционно-структурные характеристики активных углей
Характеристика сорбентов |
Активный уголь АГ-3 |
Активный уголь БАУ-А |
Истинная плотность d, кг/м3 |
1728 |
1476,8 |
Кажущаяся плотность ρ, кг/м3 |
1245 |
1158 |
Насыпная плотность, кг/м3 |
630 |
270 |
Удельная поверхность Sуд, м2/г |
532 |
602,6 |
Пористость Р, % |
27,95 |
21,6 |
Суммарный объем пор VΣ, см3/г |
0,26 |
0,3 |
Средний диаметр пор D, нм |
2,8 |
2,4 |
Механизм поглощения аммиака хемосорбентами на основе активных углей состоит в следующем. У активных углей химическое взаимодействие с аммиаком обусловлено лишь образованием донорно-акцепторной связи с катионами меди, находящимися в порах по реакции:
[Cu(H2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ + 4H2O. (1)
Комплексные катионы на основе Cu2+ - аква- и амминокомплексы - имеют пространственную форму квадрата.
Размеры сторон квадрата ~ 0,4 нм, а диагонали ~ 0,6 нм. Очевидно, что комплексные ионы легче проходят в крупные поры, чем в мелкие.
Как видно из таблицы, пористость и суммарный объем пор у углей АГ-3 и БАУ-А невелик, что, возможно, способствует меньшему насыщению активирующим раствором. Удельная поверхность углей и средний диаметр пор АГ-3 и БАУ-А также невелики. У активных углей на поверхности действуют лишь силы Ван-дер-Ваальса. Все это и объясняет результаты по влиянию различных способов получения хемосорбентов на основе активных углей.
Литература
1 . Кельцев Н.В. Основы адсорбционной техники [Текст]: монография / Н.В. Кельцев. – М.: Химия, 1981. – 592 с.
Воронежский государственный технический университет
