
- •Введение
- •Методика исследования
- •Результаты и их обсуждение
- •Заключение
- •От источников тепловых излучений
- •Для серых тел формула (2) имеет вид
- •Кристаллическая структура
- •1. «Жидкий мешок» помогает бороться с терроризмом.
- •2. Применение в медицине
- •3. Жидкий бронежилет
- •4. Применение в спорте
- •5. Применение в косметологии
- •6. Применение в транспорте
- •З аключение
- •Содержание
- •394026 Воронеж, Московский просп., 14
Заключение
Исследовано влияния природы углеродного наноструктурного материала (нанопористый активный уголь, многослойные и однослойные углеродные нанотрубки) на удельную емкость и эквивалентное последовательное сопротивление электрохимического суперконденсатора. Установлено, что удельная электрическая емкость электрохимического суперконденсатора зависит от природы наноструктурного углеродного материала электрода и достигает максимальных значений более 80 Ф/г при использовании однослойных УНТ. ЭПС суперконденсатора зависит от природы используемого наноструктурного углеродного материала менее существенно. При этом минимальное сопротивление достигается также у электродов на основе однослойных УНТ. Увеличение удельной электрической емкости и понижение ЭПС суперконденсаторов с электродами на основе однослойных УНТ в сравнении с электродами на основе активных углей и многослойных УНТ можно объяснить большей регулярностью пористой структуры углеродных композитов на основе однослойных нанотрубок и бездефектностью структуры УНТ, графеновая плоскость которых отличается практически идеальным структурным совершенством.
Литература
1. Беляков А. И. Электрохимические суперконденсаторы: текущее состояние и проблемы развития. // Электрохимическая энергетика. 2006. Т.6. № 3. С. 146-149.
2. Conway B. Electrochemical Supercapacitors: Scientific Fundamentals and Technological Applications. Kluwer–Plenum. New York. 1999.
3. Небольсин В.А., Воробьев А.Ю. Роль поверхностной энергии при росте углеродных нанотрубок в процессе каталитического пиролиза ацетилена // Неорганические материалы. 2011. Т.47. №2. С. 168-172.
4. Вольфкович Ю.М., Рычагов А.Ю., Сосенкин В.Е., Крестинин А.В. Силовой электрохимический суперконденсатор на основе углеродных нанотрубок // Электрохимическая энергетика. 2008. Т.8. №2. С. 106-110.
5. Орлов И. Н. Электротехнический справочник. В 3-х т. Т.2. Электротехнические изделия и устройства / Под общ. ред. И. Н. Орлова и др. 7 изд. 6 испр. и доп. М.: Энергоатомиздат. 1986. 712 с.
6. Burke A.F. Supercapacitors and advanced batteries: what is the future of supercapacitors as battery technology continues to advance? // Proc. Advanced capacitor world summit. USA. San Diego. 2009.
ОАО “Воронежское специальное конструкторское бюро «Рикон»”
УДК 542.4
О.Н. Болдырева, А.О. Меринова, Е.В. Оводенко
ТЕХНИЧЕСКИЕ МЕТОДЫ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ СИСТЕМ ГАЗООЧИСТКИ ПРИ ЭЛЕКТРОЛИЗЕ АЛЮМИНИЯ
Совершенствование технологии электролиза и сопряженных с ним переделов неизбежно приводит к изменению количества и состава образующихся фторсодержащих отходов, что требует разработки новых методов для улучшения экологии алюминиевого производства в современных условиях
Поскольку современные экологические критерии требуют резкого сокращения количества всех отходов отделений производства фтористых солей, поступающих на шламовое поле, наиболее актуальной проблемой становится разработка способов их утилизации, органично вписывающихся в существующие технологические схемы. Использование электролитов с пониженным криолитовым отношением (КО=2,2÷2,5) дает возможность на 2-3% повысить выход алюминия на действующих сериях электролиза. Корректировка данных электролитов с помощью регенерационного криолита с низким криолитовым отношением (КО=1,7÷2,2) позволяет эффективно решать следующие задачи:
поддерживать криолитовое отношение электролитов на требуемом уровне;
оптимизировать баланс фтора, сократив удельное потребление фторида алюминия с 30-35 до 20-25 кг/т Al, а выбросы фторсодержащих соединений – на 35-40 %.
Выпуск низкомодульного криолита с КО=1,7 (далее- хиолит- Na5Al3F14) предлагается организовать в существующих отделениях регенерации путем внедрения так называемой кислой схемы, основанной на конверсии фторидно- сульфатных газоочистных растворов в кислотные растворы, содержащие фторалюминиевую кислоту H2AlF5. Принципиальная технологическая схема ионообменной регенерации представлена на рис. 1.
Предлагаемый вариант переработки растворов газоочистки может быть успешно освоен, поскольку опыт эксплуатации ионообменных установок хорошо известен предприятиями алюминиевой промышленности и в составе многих из них имеются котельные, оборудованные соответствующими отделениями водоподготовки.
Преимуществом указанной технологии является низкий расход реагентов, в первую очередь соды (сокращение на 30%). Из технологического процесса выводится избыточная серная кислота, которую можно концентрировать и перерабатывать в ценный продукт - сульфат алюминия Al2(SO4)3·18H2O. Данный вариант «кислой» схемы представляет собой замкнутый, безотходный цикл, который может быть реализован в условиях традиционного содового орошения без закисления растворов газоочистки. Увеличение количества сульфатов, поступающих в системы газоочистки, связанное с введением в эксплуатацию электролизеров с ОА, может интенсифицировать зарастание газоочистных аппаратов и растворопроводов. В целях их выведения из технологического цикла растворы газоочистки сбрасываются на шламовое поле. В зимний период избыток сульфатов осаждается вместе со шламом на дно шламоотстойника в виде мирабилита – Na2SO4·10H2O и двойной соли - Na2SO4·NaF. Более эффективным представляется метод, когда сульфатносодовые растворы газоочистки, содержащие Na2SO4, NaHCO3, Na2CO3, насыщаются до предельных концентраций (Na2Oобщ – 270-320 г/л) и перерабатываются на товарные продукты в локальном технологическом цикле.
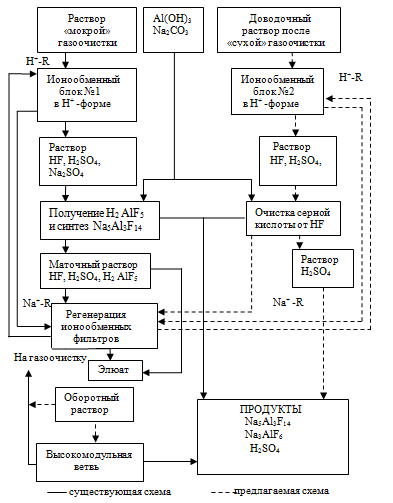
Рис. 1. Принципиальная технологическая схема ионообменной регенерации фтора и вывода сульфатов в условиях применения «мокрой» и «сухой» газоочистки
Поскольку благоприятные технологические условия для вывода сульфатов достигаются при использовании газоочистных растворов с содержанием фторидов менее 3-5 г/л, наиболее эффективным способом очистки газов применительно к сериям электролиза с ОА является следующий. Согласно данному способу осадок двойной соли 2Na2SO4· Na2CO3 (беркеит) с примесью NaF, выделенный в результате концентрирования и корректировки газоочистных растворов по методу переработки нефелинового сырья, растворяется и подвергается H+ - катионированию в ионообменных фильтрах, где происходит отделение серной кислоты.
Все отходы регенерации ионообменных фильтров, а также очистки растворов серной кислоты в виде осадка хиолита Na5Al3F14 используются при получении регенерационного криолита.
Практика показывает, что в условиях современной модернизации алюминиевого производства необходима корректировка технологической схемы, обеспечивающая сокращение и переработку образующихся отходов. Растворы газоочистки целесообразно перерабатывать на низкомодульный криолит (хиолит) с применением ионообменных фильтров с одновременным выводом сульфатов в виде раствора серной кислоты и продуктов ее переработки (сульфата алюминия). Данные технические предложения позволяют значительно повысить эффективность систем газоочистки и отделений производства фтористых солей в электролизе алюминия.
Традиционная технология предусматривает размещение участка анодирования в цехе со стандартной системой отвода сточных вод: общий коллектор кислотно-щелочных стоков, а при наличии ванн с хроматными и/или цианидными растворами – соответствующие индивидуальные коллекторы. Ввиду этого ионы алюминия могут поступать из соответствующих промывных ванн во все имеющиеся потоки, смешиваясь с промывными водами от других процессов. Отработанные технологические растворы, содержащие ионы алюминия (растворы осветления, пассивации, снятия алюминиевых покрытий с подвесок и бракованных деталей), нельзя сливать в общий сток без предварительного удаления из них ионов алюминия. Таким образом, для нормальной эксплуатации участка анодирования необходимо выполнить следующие условия:
Обеспечить такое снижение скорости поступления ионов алюминия от участка в общий сток, чтобы после соединения с другими стоками их концентрация была ниже ПДК.
Ликвидировать периодический сброс на очистные сооружения технологических растворов, а в тех случаях, когда это невозможно- предварительно удалять из них ионы алюминия.
Сдаваемые в специализированные организации или вывозимые на полигоны гальваношламы не должны содержать соединений алюминия.
Решить первую задачу предлагалось путем создания системы замкнутого водооборота на участке анодирования с помощью ионообменных установок. Однако при их эксплуатации неизбежно образование значительных количеств концентрированных жидких отходов (элюатов), содержащих ионы алюминия. Многоступенчатая каскадная промывка в сочетании с выпарным оборудованием позволяет решить эту задачу практически без образования каких-либо отходов, но потребует значительных затрат и дополнительных площадей. Ниже приводится их комплексное решение, которое основано на использовании процессов мембранного электролиза. Оно позволяет решить все три задачи практически без привлечения дополнительных площадей и с затратами, в десятки-сотни раз меньшими, чем стоимость оснащения участка альтернативными системами, очищающими промывные воды.
Примерная схема участка анодирования, включающая процессы мембранного электролиза, изображена на рис. 2.
Приведенная схема является лишь примерной и, в зависимости от конкретных условий, может существенно изменяться.
Схема на рис. 2 предусматривает работу ПЭМ в 7,9,10,13 ваннах. Во всех случаях выполняемая им основная задача- это удаление ионов алюминия из технологического раствора или промывной воды. Удаляемые ионы разряжаются на катоде с образованием порошкообразного осадка металла, который периодически снимается с поверхности катода. Наряду с этим, использование ПЭМ позволяет регулировать состав раствора или промывной воды по другим компонентам и, в ряде случаев, также выполняет функции преграды для определенных видов ионов, устраняя их доступ к определенному электроду.
Регенерация с помощью погружных модулей технологических растворов, имеющих ограниченный срок службы, позволяет устранить необходимость их периодического сброса.
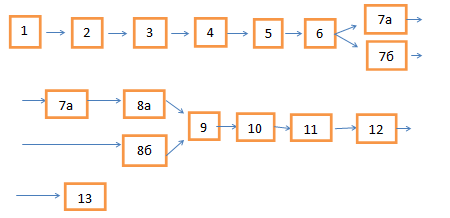
Рис. 2. Схема процесса электролиза: 1- монтаж деталей на подвески (загрузки в барабаны/колокола); 2 - обезжиривание; 3 -промывка (2-3 ступени);4 - травление/активация; 5 – промывка (1-2 ступени); 6 - анодирование; 7а и 7б- ванны улавливания с погружным электрохимическим модулем (ПЭМ); 8а и 8б- промывка (1-2 ступени); 9- ванна пассивации +ПЭМ; 10- ванна улавливания +ПЭМ; 11- промывка (1-2 ступени); 12-демонтаж; 13-промывка в ванне улавливания + ПЭМ
Реальным решением проблемы очистки больших объемов воды стали установки на основе интегральных технологических систем (ИТС) очистки и оздоровления водной среды. ИТС- это организационно оформленная интегрированная компьютеризованная модульная система, обеспечивающая организацию замкнутого цикла оборота технологических жидкостей или вод. ИТС с успехом может быть использована для очистки и переработки любых видов стоков.
ИТС очистки воды структурно состоят из следующих основных агрегатов:
1) унифицированного модуля (емкости) с транспортными средствами для удаления отходов со дна и отвода отделяемых при очистке отходов;
2) транспортного модуля, обеспечивающего контакт очистного инструмента с очищаемой средой (водой);
3) специального унифицированного инструмента для реализации физических, физико-химических или химических процессов очистки (в форме кассет из очистных патронов).
Литература
1. Калиберда И.В. Оценки параметров внешних воздействий природного и техногенного происхождения. – М.: Логос, 2002.- 544 с.
2. Фомин Г.С. Справочник. Контроль качества и экологической безопасности по международным стандартам. М.: Феникс, 2001. 301 с.
3. Ксизенко В.И. Общая химическая технология и основы промышленной экологии. М.: Колос, 2003.-364 с.
Воронежский государственный технический университет
УДК 658.382.3:621.565.004.67
В.П. Горшунова, А.В. Рыльков, Е.А. Круцких
О БЕЗОПАСНОСТИ АММИАЧНЫХ ХОЛОДИЛЬНЫХ УСТАНОВОК
Проанализировано влияние различных факторов на безопасную эксплуатацию холодильных установок с использованием аммиака в качестве хладагента
Впервые аммиак был использован в компрессионной установке Дэвидом Бойлем в 1872 г. Он построил компрессионную холодильную машину для пивоваренного завода в Триесте. С тех пор аммиак благодаря уникальным термодинамическим свойствам, а также тому, что установки с его использованием оказались эффективными и рентабельными, является наиболее распространенным хладагентом в системах промышленного назначения.
В России аммиачные холодильные установки являются основным источником хладоснабжения для различного типа производственных комплексов, в том числе предприятий в перерабатывающей промышленности и сельском хозяйстве. Вопросам безопасности аммиачных установок и изменениям в концепции такой безопасности традиционно уделялось большое внимание. Были разработаны «Мероприятия по повышению безопасности аммиачных холодильных установок» (1979 г.) и «Методические указания по контролю за соблюдением правил техники безопасности на холодильных установках (1984 г., 1991 г.). Анализ показывает, что число холодопотребляющих предприятий в перерабатывающей промышленности и в сельском хозяйстве России весьма значительно, а используемые системы хладообеспечения разнообразны как по особенностям устройства так и по производительности, аммиакоемкости, примененному оборудованию. В последнее время в связи с ростом числа новых предприятий, производящих, среди прочего, мороженое, пиво, напитки, колбасные изделия и т.д., потребность в холодильных установках резко возросла. На этих предприятиях преимущественно используются аммиачные холодильные системы.
Используются как централизованные аммиачные системы, обслуживающие большое число потребителей, так и децентрализованные, где каждый потребитель обслуживается индивидуальной (автономной) установкой. В холодильных системах используются различные типы аммиачного оборудования. Используются циркуляционные ресиверы низкого давления емкостью от 1,5 до 5 м3, линейные ресиверы высокого давления и дренажные ресиверы той же емкости.
Количество аммиака в системах может быть от 500 кг на предприятиях с децентрализованными установками и промежуточными хладоносителями до 100-150 тонн на больших мясокомбинатах, использующих насосные централизованные системы с непосредственным кипением аммиака в батареях и воздухоохладителях.
Поскольку аммиак является высокотоксичным и потенциально взрывоопасным веществом, то в настоящее время уделяют большое внимание вопросам безопасности холодильных установок, работающих на этом хладагенте. На предприятия, эксплуатирующие аммиачные холодильные установки, распространяются требования Федерального закона о промышленной безопасности опасных производственных объектов. Предприятия, использующие холодильные установки с большой зарядкой аммиака, и в других случаях, предписанных Госгортехнадзором России, обязаны заполнять Декларацию безопасности. Декларация является документом, в котором отражается характер и масштабы опасностей на промышленном объекте, возможные сценарии возникновения и развития чрезвычайных ситуаций, оценка риска и вырабатываются мероприятия по обеспечению безопасности, предупреждению возможных чрезвычайных ситуаций и обеспечению готовности к действиям при их возникновении.
С 1995 года все холодильные установки, содержащие более 1 тонны аммиака, взяты под надзор государственной службой (Госгортехнадзор России). Согласно новым требованиям все предприятия должны получить разрешение Госгортехнадзора России на право эксплуатации аммиачной холодильной установки. С этой целью разработаны специальные методы для оценки безопасности установок. Проверяется состояние всей установки и ее отдельных узлов в отношении того, отвечает ли установка требованиям российских Правил, а также имеются ли соответствующие способы для автоматической защиты от аварий. Проводятся инспекционные проверки работающего оборудования, эксперты составляют заключения о новых проектах. При анализе безопасности аммиачных холодильных установок ориентируются на требования, приведенные в нормативных документах [1-5].
В ряде случаев оборудование аммиачных холодильных установок подвергается диагностированию технического состояния. Такие случаи наступают, в частности, когда вырабатывается установленный расчетный срок службы, имели место в эксплуатации нарушения регламентированного режима или воздействие факторов, превышающих расчетные (давления, температуры, внешних силовых нагрузок и др.)
При страховании предприятия предварительно выполняется анализ риска, связанного, в частности, с возможностью токсического поражения аммиаком жителей близлежащих районов при нарушении герметичности аммиачного оборудования. Определяются поля концентраций паров аммиака в воздухе на различных расстояниях от места возможной аварии, а также площадь зоны заражения аммиаком. При выполнении расчетов используются специальные методики [4-6]. Они предусматривают возможность разделения установки на отдельные технологические блоки с помощью отсечных клапанов. Определяется масса аммиака, находящегося в условно аварийном блоке и поступающего в него из смежных блоков за время с момента возникновения аварии и до момента отсечения аварийного блока, а также масса аммиака, испарившегося за счет контакта пролитой жидкости и окружающей среды.
Оценка степени взрывоопасности аммиачных технологических блоков проводится на основе их категорирования, по расчетным значениям относительного энергетического потенциала QВ и общей приведенной массы паров аммиака «m». Показатели категорий приведены в нижеследующей таблице.
Показатели категорий взрывоопасности в зависимости от общей приведенной массы паров аммиака
Категория взрывоопасности |
QB |
m, кг |
I |
> 37 |
> 5000 |
II |
27-37 |
2000-5000 |
III |
< 27 |
< 2000 |
IV |
≤ 10 |
|
Относительный энергетический потенциал взрывоопасности технологического блока находится по формуле:
![]() .
.
Общая масса горючих паров аммиака, приведенная к единой удельной энергии сгорания, равной 46000 кДж/кг:
![]() кг
кг
В этих формулах фигурирует Е - общий энергетический потенциал взрывоопасности технологического блока холодильных установок, определяемый суммой энергий адиабатического расширения парогазовой фазы аммиака и полного сгорания имеющихся и образующихся из жидкой фазы паров аммиака за счет внутренней и внешней (окружающей среды) энергии при аварийной разгерметизации блока.
Расчетное значение Е определяется суммированием составляющих:
- энергии адиабатического расширения и сгорания паров аммиака, находящихся непосредственно в аварийном блоке;
- энергии сгорания парогазовой фазы, образующейся за счет энергии перегрева жидкой фазы рассматриваемого блока и поступившей жидкой фазы от смежных блоков за время от начала аварийной разгерметизации блока до полного отключения отсечной арматурой аварийного блока;
- энергии сгорания парогазовой фазы, поступившей к разгерметизированному блоку от смежных блоков;
- энергии сгорания парогазовой фазы, образующейся из пролитой на твердую поверхность жидкой фазы, за счет теплоотдачи от окружающей среды (от воздуха к зеркалу жидкости и от твердой поверхности - к жидкости).
Оптимизация технологических блоков по QB приводит к выбору средств отключения этих блоков при их аварийной разгерметизации: ручные (QB≤ 10); дистанционные (10 < QB < 37); автоматические (QB > 27).
Результаты расчетов и анализа подтверждают, что необходимо иметь быстродействующие отсечные клапаны для аммиачных трубопроводов, закрывающиеся автоматически (по сигналу датчика, фиксирующего превышение порогового значения концентрации паров аммиака в воздухе) или дистанционно (от обслуживающего персонала холодильных установок).
Необходимы новые сигнализаторы концентрации паров аммиака повышенной надёжности, длительной непрерывной работы и не требующие больших финансовых и трудозатрат при их эксплуатации.
Централизованные аммиачные системы непосредственного охлаждения (где несколько компрессоров работают на общие конденсаторы), выгодные с позиций экономии электроэнергии на выработку холода, оказываются уязвимыми с позиций техники безопасности. Для крупных предприятий более безопасны и предпочтительны несколько децентрализованных таких установок с пониженной зарядкой аммиака в каждой из них.
В условиях использования холодильных установок непосредственным охлаждением потребителей холода хладагентом задачи снижения суммарной аммиакоемкости решаются, в частности, следующими путями:
- вместо единой системы хладообеспечения массива потребителей холода (технологических аппаратов, камер) применение раздельных (децентрализованных) холодильных установок на группы или даже единицы холодопотребляющих объектов;
- снижение тепловых нагрузок от потребителей холода за счет оптимизации изоляционных конструкций, проводимых технологических процессов и других факторов.
- максимальное применение в помещениях вентиляционных устройств охлаждения (воздухоохладителей), имеющих значительно меньшее количество хладагента на единицу отводимой теплоты по сравнению с батареями. Кроме того, это существенно снижает геометрический объем циркуляционных и линейных ресиверов, при расчете которых используется геометрический объем охлаждающих устройств камер и технологических аппаратов.
Несмотря на все принимаемые меры по недопущению утечек аммиака (жидкого, газообразного), аварийную разгерметизацию холодильных систем нельзя полностью исключить. Поэтому для уменьшения масштабов аварий и их последствий большое значение имеет как можно более раннее обнаружение повреждения. Признаками аварии могут быть:
- появление сильного запаха аммиака без наличия явно видимого облака его паров;
- появление явно видимого белого облака паров аммиака;
- звук срабатывания предохранительных клапанов;
- звук механического разрушения (повреждения);
- срабатывание системы обнаружения и оповещения об утечке аммиака;
- падение давления, снижение температуры аммиака из-за его вскипания, падение уровня жидкости.
Основное количество аммиака попадает в воздух при испарении пролитой жидкости. Для больших предприятий, где эксплуатируются централизованные холодильные установки с сосудами большой емкости, в случае их разгерметизации масса пролитого аммиака может быть весьма значительной.
Необходимы средства, которые обеспечат химическое связывание аммиака, предотвращение его испарения и, вместе с тем, не создадут серьезных проблем в дальнейшем по утилизации образовавшейся смеси. Нужны средства и для нейтрализации парогазовых утечек аммиака. Конкретные меры и технические средства для локализации и ликвидации аварийных ситуаций должны определяться с учетом проектных характеристик холодильной установки. Система мероприятий включает также обязательное выполнение организационных мер (оснащение компрессорного цеха средствами индивидуальной защиты, обучение персонала и др.).
Выбор средств связан с производительностью и аммиакоемкостью холодильных установок (общей и единичной по оборудованию), местами размещения элементов и холодильных установок в целом, технологическими схемами и т.д.
Опыт говорит о том, что для отдельных холодильных установок (небольших, с хладоносителем, расположенным относительно вдалеке от других объектов, не представляющих достаточно серьезной опасности для окружающих людей и т.д.) может быть достаточным наличие стационарных вытяжных вентиляционных систем (в помещениях), поддонов и приямков под ресиверами.
На предприятиях, имеющих аммиачные холодильные установки, в результате аварийных ситуаций возможно появление газообразного аммиака или его смесей с воздухом в помещениях, где нет вытяжной вентиляции или она недостаточна. К этим помещениям можно, в частности, отнести:
- холодильные камеры;
- производственные цеха с потреблением холода (вентиляция предусматривается, но не всегда рассчитана на аварийный выброс аммиака);
- коридоры;
- вестибюли.
Облака газообразного аммиака могут возникать вне зданий, в результате аварийных утечек хладагента из размещенного на наружных (уличных) площадках холодильного оборудования.
В перечисленных выше случаях, для скорейшего удаления газообразного аммиака из воздуха помещений и из опасных зон вне зданий (до нормативных пределов), целесообразно применение передвижных отсасывающих устройств.
Последнее издание «Правил» [2] учитывает и отдельные требования международных Правил к аммиачным холодильным установкам. Дальнейшее широкое использование аммиачных холодильных систем и обеспечение безопасности их эксплуатации должно учитывать особенности аммиака, в первую очередь его токсичность и потенциальную взрывоопасность, а также современный уровень развития и надежности применяемых технических устройств, средств автоматики, возможности использования малодозированных (по аммиаку) единиц оборудования и установок в целом, их назначения, месторасположения предприятия.
Литература
Правила устройства и безопасной эксплуатации сосудов, работающих под давлением (ПБ 03-576-03).
Правила безопасности аммиачных холодильных установок (ПБ 09-595-03)
Определение категорий помещений, зданий и наружных установок по взрывопожарной и пожарной опасности (НПБ 105-03).
Методика прогнозирования масштабов заражения сильнодействующими ядовитыми веществами при авариях (разрушениях) на химически опасных объектах и транспорте.- М., 1990. - 71 c.
Общие правила взрывобезопасности для взрывопожароопасных химических, нефтехимических и нефтеперерабатывающих производств (ПБ 09-540-03).
Кальм Д.М. Безопасность холодильных систем [Текст] /Д.М. Кальм // ASHRAE Journal.- 1994.- №7 .- С.17 – 26.
Воронежский государственный технический университет
УДК 621. 315.61
Д.Н. Бурдунюк, А.А. Киселев, И.М. Винокурова
Технологические мероприятия по планированию режимов электрохимической обработки металлов, склонных к пассивации
В материалах статьи приводятся данные по выбору числа и условий проведения опытов для полного решения задачи с требуемой точностью при анодной обработке металлов
Планирование эксперимента осуществлялось на основе анализа зависимостей основных кинетических параметров технологических процессов и их корреляции в условиях, определяемых реальными границами отклонений.
Для определения количественных характеристик физико-механических и физико-химических свойств материалов и их изменений в процессе электрохимического формообразования при планировании эксперимента осуществляется выбор числа и условий проведения опытов для полного решения задачи с требуемой точностью. Это необходимо для сокращения числа исследований до рационального минимума.
Алгоритм решения этой задачи в общем виде для типовых электрохимических процессов может быть представлен в виде следующей системы (рис. 1).

Рис. 1. Алгоритм решения задачи по планированию эксперимента
Как показывают результаты предварительных исследований, зависимость времени решения задачи существенно зависит от опыта экспериментатора. Анализ этих зависимостей позволяет установить, что они имеют довольно сложный характер (рис. 2).
Однако минимальное число допускаемых экспериментатором ошибок лежит в пределах числа опытов (5-9), т.е. соответствует определенному нами в предыдущем разделе числу экспериментов. Одной из главных задач при планировании эксперимента является определение основных параметров (параметров первого порядка), определяющих качество и кинетические характеристики технологических процессов. Для их определения необходимо
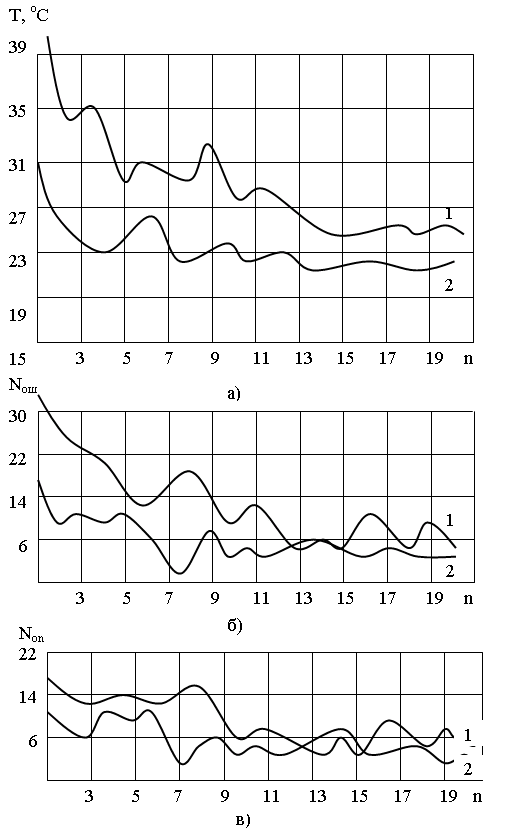
Рис. 2. Зависимость времени решения задачи (), количества ошибок
за один эксперимент (N от) и числа исследователей (Nис), допустивших
ошибки от проведённого числа (n) исследований: 1-начинающие
экспериментаторы; 2-опытные экспериментаторы
проведение экспериментальных исследований по аналогичным типовым процессам. Другой но менее значимой задачей является определение взаимосвязи и функциональных зависимостей между основными параметрами процесса и физико-химическими свойствами объектов исследований. При планированииэксперимента необходимо определится и с границами изменения параметров, чтобы исключить проведение опытов, результаты которых не могут быть использованы для разработки новых технологий. Исходя из вышесказанного и на основе анализа литературных источников, в качестве основных параметров были выбраны: плотность тока, химический состав электролита и скорость электрохимического процесса. Поскольку мы исходим из предположения, что алюминиевый электрод окисляется по механизму с отрицательным дифференц-эффектом (ОDЭ), то зависимость ток-скорость растворения металла носит довольно сложный характер, поэтому эти оба параметра являются главными и определение их корреляции зависит от целого ряда факторов. Для определения оптимальной температуры электролита мы исходим из предположения, что температура в зоне реакции является функционально зависимой от её среднего значения в объёме, а также других кинетических параметров процесса.
При определении параметров импульсного тока (частоты следования, их длительности и скважности) нижний предел частоты следования определяется из условий обеспечения стабильного состояния системы электрод-электролит, а верхний предел и длительность импульса должны обеспечивать возможность разряда потенциалопределяющей иона.
При выборе значения скважности импульсов основным условием являлось обеспечение возможности сохранения поверхности электрода в активном состоянии.
Для определения экстремальных точек на кривых зависимостей применялось их дифференцирование непосредственно в ходе эксперимента.
На характеристические параметры анодных поляризационных кривых титана большое влияние оказывает скорость поляризации. Добавление анионов того или иного сорта в водный бромид-хлоридный раствор приводит к смещению потенциалов растворения (конкурирующая адсорбция). Галоидные ионы, так же как и гидроксил-ион, не вступают в окислительно-восстановительные реакции с промежуточными низковалентными частицами, что и приводит к электрохимическому окислению ионов титана до высшей устойчивой степени окисления. В отличие от этого кислородосодержащие анионы могут восстанавливаться, химически взаимодействуя с промежуточными низковалентными частицами. Наблюдаемые экспериментальные различия эффективной валентности в водных растворах нитрат-, хлорат, и перхлорат-ионов связаны, по всей видимости, с изменением реакционной способности этих анионов в реакциях рассматриваемого типа.
Соотношение скоростей электрохимического и химического механизма определяет высокоскоростное анодное растворение окисление титановых сплавов промежуточными низковалентными частицами, а рабочая модель представляется следующим образом:
1) вблизи межфазной границы термодинамически возможно существование промежуточных комплексов с различными степенями окисления входящих в них металлических ионов. Чем выше степень окисления ионов, тем более удалена соответствующая зона от поверхности электрода. Комплексы с низшими степенями окисления адсорбированы на поверхности металла;
2) анионы различного рода, присутствующие в растворе, находятся на различном расстоянии от межфазной границы, зависящем от природы аниона. Что определяется в свою очередь сольватацией анионов в данном растворителе, специфической адсорбцией его на данном металле и поляризуемостью аниона. Эти факторы определяют энергетическое состояние аниона с точки зрения возможности химического взаимодействия с продуктами анодного растворения металла;
3) возможно химическое взаимодействие промежуточных низковалентных частиц с анионом раствора.
Рассмотренные механизмы растворения металла, позволяют качественно объяснить механизмы растворения и моделировать режимы обработки, состав электролита. Таким образом, изучение особенностей характеристик анодных кривых при анализе поведения титановых сплавов, создает необходимость учитывать и вносить поправку на ток возможного сопряженного электрохимического процесса для получения истинных значений токов растворения сплава.
Воронежский государственный технический университет
УДК 665.753
А.В. Белокопытов, И.И. Исаков, Б.А. Спиридонов
ОКИСЛИТЕЛИ РАКЕТНОГО ТОПЛИВА
Представлены сведения о жидких реактивных топливах, приведена их классификация. Показано, что эффективным окислителем является азотная кислота, а горючим – гидразин и диметилгидразин
Современная реактивная техника является чрезвычайно сложной и дорогой, поэтому важнейшим требованием, предъявляемым к ней – это высокая надежность, долговечность и безопасность при эксплуатации. В основном это зависит от качества ракетных топлив. Наиболее широкое применение получили жидкостные реактивные двигатели (ЖРД), которые создают рабочую тягу за счет вытекания струи продуктов сгорания жидкого реактивного топлива (ЖРТ) – окислителя и горючего, имеющихся на борту летательного аппарата [1].
ЖРТ по способу применения в двигателях подразделяют на однокомпонентные и двухкомпонентные. Однокомпонентные ракетные топлива по химическому составу делят на мономолекулярные и смесевые. К мономолекулярным относят вещества, в молекуле которых содержаться как горючие элементы, так и необходимый для горения кислород. Такими соединениями являются, например, сложные эфиры азотной кислоты и различных спиртов, тринитроглицерин C3H5(ONO2) метилнитрат CH3ONO2 и др. К однокомпонентным топливам относят и эндотермические соединения, выделяющие при своем распаде большое количество тепла и газообразных продуктов (например, гидразин N2H4, пероксид водорода H2O2 и др.).
Двухкомпонентные жидкие реактивные топлива, в которых каждый из компонентов подается в камеру сгорания раздельно, состоят из горючего и окислителя.
Ракетные окислители по химической природе делят на следующие: кислородные – жидкий кислород О2 и озон О3, пероксид водорода H2O2; азотные – концентрированная азотная кислота HNO3, оксиды азота, тетранитрометан; фторные – жидкий фтор и кислородные соединения фтора; хлорные – жидкий хлор, хлорная кислота и оксиды хлора.
Ракетные горючие по химическому составу подразделяют на следующие: водородные – жидкий водород; углеводородные; гидразинные – гидразин и его производные, например. диметилгидразин (CH3)2N- NH2; аминные – жидкий аммиак, амины; бороводородные – соединения типа боранов, например диборан B2H6 и др.
Наряду с жидким кислородом в качестве окислителя широкое применение получила азотная кислота, структура которой представлена на рисунке 1 [2]. Особенностью структуры HNO3 является образование четырех связей азота с тремя атомами кислорода и пятой дополнительной, которая равномерно и динамично распределена между двумя атомами кислорода и азота. Кроме этого, атомы водорода от одной молекулы кислоты отщепляются и прицепляются к соседним молекулам, образуя непрочные, но чрезвычайно химически активные агрегаты. Из-за этого в азотной кислоте обязательно образуются разного рода примеси.
В ракетной технике используют два типа азотнокислотных окислителей: белую и красную дымящие азотные кислоты. Первая представляет собой техническую азотную кислоту с концентрацией HNO3 не менее 97,4 %, а вторая – смесь азотной кислоты с четырехокисью азота. Введение в азотную кислоту четырехокиси азота (красная дымящая кислота) улучшает ее свойства как окислителя ракетного топлива, так как содержит несколько больше активного кислорода для окисления горючего [3].
А зотная
кислота легко взаимодействует с многими
конструкционными металлами, и особенно
с железом, медью и их сплавами. Образующиеся
в результате коррозии соли загрязняют
окислитель. Под действием HNO3
разрушаются
средства
ее хранения и транспортирования [4].
зотная
кислота легко взаимодействует с многими
конструкционными металлами, и особенно
с железом, медью и их сплавами. Образующиеся
в результате коррозии соли загрязняют
окислитель. Под действием HNO3
разрушаются
средства
ее хранения и транспортирования [4].
Рис. 1. Структура одиночной молекулы HNO3 (межатомные расстояния даны в рm)
Кроме того, азотная кислота не удовлетворяет требованиям совместимости с конструкционными материалами – под нее специально приходится подбирать металл для баков, труб, камер ЖРД. Даже самые стойкие сорта нержавеющей стали медленно разрушаются концентрированной азотной кислотой. Несмотря на коррозионную агрессивность и токсичность азотная кислота широко применяется в ракетной технике из-за низкой стоимости, доступности и способности самовоспламеняться со многими горючими.
Плотность ее заметно больше, чем у жидкого кислорода, но главное ее достоинство по сравнению с жидким кислородом состоит в том, что она не выкипает, не требует теплоизоляции, может неограниченно долго храниться в подходящей таре. Для уменьшения коррозионной активности азотной кислоты в нее добавляют фтористоводородную кислоту. Всего 0,5% фтористоводородной кислоты уменьшают скорость коррозии нержавеющей стали в десять раз. Для того, чтобы вещества, которые попадают в камеру сгорания ЖРД, сжигались, добавляют гиперголики. Гиперголическими веществами называются те, которые самовоспламеняются при контакте. Идеальный гиперголь для азотной кислоты – гидразин N2H4 (рис.2), который представляет собой бесцветную, дымящую на воздухе жидкость, сильно гигроскопичную и хорошо растворяющуюся в воде, спиртах, аминах. Для сгорания гидразина, протекающего с большим газовыделением, требуется сравнительно немного окислителя. Гидразин имеет относительно невысокую температуру горения, в результате чего потери тепла на диссоциацию продуктов его сгорания невелики. Высока реакционная способность гидразина при взаимодействии с окислителями, относительно высокая плотность – 1020 кг/м3, малая молекулярная масса продуктов сгорания и практически неограниченная сырьевая база выгодно отличают гидразин среди других соединений, используемых в качестве горючего для ЖРД.
Разложение гидразина происходит, как правило, с разрывом связи N – N и может протекать по следующим направлениям:
3N2H4 → 4NH3 + N2,
N2H4 → N2 + 2H2,
2 N2H4 → NH3 + N2 + H2.
Существенными недостатками гидразина, ограничивающими его широкое применение, являются высокая температура замерзания (2 0С), относительно низкая термическая стабильность и высокая токсичность.
Лучшими низкотемпературными свойствами обладают алкилпроизводные гидразина, например, несим-диметилгидразин НДМГ (рис.3).
НДМГ - бесцветная прозрачная жидкость с резким неприятным запахом, характерным для аминов. Температура кипения +63.1оС, кристаллизации -58оС. Хорошо смешивается с водой, нефтепродуктами, спиртами и многими органическими растворителями [5]. Легко самовоспламеняется с окислителями на основе азотной кислоты, что обеспечивает легкий запуск и стабильную работу двигателей в широком диапазоне изменения окружающих условий.

Рис. 2. Структура гидразина

Рис. 3. Несимметричный диметилгидразин
В настоящее время пара «азотная кислота — НДМГ» используется на ракетах-носителях «Протон», РН «Космос», РН «Циклон», РН «Днепр», РН «Титан»; в двигательных установках пилотируемых кораблей, орбитальных и межпланетных станций, а также в некоторых баллистических ракетах.
Литература
1. Братков А.А. Химмотология ракетных и реактивных топлив /А.А. Братков, Е.П. Серегин, А.Ф. Горенков; под. ред. А.А. Браткова. - М.: Химия, 1987. - 304 с.
2. Неорганическая химия: учеб. пособие для хим. и химико-технол. спец. вузов /Б.Д. Степин, А.А. Цветков.- М.: Высш. шк., 1994.- 608 с.
3. Алешков М.Н. Физические основы ракетного оружия /М.Н. Алешков, И.И. Жуков.- М.: Воениздат, 1965. – 464 с.
4. Зрелов В.Н., Серегин Е.П. Жидкие реактивные топлива /В.Н.Зрелов, Е.П.Серегин. - М.: Химия, 1975. - 320 с.
5.Ушакова В.Г. О. Н. Шпигун, О.И. Старыгин. Особенности химических превращений НДМГ и его поведение в объектах окружающей среды / О.Н. Шпигун, О.И. Старыгин //Ползуновский вестник. – 2004.- № 4. – С. 81-87.
Воронежский государственный технический университет
УДК 534.7
О.Н. Болдырева, А.О. Меринова
ТЕХНОЛОГИЯ ПОДДЕРЖАНИЯ ВОДНО-ХИМИЧЕСКОГО РЕЖИМА ДЛЯ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ РАБОТЫ ВОДООХЛАДИТЕЛЬНЫХ ЦИКЛОВ
Эксплуатация водооборотных систем сопровождается появлением ряда проблем, таких как отложение солей на теплообменных поверхностях, биологическое обрастание, активация процессов коррозии стали и цветных металлов, загрязнение воды. Надежность работы теплообменного оборудования в значительной мере зависит от качества охлаждающей воды и поддержания определенного водно-химического режима
Вышеперечисленные проблемы приводят к нарушению технологических режимов и снижению эффективности производственного процесса, увеличению времени и затрат на обслуживание и тем самым к снижению выпуска основной продукции и увеличению её себестоимости.
Ввиду этого следует уделять большое внимание методам стабилизации охлаждающей воды. Под стабильностью воды подразумевается такой её химический состав в температурных условиях эксплуатации, при котором отсутствует накипеобразование, развитие микробиологии и минимизируются процессы коррозии, нарушающие нормальное протекание технологического режима.
Внедрение стабилизационной обработки циркуляционных водоохладительных систем обеспечивает:
- поддержание оптимального, наиболее экономичного режима работы за счет снижения количества подпиточных и продувочных вод, обеспечивая возможность работы на более высоком коэффициенте упаривания, и, следовательно, экономии водных ресурсов и минимизации размера стоков;
- предотвращение образования минеральных отложений на теплообменных поверхностях;
- ингибирование процессов коррозии;
- предотвращение биологического обрастания.
Основным
соединением, встречающимся в составе
отложений в теплообменном оборудовании,
является ![]() .
Он образуется следствие распада
содержащихся в воде бикарбонатных ионов
под влиянием нагрева воды и потери
растворенной углекислоты при разбрызгивании
на градирнях и в брызгательных бассейнах:
.
Он образуется следствие распада
содержащихся в воде бикарбонатных ионов
под влиянием нагрева воды и потери
растворенной углекислоты при разбрызгивании
на градирнях и в брызгательных бассейнах:
(![]() -
-
![]() +
+![]() +
+![]() ).
).
Увеличение
концентрации в воде карбонатных ионов
![]() при наличии в ней катионов кальция
приводит к образованию осадка
,
обладающего способностью давать плотные
отложения, особенно в местах напряженных
температурных условий.
при наличии в ней катионов кальция
приводит к образованию осадка
,
обладающего способностью давать плотные
отложения, особенно в местах напряженных
температурных условий.
Растворимость
карбоната магния значительно выше, чем
карбоната кальция, поэтому ![]() входит в состав накипи в незначительном
количестве в результате одновременного
осаждения с карбонатом кальция.
входит в состав накипи в незначительном
количестве в результате одновременного
осаждения с карбонатом кальция.
Железистые отложения возникают вследствие образования нерастворимого трехвалентного железа как результата процессов коррозии или большого содержания железа в подпиточной воде.
Для предотвращения накипеобразования и ингибирования коррозии предлагается ряд многофункциональных ингибиторов, состоящих из компонентов, обладающих синергетическим эффектом, при котором эффективность смеси соединений превышает эффективность каждого компонента в отдельности. В таких продуктах противонакипной эффект формируется за счёт действия нового класса полимеров и фосфонатов, устойчивых к действию оксидантов, путём блокирования центров кристаллизации и эффективного диспергирования.
Процессы коррозии, встречающиеся в охладительных циклах, достаточно многообразны и обусловлены следующими факторами:
химическими:
-рН - при её снижении повышается растворимость многих оксидов металлов, и ускоряются процессы коррозии. Оксиды амфотерных металлов неустойчивы как при низком, так и при высоком значении рН;
- солесодержание-растворенные соли, как правило, ускоряют коррозию вследствие увеличения электропроводности среды и усиления тока коррозийных элементов. При повышении в воде концентрации хлоридов скорость общей коррозии возрастает также вследствие понижения устойчивости защитных пленок;
-растворенные газы - коррозия стальных элементов в системах охлаждения нередко вызывается растворенным в воде кислородом, которым особенно интенсивно обогащается циркуляционная вода при разбрызгивании в охладителях. Другие растворенные газы также принимают активное участие в интенсификации коррозийных процессов : свободная углекислота обуславливает понижение рН воды, наличие в воде большого количества свободной углекислоты препятствует образованию прочных пленок на металле; аммиак вызывает коррозию медных сплавов, сероводород и хлор усиливают кислотную коррозию и разрушают защитные пленки.
Другим фактором, стимулирующим коррозийные процессы, является наличие в оборотной воде микроорганизмов, взвешенных веществ и др., физическими:
-температура- с повышением температуры воды скорость коррозии возрастает;
-скорость потока-по мере возрастания скорости движения воды в трубах коррозия до известного предела возрастает, что, по-видимому связано с увеличением притока к металлу кислорода, усиливающего деполяризацию катодных участков коррозийных элементов. Дальнейшее увеличение скорости движения воды может несколько уменьшить коррозию за счет пассивирования металла и образование прочных оксидных пленок при энергичном притоке кислорода. Большие скорости движения воды вновь приводят к увеличению интенсивности коррозии вследствие механического разрушения потоком воды защитных пленок.
К другим физическим факторам, влияющим на процессы коррозии, можно отнести наличие деформаций на поверхности метала и внутренних напряжений в нем.
Обычно коррозийные процессы сопровождаются образованием на стенках труб бугристых отложений, что приводит к возникновению зон с различной степенью аэрации (зона дефицита кислорода служит анодом). Возникает цикл самоподдерживающей коррозии. Металл теряется с продуктами коррозии, образуя дополнительные осадки, которые в свою очередь вновь образуют зоны различной аэрации с дальнейшим усилением коррозии.
Антикоррозийный эффект обеспечивается за счет комбинации нескольких механизмов ингибирования коррозии стальных и модьсодержащих сплавов с быстрым формированием по всей металлической поверхности защитной пленки. Кроме того, усиление антикоррозийного действия реагентов возможно за счет комбинации двойного механизма ингибирования коррозии, с использованием ингибиторов как катодного, так и анодного типа.
Причиной развития бактерий и водорослей в охлаждающих системах является наличие в воде необходимых для них питательных веществ и благоприятные температурные условия. Особенно интенсивное развитие биологических обрастаний в охлаждающих системах наблюдается при повышенном содержании в воде питательных минеральных и органических веществ. Развитие бактерий на стенках аппаратов и труб проявляется в виде слизистых отложений, на которых способны накапливаться взвешенные вещества и продукты накипеобразования.
При содержании в охлаждающей воде большого количества железа возможно развитие железобактерий. Эти бактерии способны быстро размножаться и закупоривать трубки теплообменников.
При использовании для охлаждения вод, содержащих сульфаты, могут развиваться сульфатредуцирующие бактерии, что в некоторых случаях приводит к образованию сероводорода и сульфидов, особенно под толщей отложений. Следствием этого может быть язвенная коррозия с быстрой потерей металла.
Биологические обрастания ухудшают работу систем охлаждения не только вследствие того, что нарушают условия теплопередачи и увеличивают потерю напора в трубах, но также вследствие интенсификации коррозии труб и аппаратов.
Для предотвращения биологического обрастания оборотных систем существует широкий ряд микробиоцидов, действие которых направлено на подавление роста бактерий и водорослей.
Для разрушения и удаления биологической пленки с поверхностей теплообменного оборудования и повышения эффективности действия биоцидов используются различные биодисперсанты. Биодисперсанты работают в широком диапазоне рН, отличаются низкой токсичностью и коротким периодом биоразложения, не коррозийно-активны. Схема реагентной обработки показана на рисунке.
Контроль эффективности ингибирования процессов коррозии осуществляется с помощью образцов-свидетелей, которые изготавливаются из материалов, аналогичных имеющимся в оборотной схеме (сталь, медь, алюминий). Скорость протекания коррозии определяется по потере веса образца-свидетеля после определенного времени экспозиции его в оборотной схеме.
Контроль за биологическим обрастанием циркуляционной системы ведется по общему микробному числу (ОМЧ), для определения которого, как правило используются экспресс-тесты.
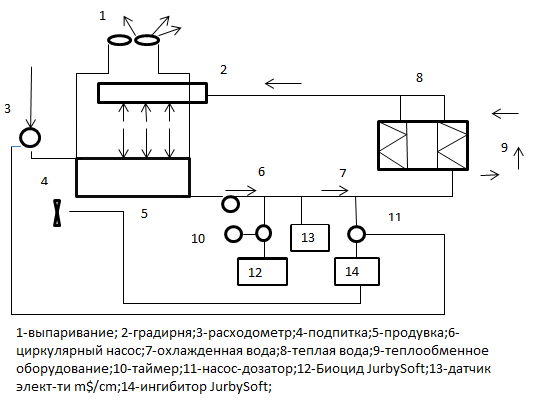
Схема реагентной обработки: 1- выпаривание; 2- градирня; 3-расходомер; 4-подпитка; 5-продувка; 6-циркулярный насос; 7-охлажденная вода;8-теплая вода; 9- теплообменное оборудование; 10-таймер; 11-насос-дозатор; 12-Биоцид JurbySoft; 13- датчик элект-ти ms/сm; 14-ингибитор JurbySoft
Литература
Рябчиков Б.Е. Современные методы подготовки воды для промышленного и бытового использования. М.:Принт,2004-328с.
2. Киприянов Н.А. Физическая химия процесса очистки воды. М.: Изд-во РУДН,2004-147 с.
3. Лоренц В.И. Эксплуатация промышленных очистных сооружений. М.: Стройиздат,1992-184 с.
4. Акимова Т.А. Экология. М.: ЮНИТИ-ДАНА, 2011. 343 с.
Воронежский государственный технический университет
УДК 621.315.61
С.А. Казакова, П.В. Бежин, И.М. Винокурова
Влияние импульсного тока на физико-химические свойства формообразования поверхности титановых и алюминиевых сплавов при ЭХО
Представлены сведения о формообразовании поверхности титановых и алюминевых сплавов при нестационарных режимах обработки
Скорости электродных реакций и большинство параметров двойного электрического слоя являются экстенсивными характеристиками и их необходимо относить к единице площади поверхности раздела. В связи с этим необходимо определять истинную поверхность электродов, что представляет собой довольно сложную задачу. Экспериментальные данные различных лабораторий могут отличаться по своим значениям на достаточно большие величины, именно из-за неправильного определения истинной поверхности электродов.
Методы измерения истинной поверхности подразделяются на две большие группы, включающие различные методики:
I in sity (вес или объём капли, отношение ёмкостей, зависимость Парсона-Цобеля, адсорбция водорода из раствора, адсорбция кислорода из раствора, осаждение металлов в области “недонапряжения”, вольтамперометрия, отрицательная адсорбция, ёмкость ионного обмена, адсорбция пробных молекул из раствора, массоперенос.
II ex sity (адсорбция пробных молекул из газовой фазы, рентгеновская дифракция, пирометрия, микроскопия.
Обычно истинная площадь поверхности, отнесённая к геометрической поверхности, характеризуется фактором шероховатости fr=A/A.
Известно, что число ионов металла, находящегося в химическом равновесии, вышедших в раствор, определяется свойством самого металла, электролитом, в котором находится последний, а также величиной поверхности, контактирующей непосредственно с электролитом. В общем виде поверхностную шероховатость в некоторых случаях можно рассматривать, используя теорию фрактальной геометрии. Основным методом для определения активной поверхности алюминиевой фольги является метод определения заряда фольги, помещённой в электролит относительно платинового электрода.
Если измерения производятся для одного металла и в электролите определённого состава, то величину поверхности можно связать с величиной заряда следующим соотношением:
S = k Q, (1)
где k – коэффициент, учитывающий химические константы равновесия для данной системы электрод-электролит; Q – величина заряда двойного электрического слоя; S – площадь активной поверхности.
Заряд системы электрод-электролит таким образом однозначно определяет активную поверхность электрода. Осциллограммы разрядных токов таких систем на сопротивлении различной величины приведены на рисунке.
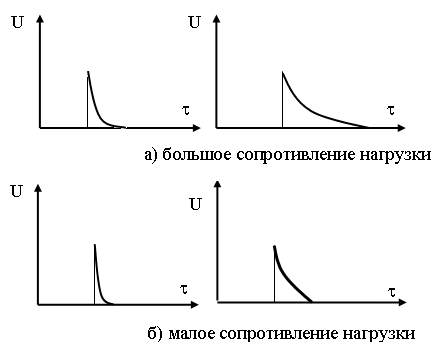
Осциллограммы рарядных токов электродных систем.
Осциллограммы, находящиеся на левой стороне фотографии
относятся к электродам с малой активной поверхностью
Поликристаллические твёрдые материалы состоят из набора случайно ориентированных кристаллов, являющихся наименьшими частицами монокристаллов. В случае дисперсных материалов два или более кристаллов могут объединяться через границы зёрен и образовывать частицы. Они характеризуются своими размерами, формой и функцией распределения по размерам. Доменные модели описывают неоднородные поверхности, как совокупность однородных доменов. Поэтому неоднородность выражается с помощью функции пространственного распределения.
Для
кристаллитов с диаметром di
и количеством частиц ni
количественный средний диаметр для
данного распределения частиц по размерам
выражается как:
![]() (2)
(2)
поверхностный
средний диаметр:
![]() ,
(3)
,
(3)
а
объёмный средний диаметр:
![]() .
(4)
.
(4)
Каждый из указанных диаметров определяется экспериментально, и точность его измерения зависит от методики и условий измерений.
При рассмотрении вопроса определения истинной поверхности по методу in situ следует отметить, что вес (или объём капли) может быть применён только для электродов в жидком состоянии. Электроды могут в этом случае быть как статическими (покоящимися или висячая капля), так и динамическими (падающая капля).
Площадь А растущей капли рассчитывается по формуле
![]() ,
(5)
,
(5)
где - плотность вещества капли.
Если m выражается в г, t – в с, а -г/см3, то площадь получается в см2. Уравнение точно выполняется для отдельной капли только в конце её времени жизни.
Метод отношения ёмкостей обычно используется для определения истинной поверхности твёрдых электродов. Он широко применяется для сопоставления площадей поверхностей из одного и того же электродного материала. Одна из разновидностей этого метода заключается в том, что измерение ёмкости производится в очень разбавленных растворах (С 10-3 М) в предположении, что минимальное значение её при потенциале нулевого заряда полностью определяется ёмкостью диффузионного слоя.
При использовании этого метода для твёрдых электродов необходимо, чтобы поверхность была абсолютно однородной и измеряемая ёмкость не зависела от частоты. Следует отметить, что при увеличении концентрации потенциалопределяющих ионов и степени пассивации электрода уменьшается степень совпадения результатов измерений.
Метод, основанный на адсорбции водорода для определения истинной поверхности алюминиевого электрода, по-нашему убеждению применять нецелесообразно, так как адсорбция Н2 на поверхности алюминия носит характер, описываемый закономерностями случайной величины.
Одним из предлагаемых методов определения истинной поверхности является метод адсорбции пробных молекул из раствора электролита. Сущность метода заключается в том, что пробные молекулы адсорбируются на твёрдом электроде, находящемся в растворе.
Величина адсорбции определяется по степени обеднения раствора, в качестве основных компонентов которого используются нейтральные растворы, содержащие ПАВ, жирные кислоты и многоатомные спирты. Площадь поверхности твёрдого электрода вычисляется из поверхностной многослойной концентрации по уравнению:
![]() ,
(6)
,
(6)
где
![]() -
наполнение насыщения, моль/см2;
-
наполнение насыщения, моль/см2;
![]() - площадь проекции одной адсорбированной
пробной молекулы.
- площадь проекции одной адсорбированной
пробной молекулы.
Для различных форм электрода уравнения имеют свои специфические формы определения поверхности. Анализ литературных данных позволяет сделать заключение о том, что методики системы [tx situ] не могут быть использованы для контроля степени развития поверхности непосредственно в технологическом процессе.
Разработанная методика была проверена в лабораторных условиях и даны положительные результаты. Характер снятых зависимостей позволяет создать прибор, регистрирующий изменение поверхности в широком интервале измеряемых величин с точностью не хуже 5 %.
Воронежский государственный технический университет
УДК 621.315.61
А.С. Костюков, Б.А. Спиридонов
ОСОБЕННОСТИ ХИМИЧЕСКОГО МЕДНЕНИЯ ДИЭЛЕКТРИКОВ
Изучен процесс нанесения медных покрытий на пластмассы методом химического восстановления. Установлено заметное влияние калия железосинеродистого, введенного в раствор химического меднения в качестве стабилизатора
Нанесение металлических покрытий на пластмассы и другие диэлектрики (процесс металлизации) позволяет получать специфические композиционные материалы с ценным сочетанием свойств металла и диэлектрика в одной детали. Применение таких материалов позволяет заменять цветные металлы, резко снижать массу и себестоимость конструкций, соединять детали пайкой, предохранять изделия из пластмассы от старения и механических повреждений, придавать им негорючесть, а также стабильность формы и размеров при тепловых нагрузках [1].
Широкое применение металлизация диэлектрических материалов получила в приборостроении и радиоэлектронике. Металлизацию в виде сплошного покрытия применяют для керамических корпусов микросхемных устройств, чаще всего производят частичную металлизацию поверхности для получения проводниковых элементов электрических схем, нанесенных на диэлектрические материалы [2].
Соответствующим подбором видов покрытий и их толщины на подложках из керамических материалов, а также таких материалов, как ситаллы, и некоторых других получают очень сложные электрические схемы, в состав которых входят сопротивления, индуктивности, емкости, проводники и тому подобные электрические элементы в виде тонких пленок.
В зависимости от способа получения различают химические, гальванические, конденсационные и другие металлопокрытия диэлектриков. По назначению гальванические металлопокрытия, получаемые на диэлектриках, классифицируют как защитно-декоративные и специальные. Первые предназначены для придания поверхности декоративных свойств с одновременной защитой ее от воздействий окружающей среды, вторые – для решения разнообразных технических задач, определяемых в основном природой металлов и структурой покрытия: обеспечения электропроводимости, теплопроводности, магнитных и оптических свойств и других. Например, широкое применение в радиотехнике получил метод химического меднения радиоэлектронных плат.
Из пластмасс, на которые наносят металлические покрытия, наибольшее практическое применение получили пластики АБС (тройной сополимер – акрилонитрил, бутадиен и стирол), полипропилен, а также термореактивные пластмассы (карболиты, фенолформальдегидные и эпоксидные стеклопластики). Большинство этих материалов характеризуются повышенными электроизоляционными свойствами, мало подвергаются деформациям при воздействии повышенной температуры.
Прочность сцепления металлического покрытия с основой зависит от природы диэлектрика, способов и режимов изготовления из него деталей, качества подготовки поверхности и многих других факторов. В значительной степени она определяется толщиной получаемого покрытия и механической прочностью поверхностного слоя диэлектрика глубиной 1-2 мкм. Величина прочности сцепления у различных диэлектриков может колебаться от нескольких сотых до 14 кН/м при отслаивании покрытия.
По теории механического зацепления, объясняющей возникновение прочной связи между металлом и диэлектриком, на поверхности, подготовленной к нанесению покрытия, содержится большое количество микроскопических углублений (у пластика АБС – до 60 млн. на 1 см2). В эти углубления проникает осаждаемый химическим способом металл и при заполнении их образует механическое зацепление типа “ласточкина хвоста”. Чем больше этих зацеплений, тем больше прочность сцепления между поверхностью диэлектрика и сформированным на нем металлическим покрытием.
Химическая теория, впервые обоснованная Собестром и его коллегами, учитывает химическое взаимодействие между металлом покрытия и пластмассой за счет ванн-дер-вальсовых сил.
Химико-электролитическая металлизация неорганических диэлектриков, как и пластмасс, осуществляется в две стадии:
1) осаждение химическим способом слоя меди, никеля или серебра;
2) электролитическое осаждение металла покрытия.
Для получения первичного металлического слоя на диэлектрических материалах химическое осаждение металлов является определяющей и специфичной операцией всего технологического процесса металлизации. Химическая металлизация предусматривает проведение следующих предварительных операций: обезжиривание, сенсибилизирование, активирование.
Реакции химического восстановления металлов (медь, никель) являются автокаталитическими, т.е. металл, образовавшийся в результате химического восстановления из раствора, катализирует дальнейшую реакцию восстановления этого же металла. Но для начального периода восстановления металла необходимо, чтобы покрываемая поверхность имела каталитические свойства, которые создаются в результате выполнения операции, получившей название активирование. Активирование заключается в том, на обрабатываемую поверхность наносятся химическим методом чрезвычайно малые количества металлов, являющихся катализаторами химического восстановления. Такими катализаторами являются коллоидные частицы или малорастворимые соединения палладия, платины, золота, серебра. Наибольшее распространение получил палладий, обладающий высокой каталитической активностью [3].
Образование каталитического слоя в виде металла, находящегося в коллоидном состоянии, - процесс весьма сложный и состоит из двух стадий. Первая стадия – нанесение пленки раствора, восстанавливающего каталитический металл (палладий) из раствора его соли; вторая стадия – погружение в раствор соли металла катализатора и восстановление его до металлического состояния в пленке раствора, прилегающей к поверхности диэлектрика.
Первая стадия обработки называется сенсибилизированием. Самым эффективным способом сенсибилизирования является обработка поверхности в растворе солей двухвалентного олова. После извлечения деталей из раствора сенсибилизатора следует промывка в холодной проточной воде, предназначенной для проведения гидролиза хлорида олова, обволакивающего поверхность пластмассы, и образовании малорастворимых основных солей олова, прочно адсорбирующихся на поверхности. Гидролиз хлорида олова происходит по реакции:
SnCl2 + H2O = Sn(OH)Cl + HCl
Процесс активирования заключается в том, что на поверхности диэлектрика, сенсибилизированной двухвалентным оловом, происходит реакция восстановления ионов каталитического металла (палладия) по реакции:
Pd2+ + Sn2+ = Pd + Sn4+
Металлический палладий в коллоидной форме равномерно распределяется тончайшим слоем по всей поверхности обрабатываемой детали.
Осаждение химическим способом меди, никеля или серебра для получения первичного металлического слоя на диэлектрических материалах является определяющей и специфической операцией всего технологического процесса металлизации.
В настоящее время разработано достаточно большое число растворов, используемых для, например, метода химического осаждения меди. Их составы отличаются большим многообразием по количеству содержащихся компонентов, однако характерным признаком каждого из них являются: соли двухвалентной меди; вещества для связывания двухвалентной меди в комплекс; вещество восстановитель; вещество, регулирующее величину рН раствора; различные добавки.
Последними исследованиями был изучен механизм восстановления меди формалином и установлен характер этого процесса. На металлической меди роисходит сопряженный процесс катодного восстановления меди
Cu2+ + 2ē = Cu
и анодного окисления формальдегида
CH2O + 3OH- = HCOO- + 2H2O + 2ē
Стандартный редокс-потенциал этой реакции в щелочной среде E0 = -1,07 В. Основная суммарная реакция процесса восстановления меди следующая:
2CH2O + Cu2+ + 4OH- → Cu + H2 2HCOO- + 2H2O
Однако в процессе химического меднения происходит ряд побочных реакций, которые приводят к повышенному расходу отдельных компонентов раствора и к необходимости вводить стабилизирующие добавки. Так, по основному уравнению реакции восстановления меди на один моль двухвалентной меди требуется два моля формалина, однако практический расход формалина выше, так как в щелочных растворах формалин участвует в реакции Каницарро:
2HCОH + NaOH → CH3OH + HCOONa
т.е. половина молекул CH2O окисляется до муравьиной кислоты (муравьинокислый натрий), а половина молекул CH2O восстанавливается до метилового спирта. Кроме того, может происходить частичное восстановление меди до одновалентного состояния с образованием осадка закиси меди Cu2O по реакции
2Cu2+ + HCOH + 5OH- → Сu2O + HCOO- + 3H2O
Образовавшиеся частицы закиси меди могут стать центрами кристаллизации, восстанавливающими медь, или же превратиться в металлическую медь за счет реакции
2Cu+ → Cu + Cu2+
В том и другом случае происходит выпадение металлической меди в объеме раствора химического меднения, обусловливающего разложение раствора и прекращение нормальной его деятельности.
С целью стабилизации раствора, т.е. сохранения его работоспособности в течение длительного времени, в раствор химического меднения вводят специальные вещества стабилизаторы, небольшие количества которых комплексуют одновалентную медь и предотвращают этим образование Cu2O и металлической меди за счет восстановления Cu+ до металла.
Целью настоящей работы является проведение сравнительных испытаний растворов химического меднения для выбора наиболее эффективного из них.
Меднение проводили на пластмассовых образцах, выполненных из полипропилена и гетинакса размером 3х4 см. Перед меднением подготовку поверхности образцов проводили, используя известные операции [3]: обезжиривание в щелочном растворе, травление в растворе, содержащем бихромат натрия и серную кислоту, сенсибилизирование в растворе хлорида олова и активацию в растворе хлорида палладия.
Сравнительные исследования процесса меднения проводили в двух растворах состава (г/л): 1 - медь сернокислая – 15; калий-натрий виннокислый – 60; никель хлористый – 3; натрий углекислый – 3; гидрат окиси натрия – 15; формалин (37 % ) – 25 мл/л; тиосульфат натрия – 0,001; 2 - медь сернокислая – 35; калий-натрий виннокислый – 170; никель хлористый – 4; натрий углекислый – 35; гидрат окиси натрия – 50; формалин (37 %) – 15 мл/л; тиосульфат натрия – 0,003; температура комнатная.
Исследованиями установлено, что из первого раствора медь осаждается темная, хрупкая, быстро окисляемая на воздухе. Раствор стабилен во времени, но скорость реакции восстановления ионов меди невелика и составляет 0,9 мкм/ч при плотности загрузки 2 дм2/л. Поскольку концентрация сульфата меди мала, то, очевидно, этим можно объяснить более низкую производительность в сравнении с другим раствором 2, из которого медь осаждается со скоростью 3-4 мкм/ ч при той же плотности загрузки. Недостатком раствора является его нестабильность во времени. Так, уже через сутки из раствора медь начинает осаждаться на дне и стенках стеклянной емкости, в которой содержался раствор. Для повышения стабильности в раствор вводили вместо тиосульфата натрия калий железосинеродистый в количестве 0, 12 г/л [4]. При практически той же скорости осаждения меди раствор сохранял свои свойства в течение пяти суток.
Литература
1. Шалкаускас М.И. Металлизация пластмасс / М.И. Шалкаускас. - М.: Знание,1983. - 64 с.
2. Ильин В.А. Металлизация диэлектриков /В.А. Ильин. - Л.: Машиностроение, 1977. - 80 с.
3. Гальванические покрытия в машиностроении. Справочник. В 2-х томах/ М.А. Шлугер, Л.Д. Ток. – М.: Машиностроение, 1985. –Т. 2.- 1985.- 248 с.
3. Петрова Т.П. Химические покрытия /Т.П. Петрова. -Соросовский образовательный журнал, 2000. - № 11. - С. 57-62.
Воронежский государственный технический университет
УДК 502
Л.Н. Звягина
ИССЛЕДОВАНИЕ ФИЗИЧЕСКИХ ПРИНЦИПОВ ЗАЩИТЫ
