
Практикум по общей химии. Спиридонов Б.А
.pdfМИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Воронежский государственный технический университет»
Б. А. Спиридонов
ПРАКТИКУМ ПО ОБЩЕЙ ХИМИИ
Учебное пособие
Воронеж 2018
1
УДК 54(075.8)
ББК 24.2я7 С722
Рецензенты:
кафедра химии Воронежского государственного лесотехнического университета им Г. Ф. Морозова (зав. кафедрой, д-р техн. наук,проф. Л. И. Бельчинская); д-р физ.-мат. наук, проф. О. В. Стогней
Спиридонов, Б. А.
Практикум по общей химии: учеб. пособие / Б. А. Спи-
С722 ридонов; ФГБОУ ВО «Воронежский государственный технический университет». – Воронеж: Изд-во ВГТУ, 2018. – 99 с.
ISBN 978-5-7731-0672-2
В учебном пособии изложены требования и рекомендации по выполнению лабораторных работ по дисциплине «Химия». В описании каждой работы содержится краткое теоретическое введение, порядок выполнения экспериментальной части, контрольные вопросы и задачи.
Издание соответствует требованиям Федерального государственного образовательного стандарта высшего образования по направлениям 11.03.03 «Конструирование и технология электронных средств» и 12.03.01 «Приборостроение», дисциплине «Химия».
Предназначено для студентов 1 курса.
Ил. 13. Табл. 10. Библиогр.: 4 назв.
|
УДК 54(075.8) |
|
ББК 24.2я7 |
ISBN 978-5-7731-0672-2 |
© Cпиридонов Б. А., 2018 |
|
© ФГБОУ ВО «Воронежский |
|
государственный технический |
|
университет», 2018 |
2
ВВЕДЕНИЕ
Развитие радиотехники и электроники, вычислительной техники и электротехники требует решения множества задач только при комплексном использовании различных методов – физических, химических, технологических и др. В связи с этим возрастает роль химических знаний при подготовке специалистов в области микроэлектроники, конструирования и технологии производства радиоаппаратуры, электронным и электрическим приборам.
Пособие предназначено для студентов 1 курса нехимических специальностей вузов. Содержание пособия соответствует требованиям Федерального государственного образовательного стандарта высшего профессионального образования по направлениям «Конструирование и технология электронных средств» и «Приборостроение».
Вданном лабораторном практикуме ставилась задача привить студенту способность ориентироваться в химических и электрохимических процессах, имеющих большое значение для его будущей специальности.
Впособии представлены наиболее важные темы курса общей химии, изучение которых осуществляется в первом и втором семестрах в соответствии с рабочими программами курса химии. Для более глубокого понимания сущности выполняемых опытов перед описанием каждой лабораторной работы в краткой форме дано теоретическое введение. В конце каждой лабораторной работы представлены вопросы для самоподготовки. В первом семестре вначале практикума рассматриваются основные понятия и законы химии и на основании одного из них – закона эквивалентов – выполняется первая лабораторная работа по определению эквивалента металла. В дальнейшем выполняются опыты по темам: химическая термодинамика, кинетика химических реакций, закономерности изменения химических свойств элементов и их соединений, свойства растворов электролитов, окис- лительно-восстановительные реакции.
Во втором семестре выполняются опыты по электрохимическим процессам – гальванические элементы, электролиз водных растворов электролитов, электрохимическая обработка металлов (оксидирование, полирование, травление). При рассмотрении теории электрохимических процессов показано строение двойного электрическо-
3
го слоя в зависимости от активности металлов. Показано влияние поляризационных явлений на работу химических источников тока и при электролизе. Особое внимание уделено вопросам коррозии и методам электрохимической защиты металлов от коррозии. В практикум включены опыты, позволяющие ознакомиться со свойствами переходных d - металлов – важнейших конструкционных материалов. Представлены опыты, связанные с изучением свойств электропроводных металлов.
Контроль качества знаний студентом учебного материала проводится как по теоретическому материалу после самостоятельного изучения, так и по лабораторным опытам.
Допуск к лабораторным занятиям осуществляется на основе программированного контроля.
4
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
1.Категорически запрещается без разрешения преподавателя проводить какие-либо опыты, не предусмотренные планом занятий.
2.Не начинать работы без предварительной проверки исправности прибора, на котором проводятся опыты.
3.Все реактивы нельзя пробовать на вкус, большинство из них ядовиты. При определении выделяющегося газообразного вещества по запаху не наклоняться над пробиркой, а держа ее в стороне, направлять пары или газы на себя плавным движением руки.
4.Опыты с ядовитыми веществами (сероводород, хлор, двуокись азота и т.д.), а также с концентрированными кислотами и щелочами можно производить только в вытяжном шкафу. Концентрированные растворы кислот и щелочей не разрешается выносить из вытяжного шкафа на свое рабочее место.
5.Во время кипячения жидкости нельзя заглядывать в сосуд свер-
ху, так как вследствие местного перегрева стенок жидкость иногда выбрасывается, особенно при наличии в сосуде обильного осадка. Нагревая пробирку с жидкостью или другими веществами, следует держать ее отверстием в сторону от себя и окружающих. Нагревать нужно равномерно всю часть пробирки, заполненную веществами. Для предохранения рук от ожогов необходимо нагреваемую пробирку укрепить в специальном держателе.
6.Нагревая реактивы, никогда не наклонятся над сосудом, во избежание попадания брызг на лицо и одежду. Разбавляя кислоты, особенно серную, нужно вливать кислоту в воду, а не наоборот!
7.Выполняя опыты, связанные с опасностью взрыва, воспламенением или разбрасыванием кислот и щелочей, помимо соблюдения всех других предосторожностей работать следует обязательно стоя.
8.Зажигать спиртовку можно от спички или горящей лучинки, а гасить спиртовку с помощью колпачка.
9.Нельзя оставлять без присмотра зажженные спиртовки и включенные электроприборы.
10.Все опыты с легковоспламеняющимися жидкостями или веществами проводить подальше от огня и в вытяжном шкафу. Отработанные легковоспламеняющиеся жидкости (бензол, бензин, эфир, ацетон и т.д.) сливать в особые емкости.
11.Каждый студент должен знать, где находятся простейшие
5
средства огнетушения: вода, песок, огнетушитель, специальные одеяла, а также уметь ими пользоваться.
12.Все электроприборы и электрические установки общего пользования (тяга, вытяжные шкафы, выпрямитель тока) могут включаться только преподавателями или лаборантами.
13.При всех несчастных случаях необходимо обращаться к лаборанту или преподавателю. В случае ожога, попадания на лицо и руки щелочей или кислот необходимо немедленно промыть обожженный участок большим количеством воды, а затем остатки щелочи нейтрализовать 2 % раствором борной кислоты, а 2 % раствором соды – остатки кислоты.
14.Во избежание несчастных случаев обходимо работе следует точно выполнять все указания по технике безопасности, которые даны
вруководстве при описании опытов.
Лабораторная работа № 1
ОСНОВНЫЕ ЗАКОНЫ И ПОНЯТИЯ ХИМИИ
Закон сохранения материи. Закон сохранения материи, или закон сохранения масс и энергий, является основным законом естествознания. Впервые он был сформулирован и экспериментально обоснован М.В. Ломоносовым в 1756 -1759 гг.
В современном виде этот закон формулируют следующим обра-
зом: в изолированной системе сумма масс и энергий постоянна.
На законе постоянства массы основано изучение химических процессов, количественные соотношения веществ, указывающих на них.
Закон постоянства состава. Этот закон был сформулирован Прустом (1801-1808 гг.): всякое химически индивидуальное вещество имеет всегда один и тот же количественный состав независимо от способа его получения.
Закон кратных отношений. В 1808 г. этот закон был сформу-
лирован Дальтоном: если два вещества образуют между собой не-
сколько соединений, то количество одного из них, отнесенное к одному и тому же количеству другого, относится как небольшие целые числа.
6
Закон Авогадро (1811 г.): в равных объемах любых газов при одинаковых физических условиях содержится одинаковое число частиц.
В 1856 г. Жераром были установлены следствия из закона Авогадро.
Первое следствие: 1 моль любого газа имеет равный объем
при одинаковых физических условиях. |
|
|
Молярный объем |
газа при нормальных |
условиях (Т = |
273°С, Р = 1,013·105 |
Па) Vm = 22414 см3/моль |
= 22,4 л/моль |
или 22,4 м3/Кмоль. |
|
|
Второе следствие: молекулярная масса газообразного вещества равна удвоенной плотности его по водороду (точнее 2,016
плотности):
Mx = М Н |
|
· 2.016 D X |
|
= 2.016 D X |
, |
(1.1) |
||
|
2 |
H |
2 |
|
|
H |
2 |
|
|
|
|
|
|
|
|
||
где Мх – молекулярная масса газа х; D X |
– |
плотность газа х по во- |
||||||
|
|
|
|
H |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
дороду. |
|
|
|
|
|
|
|
|
В 1908-1910 гг. Перреном была определена постоянная Авогад- |
||||||||
ро (NA): |
|
|
|
|
|
|
|
|
NA= 6,02 ·1023 |
моль -1 |
|
|
(1.2) |
||||
Единицей количества вещества является моль. Моль – это
масса вещества, содержащая число частиц, равное постоянной Авогадро, имеющих собственное тепловое движение. Масса одно-
го моля равна молекулярной массе вещества, выраженной в граммах. В системе СИ обычно рассматривают величину в тысячу раз больше моля – киломоль.
Закон эквивалентов. В 1848 г. Дальтоном был установлен закон эквивалентов: все вещества реагируют в эквивалентных отноше-
ниях.
Химическим эквивалентом вещества называется такое его количество, которое соединяется с одним молем водорода или замещает то же количество атомов водорода в химических реакциях.
Эквивалентной массой называется масса одного эквивалента вещества. Согласно закону эквивалентов вещества реагируют между собой в строго определенных количествах, пропорциональных их эквивалентной массе:
m1/ тЭ |
= m2/ тЭ , |
(1.3) |
1 |
2 |
|
7
где m1 и m2 – массы первого и второго вещества; mЭ1 – эквивалентные массы первого и второго вещества. Эквивалент элемента или вещества определяется по формуле:
|
|
|
Э =А/п |
|
(1.4) |
||||||
где А – атомная масса элемента; п – валентность элемента. |
|
||||||||||
|
Для основных классов неорганических соединений эквивален- |
||||||||||
ты определяются по следующим формулам: |
(1.5) |
||||||||||
|
|
|
Эоксида |
|
М оксида |
|
|||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
К n |
|
|
||
где К – число атомов элемента; п – валентность элемента; |
|
||||||||||
Моксида – молярная масса оксида; |
|
|
|
|
|
|
|
|
|||
|
|
|
Экисл. |
|
|
М кисл. |
, |
(1.6) |
|||
|
|
|
|
|
n |
||||||
|
|
|
|
|
|
|
|
|
|||
где Мкисл – молярная масса кислоты; п – основность кислоты; |
|
||||||||||
|
|
|
Э |
|
М осн. |
|
|
, |
(1.7) |
||
|
|
|
|
|
|||||||
|
|
|
осн. |
|
|
|
n |
|
|
||
|
|
|
|
|
|
|
|
|
|||
где |
Мосн. – молярная масса основания; |
п – кислотность основания; |
|||||||||
|
|
|
Э |
|
М соли |
|
, |
(1.8) |
|||
|
|
|
|
||||||||
|
|
|
соли |
|
|
|
К n |
|
|
||
|
|
|
|
|
|
|
|
|
|||
где |
Мсоли – молярная |
масса |
соли; |
|
|
К – число атомов металла; п – ва- |
|||||
лентность металла. |
|
|
|
|
|
|
|
|
|
|
|
|
Если в реакции участвуют газообразные вещества, то целесо- |
||||||||||
образнее использовать значение эквивалентного объема. |
|
||||||||||
|
Эквивалентным объемом называется объем, занимаемый |
при |
|||||||||
данных условиях |
одним |
эквивалентом вещества. Эквивалентный |
|||||||||
объем водорода равен 22,4/2 = 11,2 л/моль, а кислорода 22,4/4 = 5,6 л/моль.
Опыт 1.1. Определение эквивалента металла
Цель опыта: ознакомиться с одним из методов экспериментального определения эквивалентов металлов по объему вытесненного водорода.
8
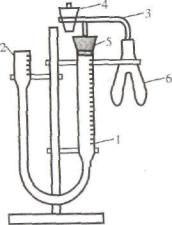
Рис. 1. Прибор для определения эквивалента металла:
1 – бюретка на 100 мл; 2 – уравнительный сосуд; 3 – стеклянный тройник с каучуковой трубкой; 4 – кран; 5 – каучуковая пробка;
6 – склянка Оствальда
Выполнение опыта. Соберите прибор, показанный на рис. 1. В уравнительный сосуд налейте через воронку воду, которая заполнит бюретку и вытеснит из прибора избыток воздуха через открытый кран 4. Бюретку укрепите на штативе так, чтобы уровни воды в бюретке и в открытой трубке совпадали с нулевым давлением. В одно колено пробирки поместите кусочек металла, а в другое (через воронку) налейте на две трети объема 15% раствор соляной кислоты. Закройте пробирку пробкой, соединенной при помощи трубки с бюреткой. Проверьте герметичность прибора. Для этого уравнительный сосуд опустите вниз на 15-20 см. Если уровень воды в бюретке немного опустится, а затем останется постоянным, следовательно, прибор герметичен. Если уровень воды в бюретке меняется, то значит, что прибор негерметичен. Необходимо устранить причину неполадки, проверив надежность крана и пробок. После того как установите, что прибор герметичен, поверните пробирку таким образом, чтобы кислота перелилась в одно колено пробирки, где находится металл. В результате взаимодействия металла с кислотой выделяющийся водород вытесняет из бюретки воду. По окончании реакции следует выждать 3-5 мин, чтобы содержимое пробирки охладилось до комнатной температуры. Затем установите на одной высоте уровень воды в бюретке и уравнительном сосуде (при этом внутри прибора создается давление, равное давлению наружного воздуха) и отметьте уровень воды в бюретке по-
9
сле опыта. Разность уровней V2-V1 равняется объему выделившегося водорода.
Обработка результатов опыта. Напишите уравнение реакции растворения исследуемого металла в соляной кислоте. Начертите табл. 1, в которую занесите результаты опыта и условия его проведения: температуру Т, атмосферное давление в период опыта Р (мм. рт. ст.) и давление насыщенного водяного пара h (мм. рт. ст.). Поправку h вводят вследствие того, что общее давление над водой в бюретке является суммой парциальных давлений водорода и паров воды. Давление водяного пара, соответствующее температуре опыта дано в прил. 1.
|
|
|
|
|
Таблица 1 |
|
|
|
|
Результаты опыта |
|
|
|
Масса |
Объем |
Темпе- |
Атмосфер- |
Давление |
|
|
металла, |
выделив- |
ратура, |
ное давление |
насыщенного |
|
|
г |
шегося |
Т |
Р, |
водяного |
|
|
|
водорода |
|
мм рт. ст. |
пара, |
|
|
|
VH |
, мл |
|
|
мм рт. ст |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для правильного вычисления необходимо привести объем
выделившегося водорода VH 2 к нормальным условиям |
(Ро = 760 мм. |
|||||
рт. ст., То = 273 К), используя объединенный газовый закон: |
||||||
|
PVH |
2 |
|
P V |
|
|
|
|
|
о о |
сonst , |
(1.9) |
|
|
|
|
|
|||
|
T |
|
|
Tо |
|
|
где Ро,Vо , То – термодинамические характеристики газа при нормальных условиях, а Р, VH 2 и Т – в условиях проведения опыта.
Очевидно, что |
V 0 |
|
VH 2 P 273 |
. |
|
||||
|
H 2 |
|
760 T |
|
Вычислите эквивалент металла по закону эквивалентов, учитывая, что эквивалентный объем водорода равен 11,2 л/моль:
|
|
Эме |
тме 11,2 |
или |
|
|
|
|||
|
|
V 0 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H 2 |
|
|
|
|
|
|
|
Эме |
тме 11200 760 Т |
|
31179,5 mме |
Т |
. |
(1.10) |
||||
VH |
(P h) 273 |
|
VH |
(P h) |
|
|||||
|
|
|
|
|
|
|||||
|
|
2 |
|
|
|
|
2 |
|
|
|
Рассчитав теоретическое значение эквивалента металла по формуле (1.4), сравните полученное значение с экспериментально
10
