
Учебное пособие 800537
.pdfКонтрольные вопросы и задачи
1.Приведите примеры реакций взаимодействия металлов с водой: а) при комнатной температуре; б) при повышенной температуре.
2.Какие металлы ряда напряжений могут взаимодействовать с окисляющими кислотами?
3.Что такое пассивность металлов? Чем она обусловлена?
4.В чем состоит особенность взаимодействия металлов с окисляющими кислотами? Объясните, как влияет активность металлов и степень разбавления кислоты на характер образующихся продуктов восстановления.
Лабораторная работа № 13
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексными называются соединения, в состав которых входят комплексные ионы. Комплексные ионы состоят из центрального иона, который называется комлексообразователем, вокруг которого расположены другие ионы или полярные молекулы – лиганды. Количество лигандов, которое координируется около комплексообразователя, называется координационным числом. Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения, которая изображается квадратной скобкой. Например, в комплексном соединении [Со (NH3 )4]Cl2 внутренней сферой со является ион [Со (NH3 )4]2+, в котором Cо2+ – комплексообразователь, молекула NH3 – лиганд, а 4 – координационное число. Между комплексообразователем и лигандом осуществляется донорно-акцепторная связь. Внешнюю сферу составляют ионы Cl-. Внутренняя и внешняя сфера образуют химическую ионную связь.
В зависимости от заряда комплексообразователя и лигандов внутренняя сфера может иметь положительный или отрицательный заряд или не иметь заряда. По этому признаку комплексные соединения относят к комплексам катионного или анионного типа или нейтральным комплексам.
В водных растворах ионы внешней сферы практически полностью отделяются от комплексных ионов в соответствии с электролитической диссоциацией:
81
[Со (NH3 )4]Cl2 ↔ [Со (NH3 )4]2+ + 2Cl-.
Диссоциация внутренней сферы комплекса происходит незначительно. Основной количественной характеристикой процесса диссоциации внутренней сферы является константа равновесия или кон-
станта нестойкости Кн
[Со (NH3 )4]2+ ↔ Cо2+ + 4 NH3.
Кн = CСо2+ · C4 NH3 / C[Co(NH3)4 ]2+.
Диссоциация комплексного иона происходит ступенчато с отрывом одной молекулы лиганда, затем другой и т.д., при этом каждой ступени отвечает своя константа нестойкости.
Цель опытов: изучить методы получения и свойства некоторых комплексных соединений.
Опыт 13.1. Получение и свойства комплексных соединений
Выполнение опыта. а) Налейте в пробирку раствор CuSO4 и прибавьте раствор аммиака до выпадения зеленовато-голубоватого осадка основной соли (CuOH)2SO4. Затем по каплям прибавьте избыток аммиака. Что наблюдаете? Напишите уравнение реакции в молекулярной и ионной форме. Прибавьте к полученному раствору несколько капель сероводородной кислоты. Напишите уравнение реакции и объясните выпадение черного осадка. Учтите, что произведение растворимости сульфида меди ПРCuS = 8,5·10- 45.
б) В три пробирки налейте растворы солей Al3+, Cr3+, Co2+ и по каплям прилейте раствор NaOH до образования осадков Al(OH)3, Cr(OH)3, Co(OH)2. Налейте в каждую пробирку избыток концентрированного раствора NaOH. Образуются комплексные соединения,
содержащие ионы [Al(OH)6]3-, [Cr(OH)6]3-, [Co(OH)4]2-. Напишите уравнения реакций образования осадков и комплексных ионов.
в) Прокалите в тигле кристаллогидраты NiSO4· 7H2O, CoSO4· 6H2O, CuSO4· 5H2O. Полученные безводные соли, охладите и затем прилейте к ним немного воды. Наблюдайте изменение окраски. Уч-
тите, что безводные соли при взаимодействии с водой образуют ком-
плексные ионы: [Ni(H2O)6]2+, [Co(H2O)6]2+, [Cu(H2O)4]2+.
г) В пробирку налейте 5 мл раствора FeCl3 и прибавьте 5 мл раствора гексациано-11 феррата калия K4[Fe(CN)6]. Каков цвет осадка
82
и как он называется? Напишите уравнение реакции в молекулярной и ионной форме.
Контрольные вопросы и задачи
1. Какие вещества относятся к комплексным соединениям?
2.Почему кристаллогидраты относятся к комплексным соединениям?
3.Какова структура комплексного соединения?
4.Что называется константой нестойкости комплексного иона?
5.Как протекает диссоциация комплексных ионов [Fe(CN)6]3- и
[Fe(CN)6]4 –?
Лабораторная работа № 14
СВОЙСТВА ПЕРЕХОДНЫХ d – ЭЛЕМЕНТОВ
Положение переходных элементов в периодической системе Д.И. Менделеева и электронные конфигурации их атомов
Элементы периодической системы, расположенные в В- группах, называются переходными (ПЭ) или переходными металлами, поскольку обладают всеми свойствами, характерными для металлов.
У переходных металлов происходит заполнение электронами внутренних d-подуровней, после того, как произошло заполнение более высоких (с большим значением главного квантового числа) s- подуровней. Например, в четвертом периоде при переходе от кальция, имеющего конфигурацию внешней оболочки 4s2 , к скандию с конфигурацией 3d14s2 следующий электрон попадает не на 4рподуровень, а в соответствии с правилом Клечковского на d- подуровень с более низким значением главного квантового числа, равного 3. У всех следующих за скандием элементов до цинка (конфигурация 3d104s2) энергетически более выгодным становится заполнение 3d-подуровня; в наружном слое сохраняется 4s2 или в некоторых случаях 4s1. Таким образом, возможность нахождения вблизи ядра у 4s - электрона больше, чем у 3d - электрона. Энергии 4s и 3dорбиталей близки между собой, однако 4s - электроны несколько прочнее связаны с ядром, чем 3d - электроны.
83
В пятом периоде переходными являются металлы, начиная от иттрия и кончая кадмием. Порядок заполнения атомных орбиталей тот же, что и для элементов IV периода: по мере возрастания порядкового номера элемента добавляются d - электроны в предпоследний энергетический уровень, а в наружном слое сохраняется конфигурация 5s2, а у некоторых металлов 5 s1 (Nb 4d45s1, Mo 4d55s1 и др.).
В шестом периоде к переходным элементам относятся металлы от лантана до ртути: в этом ряду, за исключением лантаноидов, происходит заполнение d-электронами пятого энергетического уровня, в
наружном энергетическом слое сохраняется конфигурация 6s2, кроме Рt (5d9 6s1).
Элементы с порядковыи номерами 58 – 71 называются лантаноидами (f - элементы). У них по мере возрастания порядкового номера заполняется f - электронами энергетический уровень с n = 4, который достраивается до 18 – 32 электронов (максимального значения).
В седьмом периоде, незавершенном, к переходным элементам относятся элементы с порядковыми номерами 89, 104, 105 – актиний, курчатовий, нильсборий и элементы с порядковыми номерами 90 – 105 – актиноиды (f – элементы), у которых заполняется электронами энергетический уровень с n = 5.
Вопрос об устойчивости той или иной электронной конфигурации очень сложен, так как устойчивость конфигурации является функцией целого ряда факторов: взаимодействия электронов с ядром, электронного отталкивания, распределения электронов по энергетическим ячейкам. Так, например, устойчивой конфигурацией хрома оказывается 3d54s1, а не 3d44s2. Это связано с тем, что при переходе от d4 к d5 - конфигурации увеличивается число электронов с параллельными спинами, что приводит к большей устойчивости атома.
Закономерности изменения атомных радиусов
Атомные радиусы в горизонтальных рядах переходных металлов сравнительно незначительно уменьшаются, особенно в триадах элементов, входящих в VIII группу.
В В-группах при переходе от первого элемента ко второму происходит заметное возрастание радиуса атома, при переходе от второго к третьему – для некоторых элементов наблюдается даже не-
84
которое уменьшение. Причиной такой закономерности изменения радиусов атомов В-группах является лантаноидное сжатие (уменьшение радиусов атомов в ряду лантаноидов от 0,183 до 0, 174 нм).
Валентные состояния переходных металлов
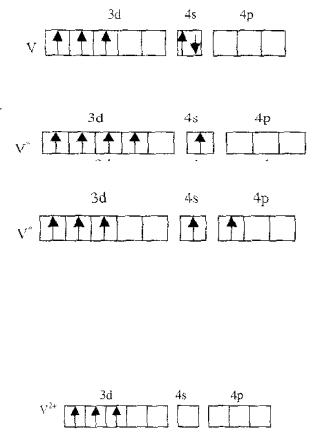
Переходные элементы отличаются от других тем, что их валентные электроны находятся на двух энергетических уровнях с близкими энергиями – (n – 1)d и ns. Этим объясняется характерное свойство переходных элементов – широкий набор валентных состояний. В образовании химической связи участвуют как s - электроны наружного энергетического уровня, так и d-электроны предпоследнего уровня. При этом может происходить не только отдача электронов, но и образование ковалентных связей за счет всех или части неспаренных электронов. Так, например, ванадий может использовать для образования связей все пять валентных электронов и образует соединения со степенями окисления +2, +3, +4, +5. В невозбужденном состоянии ванадий имеет следующее распределение валентных электронов по энергетическим ячейкам:
В возбужденном состоянии атома возможны электронные конфигурации
или
При таком распределении электронов по квантовым ячейкам возможно образование пяти ковалентных связей. Ион ванадия со степенью окисления +2, имея распределение электронов по квантовым ячейкам
85
может образовывать три ковалентные связи. За счет имеющихся свободных атомных орбиталей возможно образование донорноакцепторных связей.
Ионы переходных металлов с низкими степенями окисления существуют в виде катионов, которые в растворах сильно гидратиро-
ваны, например
[Ni(H2O)4]2+, [Cr(H2O)6]3+, [Cu(H2O)6]2+.
Энергия гидратации тем больше, чем больше заряд иона и меньше радиус. В промежуточных степенях окисления, если гидроокись амфотерна, существуют катионная и анионная формы, так, например, [Cr(H2O)6]3+, (Cr(OH)4]-. В высоких степенях окисления образуются оксикатионы типа ТiО2+ - титанил-ион, VO2+- ванадил-ион, в высоких степенях окисления или близких к ним – оксокoмплексы,
как, например, VO3-, CrO42-, MnO42-, MnO4-.
Переходные металлы могут достигать максимальной степени окисления, могут и не достигать. Не достигают максимальной степени окисления главным образом элементы восьмой группы (кроме Os
и Ru).
Для количественной характеристики устойчивости различных степеней окисления в растворах могут быть использованы стандартные окислительно-восстановительные потенциалы. Чем более электроположителен стандартный окислительно-восстановительный потенциал, тем менее устойчива данная степень окисления.
Переходные элементы, имеющие в соединениях максимальную степень окисления, проявляют сходство с элементами главных подгрупп: образуют соединения с одинаковым числом связей и сходные между собой по свойствам. Например: SO3 и CrO3, H2SO4 и H2CrO4, Cl2O7 и Mn2O7, HСlO4 и HMnO4, KClO4 и KMnO4.
Свойства оксидов переходных металлов
Свойства переходных элементов зависят главным образом от степени окисления. Изменение характера оксидов ПЭ можно проследить на примере высших оксидов IV периода:
Sc2O3 |
TiO2 |
V2O5, CrO3, Mn2O7 |
основный |
амфотерный |
кислотный |
86
Основные и амфотерные оксиды как правило, не взаимодействуют с водой, оксиды с кислотными свойствами взаимодействуют с водой, например
CrO3 + H2O = H2CrO4,
Mn2O7 + H2O = 2HMnO4.
Кислотно-основные свойства гидроокисей переходных металлов
При рассмотрении кислотно-основных свойств гидроокисей следует иметь в виду, что характер диссоциации зависит главным образом от заряда и радиуса элемента, образующего гидроокись. С увеличением степени окисления и уменьшением радиуса иона элемента, образующего гидроокись, у последнего нарастают кислотные свойст-
ва. Так, например, в ряду Mn(OH)2, Mn(OH)3, Mn(OH)4, H2MnO4, HMnO4 две первых гидроокиси проявляют основные свойства, Mn(OH)4 – амфотерные, а две последних – кислотные. В связи с наличием у переходных элементов различных степеней окисления и различной их устойчивости закономерность изменения кислотноосновных свойств гидроокисей в побочных В-подгруппах усложняется.
Элементы IВ – подгруппы группы могут проявлять степень окисления больше единицы (Cu+, Cu2+, Au3+). Гидроокись с устойчивой степенью окисления Cu(OH)2 является слабым основанием, Au(OH)3 – амфотерное соединение с преобладанием кислотных свойств.
Гидроокиси II B-подгруппы являются слабыми основаниями: Zn(OH)2 – амфотерное соединение, амфотерные свойства у Cd(OH)2 выражены слабее, a Hg(OH)2 амфотереные свойства не проявляет, неустойчива и распадается на HgO и H2O.
В III В-подгруппе изменение свойств более закономерно: Sc(OH)3 является слабым основанием с почти полностью отсутст-
вующими признаками амфотерности, а La(OH)3 |
уже сильное осно- |
вание. Увеличение радиусов атомов от Sc к La |
делает связь Э - О |
менее прочной, что приближает гидроокиси этой группы к гидроокисям II А-подгруппы. В ряду лантаноидов основные свойства гидроокисей уменьшаются, что является результатом лантаноидного сжатия.
87
Для элементов IV В-подгруппы (Ti, Zr, Hf) характерна степень окисления +4. Гидроокиси Э(ОН)4 амфотерны, их кислотные свойства при переходе от Ti к Hf ослабевают.
У элементов V В-подгруппы (V, Nb, Ta) характерной является степень окисления +5. Они образуют слабые кислоты с общей формулой НЭО3, их сила уменьшается от V к Ta.
Элементы VI В-подгруппы (Cr, Mo, W) образуют гидроокиси, отвечающие высшей степени окисления +6, имеют общую формулу Н2ЭО4 и являются кислотными. В ряду H2CrO4, H2MoO4, H2WO4 сила кислот уменьшается. В низких степенях окисления хрома Cr(OH)2 проявляет основные свойства, а Cr(OH)3 – амфотерные.
Элементы VI1 В-подгруппы имеют степени окисления от +2 до +7. Для марганца характерны степени окисления +2, +4, +6, +7. Им соответствуют гидроокиси Mn(OH)2, Mn(OH)4, H2MnO4, HMnO4. Mn(OH)2 – слабое основание, а Mn(OH)4 - амфотерное (легко разлагается на MnO2 и H2O ), H2MnO4 и HMnO4 - кислоты. Для Tc и Re наиболее характерна степень окисления +7, соответствующие им гидроокиси обладают кислотными свойствами.
Окислительно-восстановительные свойства соединений переходных элементов
Окислительно-восстановительные свойства соединений переходных элементов зависят от степени окисления элемента, образую-
щего соединение. Соединения, содержащие элемент с низшей степенью окисления (Ti2+, V2+, Cr2+, Mn2+, Fe2+ и др.), проявляют восстано-
вительные свойства, например, Cr(OH)2, Mn(OH)2, Fe(OH)2 легко окисляются на воздухе до Cr(OH)3, Mn(OH)4, Fe(OH)3. Соединения,
cодержащие элемент в высшей степени окисления, проявляют окислительные свойства, например NH4VO3 (V+5), K2Cr2O7 (Cr+6) , KMnO4
(Mn+7).
Для количественной характеристики окислительно-восстанови- тельных свойств соединений переходных элементов используют изо- барно-изотермические потенциалы, для растворов – окислительновосстановительные потенциалы. В таблице 9 приведены стандартные окислительно-восстановительные потенциалы для ПЭ четвертого периода.
88
Таблица 9 Стандартные окислительно-восстановительные
потенциалы переходных элементов четвертого периода
Система |
TiO2+/Ti3+ |
VO3-/VO2+ |
Cr2O7/Cr3+ |
MnO4-/Mn2+ |
Ео, В |
0,1 |
0,96 |
1,36 |
1,52 |
Увеличение окислительно-восстановительных потенциалов свидетельствует о нарастании окислительных свойств у соединений одного и того же ряда ПЭ. Стандартные окислительновосстановительные потенциалы растворов соединений ПЭ VII - группы приведены в табл. 10.
Таблица 10 Стандартные окислительно-восстановительные
потенциалы переходных элементов VII-подгруппы
Cистема |
|
|
Ео, В |
|
MnO4- + 5 e + 8 H+ = Mn2+ + |
1,52 |
|||
4H2O |
|
|
|
|
TcO - + 7e + 8H+ |
= Tc + 4H |
2 |
O |
-0,47 |
4 |
|
|
|
|
ReO4- + 7e + 8H+ |
= Re + 4H2O |
-0,36 |
||
У всех элементов В-подгрупп благодаря наличию вакантных атомных орбиталей очень сильно выражена способность к образованию комплексов. Комплексообразующие свойства проявляются тем сильнее, чем больше заряд и меньше радиус. Максимум способности к комплексообразованию совпадает с нахождением элементов в VIII B-подгруппе и примыкающих к ней d-элементов.
Если проанализировать закономерность изменения комплексообразующих свойств ПЭ в В-группах по вертикали, то она выражена менее отчетливо. В самой общей форме можно отметить, что для некоторых В-подгрупп наблюдается тенденция к увеличению способности к комплексообразованию с ростом атомного номера (Cu, Ag, Au, Zn, Cd, Hg, Cr, Mo, W, Mn, Tc, Re). Однако комплексообразую-
щие свойства ПЭ в значительной мере зависят от природы лиганда и степени окисления комплексообразователя.
Цель опыта: 1. Изучить кислотно-основные свойства оксидов и гидроксидов, окислительно-восстановительные и комплексообра-
89
зующие свойства ПЭ. 2. Научиться объяснять поведение ПЭ и их соединений, используя термодинамические характеристики.
Опыт 14.1. Кислотно-основные свойства оксидов и гидроокисей
а) Получение и свойства гидроокисей d-элементов с низкой степенью окисления.
Выполнение опыта. Возьмите по 2 мл растворов солей Mn(II), Fe(II),Ni(II), и Co(II) (раствор соли железа (II) готовится непосредственно перед опытом из сухой соли), прилейте по 1 мл 2М раствора щелочи. Отметьте цвет осадков. Разделите осадки на 2 части и испытайте их свойства. Запишите уравнения реакций всех происходящих процессов и сделайте соответствующий вывод о свойствах и характере гидроокисей d - элементов с низкой степенью окисления.
б) Получение и свойства гидроокисей d-элементов с промежуточной степенью окисления.
Выполнение опыта. Возьмите 2-3 мл раствора соли хрома (III), прибавьте по каплям раствор гидроокиси натрия до образования осадка. Полученный осадок разделите на две пробирки. Проделайте реакции, выявляющие свойства и характер полученного осадка гидроксида. Напишите уравнения происходящих реакций. Сделайте обобщающий вывод о возможных свойствах гидроокисей d- элементов с промежуточной степенью окисления.
в) Получение и свойства гидроокисей d-элементов с высшей степенью окисления.
Выполнение опыта. Насыпьте в пробирки порошки CrO3 и V2O5 (отдельно). Добавьте по 2-3 мл воды c помощью универсальной индикаторной бумаги определите pН полученных растворов. Составьте уравнения происходящих реакций. Сделайте вывод о характере и свойствах полученных соединений (оксидов и гидроокисей d- элементов с различной степенью окисления).
Опыт 14.2. Гидролиз солей d-элементов
Выполнение опыта. При помощи рН-метра определите рН растворов сернокислых солей железа (II) и (III), никеля (II), марганца (II). Какой вывод можно сделать о глубине протекания гидролиза в
90
