
- •Предисловие
- •Теоретическое введение
- •1.1. Историческая справка
- •1.2. Возникновение скачка потенциала на границе
- •1.4. Гальванические элементы
- •1.5. Измерение эдс гальванических элементов
- •1.6. Электродные потенциалы. Стандартный водородный
- •1.7. Термодинамика гальванического элемента
- •1.8. Типы обратимых электродов
- •1.9. Классификация электрохимических (гальванических)
- •1.10. Диффузионный потенциал
- •1.11. Применение метода эдс (потенциометрического метода)
- •1.12. Химическая поляризация
- •1.13. Концентрационная поляризация
- •1.14. Перенапряжение водорода
- •1.15. Теория водородного перенапряжения
- •2. Тест для проверки знаний по теме «эдс»
- •Оглавление
1.8. Типы обратимых электродов
Различают обратимые и необратимые электроды. При перемене направления электрического тока на обратимых электродах возникают реакции, противоположные по направлению, на необратимых – протекают реакции не обратные друг другу. Примером обратимого электрода служит медь в растворе, содержащем Сu2+ . При прохождении тока в противоположных направлениях идут реакции:
Сu – 2e → Сu2+ и Сu2+ + 2e → Сu.
К необратимым электродам относится, например, медь в растворе кислоты. Перемена направления тока приводит к реакциям:
Сu – 2e → Сu2+ и 2Н+ + 2е → Н2.
Из обратимых электродов составляются обратимые гальванические элементы.
Электроды в зависимости от устройства и типа электродной реакции делятся на электроды первого рода, второго рода и окислительно – восстаовительные ( или редокси – электроды).
Электроды первого рода – это электроды, в потенциалопределяющих реакциях которых принимает участие один вид ионов. К ним относятся металлические, амальгамные, газовые.
Металлические и амальгамные обратимы относительно катионов. Например,: Zn Zn2+; Cu Cu.2+; Аg Аg+.
ЦИНКОВЫЙ МЕДНЫЙ СЕРЕБРЯНЫЙ
В общем виде: Ме МеZ+; уравнение потенциалопределяющей реакции на электродах, обратимых относительно катионов:
Ме – ze → МеZ+.
Электродный потенциал согласно (14) и с учётом того, что активность чистого металла равна единице:
![]() (23)
(23)
Амальгамные электроды состоят из
амальгамы металла, находящейся в контакте
с раствором, содержащим ионы этого
металла. Например: (Hg) Cd
Cd2+,
уравнение потенциалопределяющей
реакции: (Hg) Cd – 2e → Cd2+
и формула электродного потенциала:
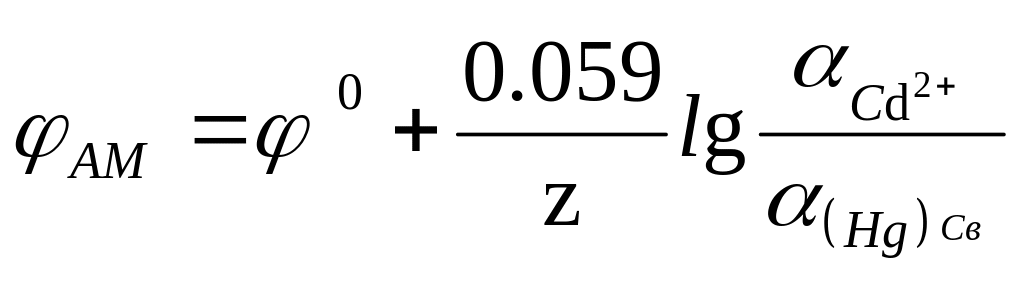 ,
(24)
,
(24)
где
![]() –
активность кадмия в амальгаме.
–
активность кадмия в амальгаме.
Газовые электроды могут быть обратимыми как относительно катиона ( например, водородный), так и относительно аниона (например, хлорный, кислородный).
Водородный электрод Pt, H2 H+ с электродной реакцией:1/2 H2 – е → Н+ и потенциалом водородного электрода согласно (14):
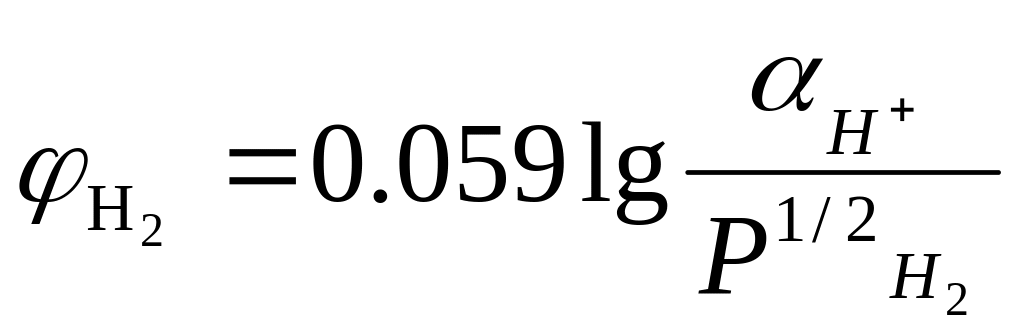 .
(25)
.
(25)
Стандартный потенциал водородного условно принят равным нулю (см. ранее).
Хлорный электрод Pt, Cl2 Cl- с электродной реакцией
Cl- – е → 1/2 Cl 2 и потенциалом хлорного электрода согласно (5):
или 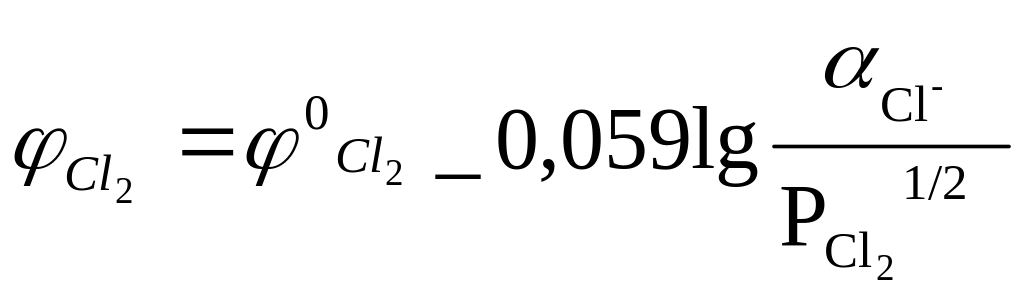 (26)
(26)
Кислородный электрод Pt, O2 OH- c электродной реакцией: 2 OH- – 2е → 1|2O2 + H2O и потенциалом кислородного электрода согласно (5):
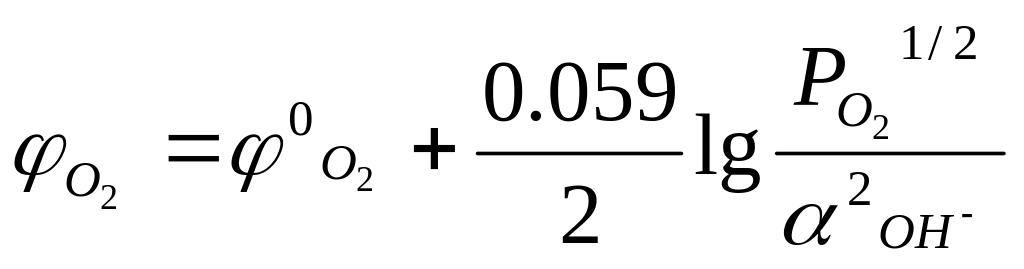 (27)
(27)
или
![]() .
(28)
.
(28)
Электроды второго рода - это электроды, в потенциалопределяющих реакциях которых принимает участие оба вида ионов, т.е. как катионы, так и анионы. Такие электроды состоят из трёх фаз: металл покрыт слоем его малорастворимой соли и погружён в раствор, содержащий анионы, одноимённые с анионами соли. Вследствие устойчивости потенциалов электроды второго рода могут быть использованы как электроды сравнения вместо стандартного водородного электрода при потенциометрических измерениях. Для этого наиболее употребительны каломельный и хлорсеребряный электроды.
Каломельный электрод состоит из ртути, покрытой пастой, содержащей каломель (Hg2Cl2), соприкасающейся С раствором хлорида калия: Hg, Hg2Cl2ТВ. KCl. Потенциалопределяющая реакция протекает в две стадии:
2Hg – 2e → Hg22+ ,
образовавшиеся ионы Hg22+ в растворе встречают ионы хлора и образуют осадок малорастворимой соли Hg2Cl2ТВ. :
Hg22+ + 2 Cl- → Hg2Cl2ТВ.
Суммарная реакция этих двух стадий имеет вид:
2Hg – 2e + 2 Cl- → Hg2Cl2ТВ.
Таким образом, в работе каломельного
электрода участвуют катионы и анионы.
Электродный потенциал согласно (5) имеет
вид:
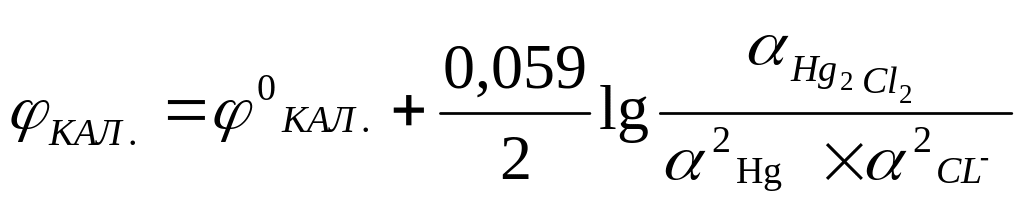 ,
учитывая, что активности чистых веществ
(
,
учитывая, что активности чистых веществ
(![]() )
равны единице, формула электродного
потенциала такова:
)
равны единице, формула электродного
потенциала такова:
![]() .
(29)
.
(29)
Хлорсеребряный электрод – это серебряная пластина, покрытая малорастворимой солью AgCl и погружённая в раствор KCl: Ag, AgClТВ. KCl. Электродный процесс, как и у каломельного электрода, протекает в две стадии. Cуммарная потенциалопределяющая реакция имеет вид:
Ag – e + Cl- → AgClТВ. ,
а формула электродного потенциала
согласно (16) и учётом того, что
![]() такова:
такова:
![]() (30)
(30)
Электроды третьего рода (редокси – электроды или окислительно – восстновительные) - это электроды, в потенциалопределяющих реакциях которых не принимают участия простые вещества (металлы, газы), т.е. все участники электродной реакции находятся в растворе, а инертный металл (например, платина) служит для отвода или подвода электронов.
Простым примером такого электрода может служить платина, опущенная в раствор, содержащий ионы Fe2+ и Fe3+, его вид: Pt Fe2+, Fe3+. Потенциалопределяющая реакция имеет вид: Fe2+– e → Fe3+,
а формула электродного потенциала согласно (5) такова:
![]() .
(31)
.
(31)
или в общем виде:
![]() .
(32)
.
(32)
Окислительно- восстановительные электроды могут быть составлены и на основе органических окислительно- восстановительных систем. Таких систем довольно много, но особый интерес представляет хингидронный электрод. Так называют платиновый электрод, погружённый в раствор хингидрона – это молекулярное соединение хинона и гидрохинона С6 Н4О2.
.С6 Н4(ОН)2, которое в растворе диссоциирует на хинон и гидрохинон
(С6 Н4)2О2 (ОН)2 ↔ С6 Н4О2 + С6 Н4(ОН)2.
Хингидрон хинон гидрохинон
Хинон, восстанавливаясь водородом, может присоединять последний, образуя гидрохинон. В свою очередь гидрохинон может окисляться, отдавая водород и превращаясь при этом в хинон
С6 Н4(ОН)2 ↔ С6 Н4О2 + Н2.
Равновесие этой реакции сильно сдвинуто в сторону образования гидрохинона. Если прибавить хингидрон к какому-либо раствору, то он, распавшись на хинон и гидрохинон, даёт раствор, содержащий окисленную (хинон) и восстановленную (гидрохинон) формы, которые, благодаря наличию платинового электрода, позволяют измерить окислительно-восстановительный потенциал такого раствора. Так как окисление-восстановление протекает с участием водорода, то окислительно- восстановительный потенциал раствора должен зависеть от концентрации ионов водорода. На поверхности платинового электрода Н2 ионизируется и устанавливается равновесие
Н2 − 2е ↔ 2Н+.
Общий процесс на электроде изображается так:
С6 Н4(ОН)2 ↔ С6 Н4О2 + Н2 − 2е ↔ С6 Н4О2 + 2Н+
или С6 Н4(ОН)2 − 2е ↔ С6 Н4О2 + 2Н+.
Следовательно, для потенциала такого электрода имеем выражение
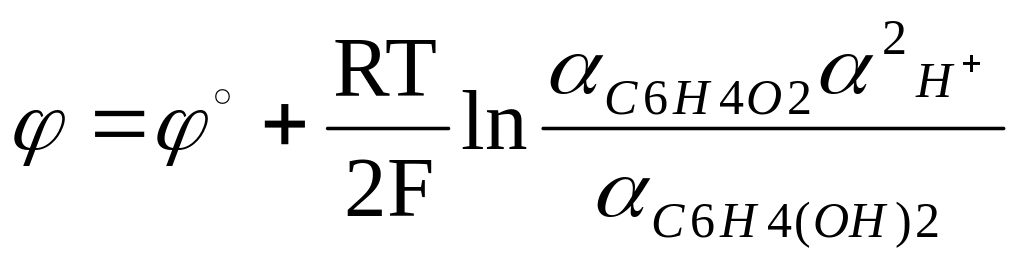 .
(33)
.
(33)
Это выражение можно переписать, выделив
ln
![]() в отдельный член
в отдельный член
![]() .
(34)
.
(34)
Если к водному раствору прибавлен в избытке малорастворимый хингидрон, диссоциирующий на молекулы С6 Н4О2 и С6 Н4(ОН)2, то
![]() и
и
![]() .
.
При этом второй член уравнения (26 )
обращается в нуль, и выражение для
потенциала приобретает вид:
![]() (35)
(35)
или при 298К
![]() (36)
(36)
Легко видеть, что уравнения ( 35 ) и (36)
совпадают с обычным выражением для
потенциала электрода, причём этот
потенциал зависит от активности ионов
водорода. Другими словами, хингидронный
электрод является своеобразным водородным
электродом. Но для него , в отличие от
стандартного водородногоэлектрода,
![]() .
Как показывают измерения,
.
Как показывают измерения,
![]() при
298 К.
при
298 К.
Используя раствор, для которого активность ионов водорода известна, получаем электрод с известным значением потенциала. Вместе с тем, хингидронный электрод может служить и для потенциометрического определения рН.
Хингидронный электрод легко приготовляется и удобен в работе. Но хингидронным электродом нельзя пользоваться в щелочной среде. Это объясняется тем, что гидрохинон является слабой кислотой; в щелочном растворе он сильно диссоциирует, и концентрация его в насыщенном растворе не является постоянной. Хингидронный электрод нельзя использовать также в присутствии сильных окислителей и восстановителей.
Стеклянный электрод является важнейшим среди ионообменных (ионоселективных) электродов. Он представляет собой тонкую мембрану из специального стекла, в котором повышено содержание щелочных составляющих – соединений натрия, лития и др. Стекло представляет собой переохлаждённую жидкость – раствор различных силикатов. В наиболее простом случае это соль, состоящая из , как указывалось щелочных металлов и анионов SiO32-. Вода, смачивающая стекло, адсорбируется его поверхностью, гидратируя анионы кремневой кислоты. При погружении стекла в достаточно концентрированный раствор катионы водорода, благодаря их большой подвижности малым размерам, внедряются в поверхность стекла, обмениваясь с катионами щелочного металла. Если обработать таким образом тонкую стеклянную мембрану, выдержав её в кислоте достаточно долго, чтобы катионы водорода проникли в неё на заметную глубину, то такую мембрану можно рассматривать как «насыщенную» катионами водорода. Потенциалопределяющий процесс на границе раствор – стекло и заключается в таком обмене между ионами щелочного металла, например Na+, содержащимися в стекле, и ионами Н+, находящимися в растворе:
Na+с + Н+р = Na+р + Н+с
При разделении стеклянной мембраной, обработанной указанным способом, двух растворов кислоты с различной концентрацией катионов водорода, но более разбавленных, чем раствор , в котором происходило насыщение стекла Н+ , на поверхности мембраны возникнут скачки потенциала, зависящие от рН растворов. Придя в соприкосновение с более разбавленным раствором кислоты, стекло начнёт отдавать катионы водорода, что вызовет возникновение положительного заряда у поверхности раствора и отрицательного заряда на самом стекле за счёт избытка анионов кремневой кислоты.
П усть
усть
![]() и
и
![]() - проекции поверхностей стеклянной
мембраны (рис. 4). Раствор
- проекции поверхностей стеклянной
мембраны (рис. 4). Раствор
![]() (слева) имеет активность катионов
водорода
(слева) имеет активность катионов
водорода
![]() ,
а раствор
,
а раствор
![]() (справа) -
(справа) -
![]() .
Положим, например, что
>
.
В таком случае вероятность выхода в
раствор катионов Н+ с поверхности
меньше, чем с
,
что выражено на рис. 6 различной
концентрацией значков (−) на этих
поверхностях.
.
Положим, например, что
>
.
В таком случае вероятность выхода в
раствор катионов Н+ с поверхности
меньше, чем с
,
что выражено на рис. 6 различной
концентрацией значков (−) на этих
поверхностях.
Рис. 4. Схема возникновения скачка потенциала на двух поверхностях стеклянной мембраны
Работу перехода1 г-иона Н+ из мембраны стекла в раствор или обратно нужно рассматривать как работу электрическую, так как катионы водорода переносят электрические заряды. Возникновение отрицательно заряженной поверхности стекла (за счёт покинувших её катионов Н+ ) и положительно заряженного раствора непосредственно около этой поверхности (за счёт вышедших в раствор катионов Н+ ) приводит к образованию двойного электрического слоя на каждой поверхности мембраны. Процесс идёт до установления равновесия, причём факторами, определяющими это равновесие, являются: активности катионов Н+ и возникший скачок потенциала. Из всего сказанного следует, что стеклянный электрод имеет потенциал, зависящий только от активности ионов водорода:
![]() ,
(37)
,
(37)
где
![]() - это потенциал асимметрии, вызванный
тем, что поверхности стеклянной мембраны
различны по свойствам, обусловленным
главным образом механической, термической
обработкой в процессе изготовления
электрода.
- это потенциал асимметрии, вызванный
тем, что поверхности стеклянной мембраны
различны по свойствам, обусловленным
главным образом механической, термической
обработкой в процессе изготовления
электрода.
