
- •Предисловие
- •Теоретическое введение
- •1.1. Историческая справка
- •1.2. Возникновение скачка потенциала на границе
- •1.4. Гальванические элементы
- •1.5. Измерение эдс гальванических элементов
- •1.6. Электродные потенциалы. Стандартный водородный
- •1.7. Термодинамика гальванического элемента
- •1.8. Типы обратимых электродов
- •1.9. Классификация электрохимических (гальванических)
- •1.10. Диффузионный потенциал
- •1.11. Применение метода эдс (потенциометрического метода)
- •1.12. Химическая поляризация
- •1.13. Концентрационная поляризация
- •1.14. Перенапряжение водорода
- •1.15. Теория водородного перенапряжения
- •2. Тест для проверки знаний по теме «эдс»
- •Оглавление
1.2. Возникновение скачка потенциала на границе
металл – раствор
Существует тесная взаимосвязь электрохимических и химических явлений, при которых происходит взаимопревращение электрической и химической форм энергии. Устройство для получения электрического тока за счёт химической реакции называется электрохимическим (гальваническим) элементом. Простейший электрохимический элемент состоит из двух полуэлементов (электродов) – металлических или полупроводниковых пластин (проводников 1 рода), которые помещены в растворы или расплавы электролитов (проводники 11 рода). Полуэлементы (электроды) пространственно отделены друг от друга и соединены между собой проводником 1 рода. Растворы электролитов соединяются между собой проводником 11 рода.
К электрохимическим, или гальваническим, элементам относятся системы, в которых химическая энергия определённого физико-химического процесса превращается в полезную электрическую работу. Обратный процесс – химическое превращение, на возбуждение и поддержание которого расходуется электрическая энергия, - происходит в электролизёрах, или электролитических ячейках.
Для того чтобы выяснить механизм образования электрической энергии в гальваническом элементе, необходимо остановиться на причинах разности потенциалов между металлом и раствором. Допустим, что металл Ме погружён в раствор, содержащий его гидратированные ионы Меz+. nH2O. Металлы состоят из положительно заряженных ионов, расположенных в узлах кристаллической решётке и относительно свободных электронов (электронный газ). Ионы металла в решётке совершают колебательные движения, при достаточной амплитуде которых они могут оторваться от кристалла. На рис. 1(а) схематически изображена зависимость потенциальной энергии иона металла от его расстояния до поверхности металла х. Точка b соответствует энергии иона, находящегося на поверхности металла (штриховая линия mm1). Отрезок ab показывает резкое возрастание энергии иона при его «вдавливании внутрь решётки (сближение с другими ионами). Отрезок bcd характеризует увеличение энергии иона по мере его удаления от поверхности металла. Для полного отрыва иона необходима дополнительная энергия активации W0. Она весьма велика, поэтому испарение иона в вакууме – маловероятный процесс. Однако отрыв иона от кристалла значительно облегчается при переносе металла в раствор. Вследствие гидратации иона энергия резко уменьшается и в растворе имеет значение, соответствующее точке e на рис. 1(а):
Ме – ze + nH2O → Меz+. nH2O
Поэтому для отрыва от поверхности металла постепенно гидратирующегося иона необходимо преодолеть значительно меньший потенциальный барьер W1. Дальнейшее увеличение расстояния х от поверхности металла снова вызывает увеличение энергии иона (ef соответствует уменьшению расстояния между ионами и молекулами гидратной оболочки по сравнению с их значением в равновесном гидратном комплексе). Возможен и обратный процесс потери ионом гидратной оболочки осаждения его на поверхности металла. Однако он требует преодоление большего энергетического барьера W2 > W1, а поэтому идёт с меньшей скоростью, чем процесс отрыва ионов от металла (процесс окисления металла):
Меz+. nH2O + ze → Ме + nH2O.

Рис. 1. К механизму возникновения электродного потенциала
a) –активные металлы; б) –инетные металлы
По мере перехода ионов металла в раствор условия постепенно изменяются, так как металл приобретает отрицательный заряд вследствие избытка электронов на его поверхности. В связи с этим энергия ионов на его поверхности уменьшается от b до b'.
Соответственно возрастает от W1 до W1' потенциальный барьер, который необходимо преодолеть для перевода иона в раствор, и постепенно уменьшается скорость этого процесса. Количество ионов в растворе вблизи электрода, наоборот, возрастает, и их энергия постепенно увеличивается от е до е' вследствие электростатического отталкивания одноимённых зарядов, поэтому потенциальный барьер для разряда ионов уменьшается. Наконец наступает такое состояние, при котором потенциальные барьеры отрыва и разряда ионов становятся одинаковыми (W1 = W2). Одинаковыми становятся скорости обоих процессов, т. е. наступает равновесие:
Ме – ze + nH2O ↔ Меz+. nH2O
При этом металл заряжается относительно раствора отрицательно, а в растворе накапливается избыток катионов, которые электростатическими силами удерживаются в непосредственной близости от поверхности металла, образуя внешнюю обкладку двойного электрического слоя, напоминающего плоский конденсатор.
Таков механизм возникновения скачка потенциала на границе раздела между активными металлами и растворами их солей. Аналогично можно показать, что, если энергия гидратированного иона в растворе выше, чем на поверхности металла (например, для малоактивных металлов), скорость разряда ионов первоначально больше скорости их перехода из металла в раствор. Металл тогда заряжается относительно раствора положительно, а вблизи его поверхности накапливаются избыточные анионы. По мере увеличения положительного заряда металла скорость разряда ионов уменьшается, возрастает скорость их перехода в раствор и в конце концов снова наступает состояние равновесия. В образующемся двойном электрическом слое металл заряжается положительно, а во внешней обкладке накапливаются отрицательные ионы. Этот случай схематически изображён на рис 1 (б). Равновесный потенциал, возникающий между металлом и раствором, определяет работу, которую мог бы дать процесс окисления металла, если бы протекал обратимо. Образование двойного электрического слоя (т.е. равновесной разности потенциалов между металлом и раствором) защищает металл от дальнейшего окисления (перехода в ионы) или, наоборот, препятствует восстановлению ионов из раствора. Итак, скачок потенциала на границе раздела металл – раствор электролита возникает вследствие обмена катионами между соприкасающимися фазами.
1.3. Строение двойного электрического слоя на границе
металл – раствор
Двойной электрический слой на границе металл – раствор создаётся зарядами, находящимися на металле, и ионами противоположного знака (противоионами), ориентированными у поверхности металла. В формировании двойного электрического слоя принимают участие как электростатические силы, под влиянием которых противоионы подходят к поверхности металла, так и силы теплового(молекулярного) движения , в результате действия которых двойной электрический слой приобретает размытое диффузное строение. Кроме того, в создании двойного электрического слоя на границе металл – раствор существенную роль играет эффект специфической адсорбции поверхностно-активных ионов и молекул, которые могут содержаться в электролите.
Под строением двойного слоя понимают распределение зарядов в его ионной обкладке. Упрощённо ионную обкладку можно условно разделить на две части: 1) плотную, или слой Гельмгольца, образованную ионами, практически вплотную подошедшими к металлу; 2) диффузную, слой Гюи, созданную ионами, находящимися на расстоянии от металла, превышающих радиус гидратированного иона (рис.2, I). Толщина плотной части порядка 10-8 см, диффузной – 10-7 – 10-3 см.
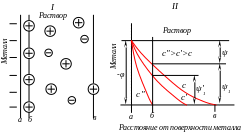
Рис. 2. Строение двойного электрического слоя (I) на границе металл – раствор и распределение потенциала в ионной обкладке при различной концентрации раствора (II); аб-плотная часть; бв-диффузная часть; φ-разность потенциалов между раствором и металлом; ψ, ψ, -падение потенциала в плотной и диффузной частях двойного электрического слоя, х- расстояние от поверхности металла
Распределение потенциала в ионной обкладке двойного электрического слоя представлено на рис.2, II. Величина скачка потенциала на границе металл – раствор складывается из падения потенциала Ψ в плотной части двойного слоя и падения потенциала Ψ1 в диффузной. Строение двойного электрического слоя определяется общей концентрацией с раствора. С её увеличением процессы, способствующие формированию диффузной части, ослабляются, размеры её уменьшаются, двойной слой сжимается, что приводит к изменению Ψ1-потенциала (рис.2, I I). В концентрированных растворах диффузная часть практически отсутствует, и двойной электрической слой подобен плоскому конденсатору, что соответствует модели Гельмгольца, впервые предложившего теорию строения двойного электрического слоя в1853 году.
Итак, в формировании ионной обкладки двойного слоя принимают участие как электростатические силы, под влиянием которых противоионы подходят к поверхности электрода, так и силы теплового (молекулярного) движения, в результате действия которых двойной слой приобретает размытое диффузное строение. Кроме того, в создании двойного электрического слоя на границе металл – раствор существенную роль играет эффект специфической адсорбции поверхностно-активных ионов и молекул, которые могут содержаться в электролите.
