
- •Введение
- •1. Спектральные и оптические методы анализа
- •1.1. Эмиссионный спектральный анализ. Фотометрия пламени
- •Контрольные вопросы
- •1.2. Молекулярно-абсорбционный анализ
- •Контрольные вопросы
- •1.3. Дифференциальная фотометрия
- •Контрольные вопросы
- •1.4. Фотометрическое титрование
- •Контрольные вопросы
- •1.5. Кинетический метод анализа
- •Контрольные вопросы
- •1.6. Фотометрия светорассеивающих систем
- •Контрольные вопросы
- •1.7. Люминесцентный анализ
- •Контрольные вопросы
- •1.8. Рефрактометрический метод анализа
- •Контрольные вопросы
- •1.9. Метрологические характеристики и статистическая обработка результатов анализа
- •2. Электрохимические методы анализа
- •2.1. Электрогравиметрия
- •Контрольные вопросы
- •2.2. Потенциометрия
- •Контрольные вопросы
- •2.3. Кондуктометрия
- •Контрольные вопросы
- •2.4. Полярографический анализ
- •Контрольные вопросы
- •2.5. Амперометрическое титрование
- •Контрольные вопросы
- •3. Хроматографические методы
- •3.1. Характеристика основных конструктивных узлов (блоков) хроматографа
- •3.2. Принцип работы газового хроматографа на примере chrom 5
- •3.3. Генератор водорода. Устройство и принцип работы
- •3.4. Методика выполнения работы Отбор пробы
- •Подготовка хроматографов к выполнению измерения
- •Выполнение измерений
- •Вычисление результатов анализа
- •3.5. Методы расчета хроматограмм
- •3.6. Методы расчета концентраций
- •Контрольные вопросы
- •4. Титриметрические методы анализа
- •Правила титрования
- •4.1. Кислотно-основное титрование в водном растворе
- •Контрольные вопросы
- •4.2. Осадительное титрование
- •Контрольные вопросы
- •4.3. Методы комплексообразования. Комплексонометрическое титрование
- •Контрольные вопросы
- •4.4. Окислительно-восстановительное титрование
- •Контрольные вопросы
- •Заключение
- •Библиографический список
- •Оглавление
- •394026 Воронеж, Московский просп., 14
Контрольные вопросы
1. Какие реакции лежат в основе метода осаждения? Какие требования к ним предъявляются? Классификация методов осаждения.
2. Какие типы индикаторов применяются в осадительном титровании? Какие реакции лежат в основе метода Мора, Фаянса, Фольгарда?
3. На чем основано применение хромата калия в качестве индикатора при титровании хлоридов раствором нитрата серебра? Почему нельзя проводить количественное определение по методу Мора) в кислой среде, б) в щелочной среде?
4. На чем основано применение железоаммонийных квасцов в качестве индикатора?
5. Каков механизм действия адсорбционных индикаторов в аргентометрии? Какие вещества применяются в качестве адсорбционных индикаторов?
6. Как можно приготовить титрованные растворы аргентометрического метода?
7. В чем сущность тиоцианометрического (роданометрического) метода определения серебра и галогенидов? Какие реакции лежат в основе этого метода?
8. Какие реакции положены в основу меркурометрического метода?
9. В каких координатах целесообразно строить кривые осадительного титрования? От каких факторов зависит величина скачка на кривой осадительного титрования?
4.3. Методы комплексообразования. Комплексонометрическое титрование
Методы комплексообразования основаны на реакциях, в результате которых между катионами и анионами образуются комплексные ионы:
Аg+ + 2 CN [Аg(CN)2]
Нg2+ + 4 I [НgI4]2
Комплексы, полученные в результате этих реакций, должны быть устойчивыми. Устойчивость комплексов определяется константой нестойкости или константой устойчивости (константой образования – ):
Кн. [Аg(CN)2]- = [Ag+ ]·[CN]2 / [Аg(CN)2] =1,0·1021
Кн. [НgI4]2- = [Hg2+ ]·[I]4 / [HgI42] = 1,38·1030
Куст. [Аg(CN)2]- = [Аg(CN)2] / [Ag+ ]·[CN]2 =1,0·1021 =
Куст. [НgI4]2- = [HgI42] / [Hg2+ ]·[I]4 / [HgI42] = 7,25·1029 =
Чем меньше константа нестойкости или чем больше константа устойчивости, тем более устойчивый комплексный ион образуется и тем больше вероятность применения его в объемном анализе. При титровании концентрация титруемых ионов постепенно уменьшается, а концентрация реагирующих с ними ионов рабочего раствора постепенно увеличивается. Если реакция идет в несколько стадий, то на кривой титрования будет несколько ступеней. Для определения точки эквивалентности применяют индикаторы, которые дают либо окрашенные, либо нерастворимые соединения с определяемым веществом. Причем эти соединения индикатора должны быть менее прочными, чем соединения, получаемые по основной реакции титрования.
В настоящее время наиболее широко применяется метод комплексонометрии, основанный на реакциях, осуществляемых с помощью комплексонов.
Метод комплексонометрии. Метод комплексонометрии основан на реакциях, которые сопровождаются образованием комплексных соединений катионов с органическими реактивами – комплексонами. При этом образуются комплексные соединения, которые называют внутрикомплексными или хелатными комплексными соединениями.
Комплексонами называют органические соединения, представляющие собой производные аминополикарбоновых кислот.
Например: нитрилотриуксусная кислота (НТАилиН3Y) – комплексон I
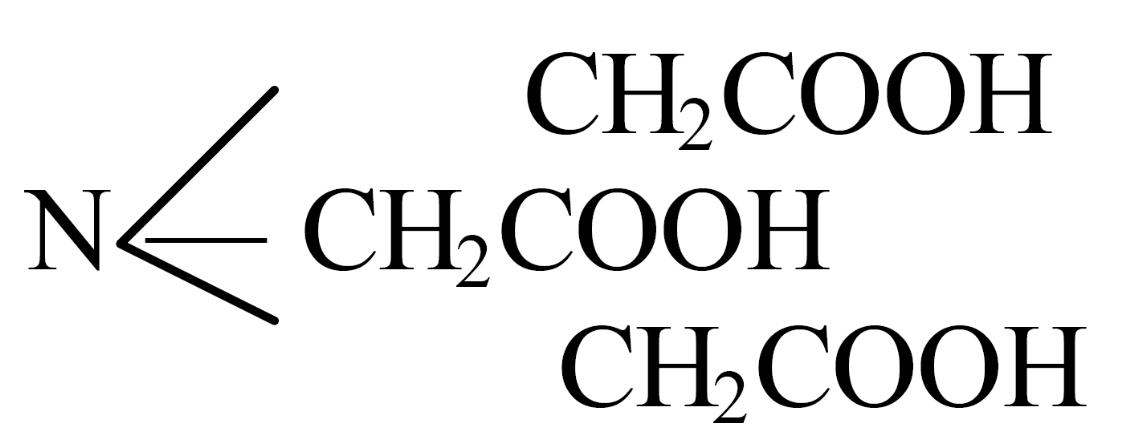
Этилендиаминтетрауксусная кислота (ЭДТУКилиН4Y) – комплексон II
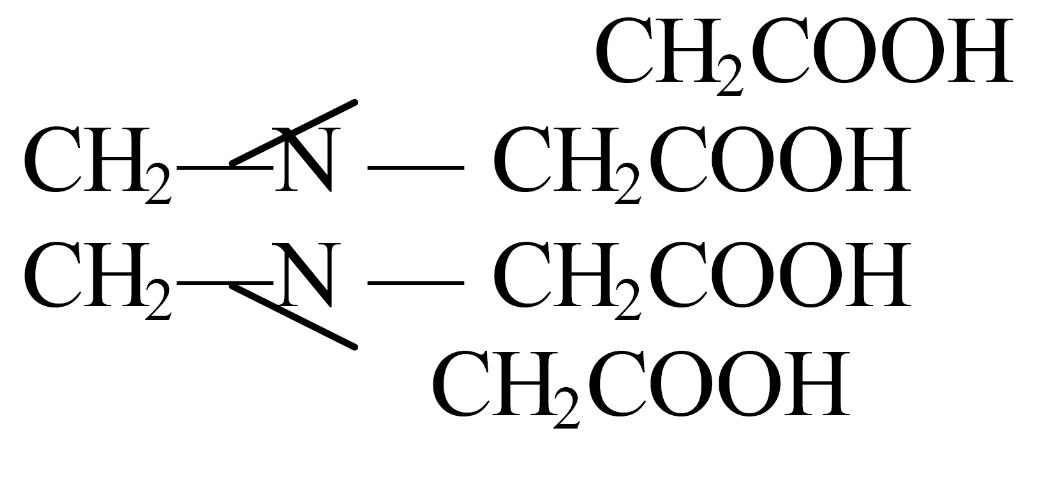
На практике наиболее часто применяют двунатриевую соль этилендиаминтетрауксусной кислоты – комплексон III или трилон Б (Nа-ЭДТА или ЭДТА, сокращенно Nа2Н2Y), в связи с хорошей растворимостью соли в воде:
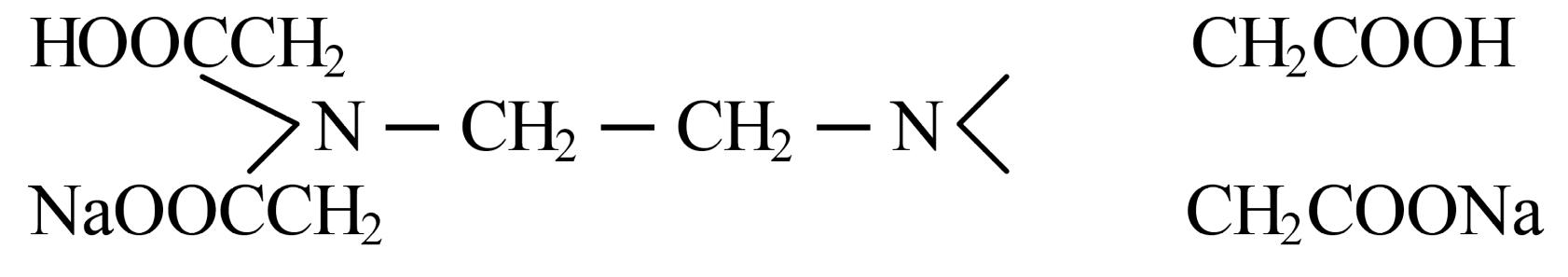
ЭДТА образует со многими катионами металлов устойчивые малодиссоциированные растворимые в воде внутрикомплексные соли.
В комплексах часть связей носит ионный характер, часть – донорно-акцепторный. Трилон Б с ионами металлов любого заряда образует четырех-пяти или шестикоординационный комплекс с пятичленными циклами.
Атом металла находится в окружении атомов кислорода и атомов азота, находящихся в цис-положении.
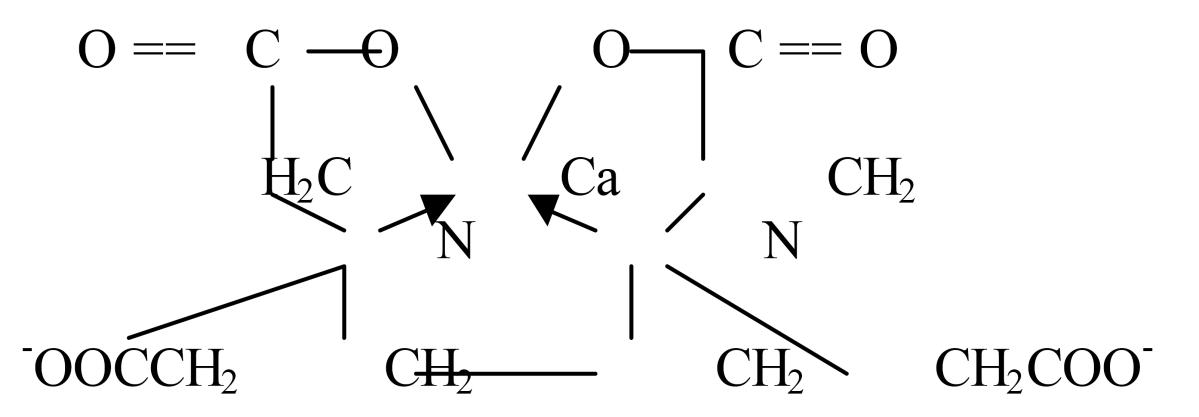
Устойчивость комплексов с ЭДТА возрастает с увеличением заряда центрального иона, поэтому однозарядные катионы коплексонометрически в водных растворах не определяют.
Метод, в котором используют трилон Б, называют трилонометрией. Трилонометрический метод анализа основан на мгновенном образовании малодиссоциированных комплексных соединений различных катионов с трилоном Б. Трилон Б представляет собой белый растворимый в воде порошок.
Растворы трилона Б очень устойчивы, поэтому можно применять довольно разбавленные растворы (до 0,0001 М). В водном растворе трилон Б диссоциирует и имеет кислую реакцию.
Nа2Н2Y = 2 Nа+ + Н2Y2
В реакциях комплексообразования реакции между трилоном Б и ионами металлов протекают стехиометрически в соотношении 1:1. Следовательно, молярная масса эквивалента ЭДТА и определяемого иона металла равны их молярным массам. При титровании ЭДТА солей металлов-комплексообразователей протекают следующие реакции:
М2+ + Н2Y2 МY2 + 2 Н+
М3+ + Н2Y2 МY + 2 Н+
М4+ + Н2Y2 МY + 2 Н+
Из приведенных реакций следует, что на 1 моль ионов металла, независимо от степени окисления металла, идет 1 моль трилона Б и освобождается 2 моль ионов водорода. Образующиеся комплексные соединения различаются лишь по заряду. Ионы водорода понижают рН раствора, в результате повышения кислотности среды требуемого комплексного соединения может не получиться. Поэтому титрование проводят в буферном растворе, поддерживающем определенное значение рН. Все это позволяет использовать ЭДТА для титриметрического определения солей металлов.
Индикаторы комплексонометрического титрования. Для определения точки эквивалентности при комплексонометрическом титровании часто используют металл-индикаторы, представляющие собой органические красители, образующие с катионами определяемых металлов растворимые в воде окрашенные комплексы.
М2+ + 2 НInd МInd2 + 2 Н+
Цвет 1 Цвет 2
Эти комплексные соединения менее устойчивы, чем внутрикомплексные соли, которые образуются при титровании раствора катиона комплексонами.
МInd2 + Н2Y2 МY2 + 2 НInd
Цвет 2 Цвет 1
В точке эквивалентности комплексное соединение индикатора и металла разрушается, индикатор выделяется в свободном виде, а определяемый катион образует комплексное соединение с комплексоном. Окраска комплексного соединения индикатора и катиона отличается от окраски свободного индикатора, поэтому в точке эквивалентности происходит изменение окраски титруемого раствора.
Процесс образования комплекса между металлом и индикатором характеризуется константой устойчивости:
М + Ind МInd
Кобр. = = [МInd] / [М]·[Ind]; [М]·= [МInd] / ·[Ind];
Заметное изменение цвета раствора происходит при равенстве концентраций [МInd] = [Ind], тогда:
[М] = 1 / ; рМ = lg Ind;
Интервал перехода индикатора устанавливается при изменении соотношения [МInd] / [Ind] от 1/10 до 10/1 и будет равен:
рМ = lg ± 1
Наиболее широкое применение в комплексонометрии имеет хромоген черный. В зависимости от рН раствора существуют три окрашенные формы этого красителя. При рН < 6 раствор имеет винно-красный цвет, при рН = 7 - 11 – синий цвет, при рН > 11,5 – желто-оранжевый цвет. В слабо щелочном растворе хромоген черный образует с ионами магния, цинка и некоторыми другими катионами интенсивно окрашенные винно-красные комплексы. При рН 8-10 переход окраски индикатора из винно-красной в синюю окраску проявляется наиболее отчетливо.
Устойчивость комплексов металлов с ЭДТА зависит от иона металла, его заряда и от рН среды. Наиболее устойчивые комплексы образуются с многозарядными комплексами р-и d-элементов. Наименее устойчивые комплексы образуют s-элементы.
Титрование ЭДТА проводится при строго определенных условиях, из которых большое значение имеет рН титруемого раствора. В сильно кислых растворах образуются менее устойчивые комплексные соединения, а в сильно щелочных растворах образуются осадки гидроксидов металлов определяемых катионов. Поэтому для поддержания рН на определенном уровне титрование проводят в присутствии буферного раствора, отвечающего определенному значению рН. Титрование большинства катионов проводят в аммиачной буферной среде при рН = 8 – 9. Иногда наряду с буферным раствором добавляют вспомогательный комплексообразователь, например тартрат натрия, триэтиламин, цитрат и ацетатнатрия.
Методы комплексонометрического титрования. Комплексонометрическое титрование может быть выполнено различными методами:
а) методом прямого титрования – определяемый металл оттитровывают эквивалентным количеством ЭДТА:
М2+ + Н2Y2 = [МY]2 + 2 Н+
(1/z* 2+) = (1/z*ЭДТА)
б) методом обратного титрования – добавляют избыток комплексона и оттитровываютего сульфатом магния или цинка:
М2+ + Н2Y2(избыток) = [МY]2 + 2 Н+
Н2Y2 + Zn2+ = [ZnY] 2 + 2 Н+
(1/z* М2+) = (1/z*ЭДТА) - (1/z* Zn2+)
в) методом заместительного титрования – к определяемому иону металла добавляют раствор относительно малоустойчивого комплексоната магния и оттитровывают выделившийся магний раствором ЭДТА:
М2+ + [МgY]2 = [МY]2 + Mg2+
Mg2+ + Н2Y2 = [МgY]2- + 2 Н+
(1/z* Ме2+) = (1/z*[МgY]2 ) = (1/z*ЭДТА)
Некоторые металлы (Со, Ni, Cu, А1) образуют слишком прочные комплексы с индикатором, окраска раствора изменяется необратимо. Поэтому данные металлы титруют в присутствии другого индикатора или используют метод обратного титрования. К раствору прибавляют определенное количество трилона Б, избыток которого тируют раствором соли магния или цинка.
Метод обратного титрования применяют и в том случае, если металлы (Рb, Нg, In и др.) образуют слабо окрашенные комплексы с ЭДТА.
Процесс титрования может быть охарактеризован кривой титрования, построенной в координатах: рМ – V, где рМ – взятый с обратным знаком логарифм концентрации ионов металла Мn+ , V – объем титранта. Скачок титрования на кривой титрования зависит от устойчивости комплексного соединения ив значительной степени зависит от рН среды.
