
- •Введение
- •1. Спектральные и оптические методы анализа
- •1.1. Эмиссионный спектральный анализ. Фотометрия пламени
- •Контрольные вопросы
- •1.2. Молекулярно-абсорбционный анализ
- •Контрольные вопросы
- •1.3. Дифференциальная фотометрия
- •Контрольные вопросы
- •1.4. Фотометрическое титрование
- •Контрольные вопросы
- •1.5. Кинетический метод анализа
- •Контрольные вопросы
- •1.6. Фотометрия светорассеивающих систем
- •Контрольные вопросы
- •1.7. Люминесцентный анализ
- •Контрольные вопросы
- •1.8. Рефрактометрический метод анализа
- •Контрольные вопросы
- •1.9. Метрологические характеристики и статистическая обработка результатов анализа
- •2. Электрохимические методы анализа
- •2.1. Электрогравиметрия
- •Контрольные вопросы
- •2.2. Потенциометрия
- •Контрольные вопросы
- •2.3. Кондуктометрия
- •Контрольные вопросы
- •2.4. Полярографический анализ
- •Контрольные вопросы
- •2.5. Амперометрическое титрование
- •Контрольные вопросы
- •3. Хроматографические методы
- •3.1. Характеристика основных конструктивных узлов (блоков) хроматографа
- •3.2. Принцип работы газового хроматографа на примере chrom 5
- •3.3. Генератор водорода. Устройство и принцип работы
- •3.4. Методика выполнения работы Отбор пробы
- •Подготовка хроматографов к выполнению измерения
- •Выполнение измерений
- •Вычисление результатов анализа
- •3.5. Методы расчета хроматограмм
- •3.6. Методы расчета концентраций
- •Контрольные вопросы
- •4. Титриметрические методы анализа
- •Правила титрования
- •4.1. Кислотно-основное титрование в водном растворе
- •Контрольные вопросы
- •4.2. Осадительное титрование
- •Контрольные вопросы
- •4.3. Методы комплексообразования. Комплексонометрическое титрование
- •Контрольные вопросы
- •4.4. Окислительно-восстановительное титрование
- •Контрольные вопросы
- •Заключение
- •Библиографический список
- •Оглавление
- •394026 Воронеж, Московский просп., 14
Контрольные вопросы
1. Для решения каких аналитических задач применяют ртутный капающий электрод и твердый вращающийся (Рt, Аu, С) электрод в вольтамперометрии?
2. Объяснить ход постояннотоковой полярограммы; какими процессами обусловлены ее участки?
3. Какую природу имеют миграционный ток (iм), конденсаторный ток (iк), предельный ток (iД)? Какова их роль в полярографическом анализе?
4. Какова роль фона и какие требования к нему предъявляют?
5. С какой целью и в каких случаях продувают азот через анализируемый раствор перед полярографированием?
6. Зачем и в каком методе добавляют поверхностно-активные вещества в полярографируемый раствор?
7. Что является мерой обратимости электрохимической реакции на индикаторном электроде? Как влияет обратимость на результат полярографического анализа?
8. Как осуществляют качественный анализ в полярографии? Какие варианты количественного анализа вам известны?
2.5. Амперометрическое титрование
Аликвотную часть анализируемого раствора помешают в электролизер, снабженный вращающимся платиновым и хлорсеребряным электродами. Между электродами устанавливают напряжение, необходимое для разрядки одного из ионов и титруют подходящим стандартным раствором. Одно из реагирующих веществ должно обязательно участвовать в окислительно-восстановителъных процессах на индикаторном электроде.
Различают титрование по току определяемого вещества (рис. 19, кривая 1), по току и титранта я определяемого вещества (рис. 19, кривая 3). В процессе титрования изменяется сила тока, ее регистрируют гальванометром, или ячейку подключают к самописцу, который вычерчивает кривую зависимости силы тока от объема прилитого титранта.
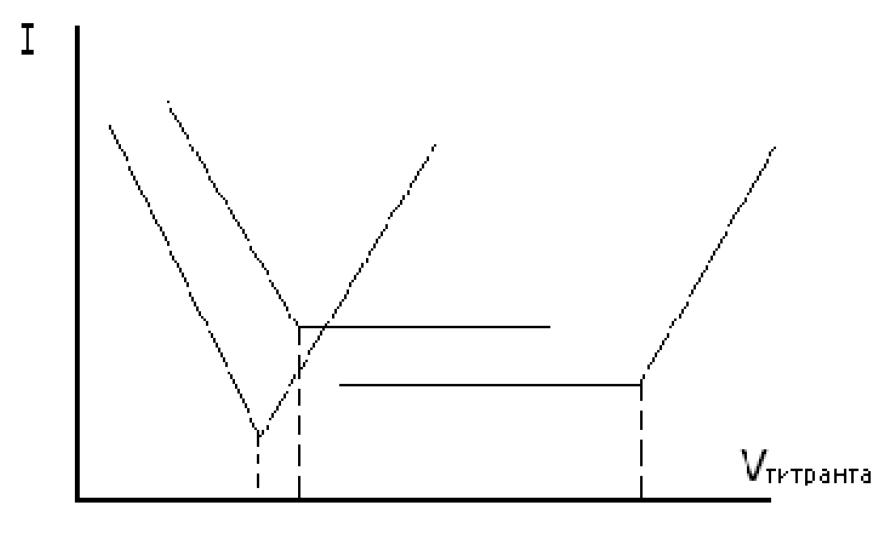
Рис. 19. Кривые амперометрического титрования
По перегибу кривой определяют точку эквивалентности и объем стандартного раствора, пошедшего на титрование.
Пример. Амперометрическое определение кадмия
Титрование проводят по току титранта. В качестве стандартного раствора используют 0,03 М раствор гексацианоферрата (II) калия. Его заливают в напорную емкость (сосуд Мариотта), которую устанавливают над ячейкой. Вместо обычного наконечника используют капилляр. Зажимом регулируют скорость вытекания раствора.
1. Определяют скорость вытекания стандартного раствора из капилляра (необходимо удалить пузырьки воздуха из трубки и капилляра). Для этого опускают капилляр в мерную колбочку на 25 см3. Открывают верхний зажим и одновременно включают секундомер. Отмечают время, необходимое для вытекания 25 см3 стандартного раствора. Рассчитывают объем раствора, вытекающего за 1 минуту.
2. Определяют концентрацию раствора азотнокислого кадмия. В ячейку наливают мерной пипеткой или из бюретки 5,00 см3 раствора Сd(NO3)2, 50 см3 1 М раствора Na2SO4, доливают дистиллированную воду до общего объема 150 см3.
Опускают в раствор электроды. Платиновый вращающийся электрод не должен касаться дна и стенок электролизера. Хлорсеребряный электрод не должен мешать вращению платинового электрода. Если используют не вращающийся платиновый электрод, то для перемешивания раствора применяют магнитную мешалку.
Аликвоту нитрата кадмия раствор титруют раствором гексацианоферрата (II) калия. Опускают капилляр в исследуемый раствор, открывают верхний зажим, одновременно включают секундомер и самописец. Через каждую минуту на бумажной ленте (на графике) делают пометки (это дает возможность знать количество прилитого стандартного раствора в каждой точке титрования).
При добавлении гексацианоферрата (II) калия кадмий выпадает в осадок.
После того, как весь кадмий вступит в реакцию, т.е. при достижении точки эквивалентности, в растворе появляется избыток титранта. Гексацианоферрат (II) калия окисляется до гексацианоферрата (III) калия. При этом возрастает ток, который фиксируется самописцем (или гальванометром) (рис. 20).
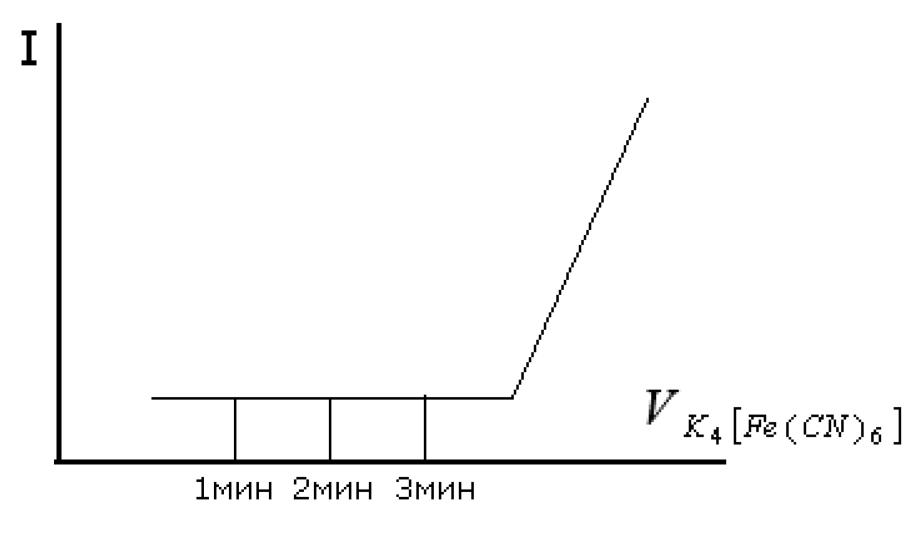
Рис. 20. Кривая амперометрического титрования раствора Сd(NO3)2 гексацианоферратом (II) калия
Точку эквивалентности и эквивалентный объем титранта, находят по графику. Титрование повторяют несколько раз до получения трёх сходящихся результатов (допускается расхождение на 0,1 – 0,2 см3).
Рассчитывают среднее значение эквивалентного объема из трех параллельных определений. По нему рассчитывают молярную концентрацию эквивалента азотнокислого кадмия с точностью до 4-х значащих цифр:
![]()
Берут точный объем раствора Cd(NO3)2 (например 8,5 см3), добавляют 50 см3 1 М раствора Na2SO4, воды до 150 см3 и титруют раствором К4[Fе(СN)6]. Титрование повторяют до получения трёх сходящихся результатов (расхождение между параллельными не более 0,1 – 0,2 см3). Рассчитывают среднее значение эквивалентного объема из трех параллельных определений. По нему рассчитывают объем аликвоты раствора азотнокислого кадмия с точностью до 4-х значащих цифр.
Сравнивают полученный объем со взятым на анализ. Если расхождение не превышает 0,2 – 0,3 %, приступают к анализу образца.
Анализируемый раствор количественно переносят в электролизер. Добавляют 50 см3 1 M раствора Na2SO4 и воду до 150 см3 и титруют подобно учебной задаче. Рассчитывают V[Cd(NO3)2], эквивалентная концентрация которого известна. Зная объем и концентрацию раствора Сd(NO3)2, рассчитывают массу кадмия в граммах
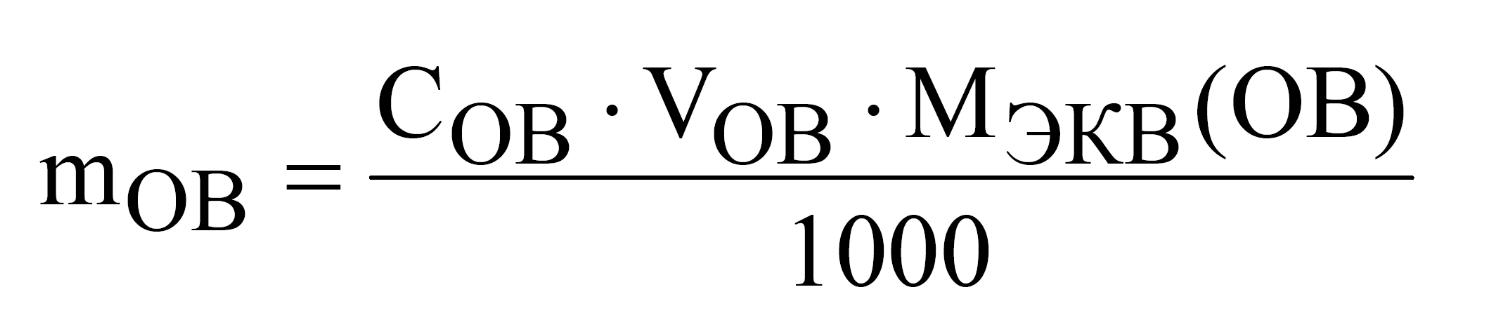
где СОВ – концентрация определяемого вещества моль экв/дм3; VОВ – рассчитанный объем анализируемого раствора, см3; МЭКВ(ОВ) – молярные массы эквивалента [1/2 Cd(NO3)2] г/моль. По результатам трех параллельных определений рассчитать СКО и доверительный интервал для полученных величин (доверительная вероятность 95%). Рассчитывают абсолютную и относительную ошибку определения.
