
- •Введение
- •1. Спектральные и оптические методы анализа
- •1.1. Эмиссионный спектральный анализ. Фотометрия пламени
- •Контрольные вопросы
- •1.2. Молекулярно-абсорбционный анализ
- •Контрольные вопросы
- •1.3. Дифференциальная фотометрия
- •Контрольные вопросы
- •1.4. Фотометрическое титрование
- •Контрольные вопросы
- •1.5. Кинетический метод анализа
- •Контрольные вопросы
- •1.6. Фотометрия светорассеивающих систем
- •Контрольные вопросы
- •1.7. Люминесцентный анализ
- •Контрольные вопросы
- •1.8. Рефрактометрический метод анализа
- •Контрольные вопросы
- •1.9. Метрологические характеристики и статистическая обработка результатов анализа
- •2. Электрохимические методы анализа
- •2.1. Электрогравиметрия
- •Контрольные вопросы
- •2.2. Потенциометрия
- •Контрольные вопросы
- •2.3. Кондуктометрия
- •Контрольные вопросы
- •2.4. Полярографический анализ
- •Контрольные вопросы
- •2.5. Амперометрическое титрование
- •Контрольные вопросы
- •3. Хроматографические методы
- •3.1. Характеристика основных конструктивных узлов (блоков) хроматографа
- •3.2. Принцип работы газового хроматографа на примере chrom 5
- •3.3. Генератор водорода. Устройство и принцип работы
- •3.4. Методика выполнения работы Отбор пробы
- •Подготовка хроматографов к выполнению измерения
- •Выполнение измерений
- •Вычисление результатов анализа
- •3.5. Методы расчета хроматограмм
- •3.6. Методы расчета концентраций
- •Контрольные вопросы
- •4. Титриметрические методы анализа
- •Правила титрования
- •4.1. Кислотно-основное титрование в водном растворе
- •Контрольные вопросы
- •4.2. Осадительное титрование
- •Контрольные вопросы
- •4.3. Методы комплексообразования. Комплексонометрическое титрование
- •Контрольные вопросы
- •4.4. Окислительно-восстановительное титрование
- •Контрольные вопросы
- •Заключение
- •Библиографический список
- •Оглавление
- •394026 Воронеж, Московский просп., 14
Контрольные вопросы
1. Сущность метода. Принципиальная схема прибора.
2. Приготовление стандартных растворов.
3. Какой стандартный раствор используется в данной методе анализа? Как он готовится? Расчет навески для приготовления 500 см3 0,5 н раствора. На каких весах надо взвешивать навеску? Какая мерная посуда требуется для приготовления раствора? Как определяется его точная концентрация?
4. Как приготовить и определить точную концентрацию раствора уксусной кислоты?
5. Какое значение в данной методе анализ играет подвижность ионов? Какие ионы обладают наибольшей подвижностью? В чём суть “эстафетного” механизма переноса заряда ионами Н+ и ОН–?
6. Какие процессы происходят в растворе при титровании едким натром смеси соляной и уксусной кислоты? Объясните кондуктометрические кривые. Почему при титровании уксусной кислоты электропроводность не падает, а растет?
7. Как определяется точка эквивалентности?
8. Почему возможно определение смеси кислот кондуктометрическим методом?
9. Эквивалентная и удельная электропроводность. Какую из них измеряем в ходе анализа?
10. В каких единицах измеряется электропроводность?
11. Какие электроды используются в анализе? Их устройство.
12. Постоянный или переменный ток проходит через ячейку?
13. Достоинства и недостатки метода.
14. Как рассчитать массу HCl и CH3COOH в контрольной задаче?
15. Какие знаете способы выражения концентрации растворов?
2.4. Полярографический анализ
Полярография представляет собой разновидность вольтамперометрии – группы электрохимических методов, в которых регистрируют силу тока в цепи электролизера при программируемом изменении подаваемого наячейку напряжения. В полярографии в качестве индикаторного применяется ртутный капающий микроэлектрод.
Процессы восстановления на микроэлектроде протекают в диффузионном режиме, а наблюдаемый предельный диффузионный ток (ig) подчиняется уравнению Ильковича
ig = 708,2nD1/2m2/3t1/6C
где F – постоянная Фарадея, А·с/моль; D – коэффициент диффузии электродноактивного вещества, см2/c ; С – концентрация определяемого вещества в объеме раствора, моль/дм3; m – скорость вытекания ртути мг/с; t – период капания ртути, с.
Миграция ионов под действием градиента электрического потенциала совпадает по направлению с диффузной, протекающей под действием градиента химического потенциала (в первом приближении – под действием градиента концентрации). Поэтому величину ig, регистрируют при условии сведения к минимуму миграционного тока. С этой целью в раствор добавляют значительный избыток (до 1000-кратного) фонового электролита, и измерение проводят в отсутствие перемешивания.
Чтобы избежать влияния растворенного кислорода, его удаляют продувкой азота или химическими методами. Поверхностно-активные вещества (например, желатин) предохраняют от появления на полярограммах максимумов.
Правильно записанная постояннотоковая полярограмма имеет вид кривой, представленной на рис. 17. Там же показано, как графически определять предельный ток ig.

Рис. 17. Постояннотоковая полярограмма и её важнейшие характеристики: ig -сила предельного тока, Е1/2 - потенциал полуволны
Для качественного анализа сравнивают экспериментальные значения Е1/2 с табличными, полученными в идентичных условиях, или записанными в присутствии того же фона для известных катионов. При количественном анализе обычно пользуются заранее построенным калибровочным графиком в координатах “h – концентрация ионов”. Чувствительность постояннотоковой полярографии ограничена силой тока заряда двойного электрического слоя - ДЭС (конденсаторного тока), который для ртутного капающего электрода достигает 10-7 А. Кроме того, волны с величинами Е1/2, отличающимися менее, чем на 100 мВ, остаются неразделёнными (низкая разрешающая способность метода).
Значительно лучшими аналитическими характеристиками обладает переменнотоковая полярография: минимальная определяемая концентрация 5·10–8 моль/дм3 (вместо 10–5) и разрешение ~ 40 мВ. В этом методе при линейной развёртке напряжения, подаваемого на ячейку, его моделируют переменной составляющей с амплитудой до 60 мВ (например, по синусоидальному закону). При этом ток в цепи электролизера имеет три составляющих: диффузионный ток, связанный с электродной реакцией, протекающей под воздействие медленно меняющегося напряжения; ток заряда-разряда ДЭС под воздействием синусоидального напряжения и ток, вызванный изменением скорости электродной реакции под воздействием синусоидального напряжения.
Прибор устроен так, что постоянная составляющая не регистрируется, а емкостная и активная составляющая разделены по фазе. Это приводит к образование пика при Е1/2, высота которого прямо пропорциональна концентрации: электродноактивного вещества (если электродный процесс обратим).
Пример. Полярографическое определение никеля и меди в сточных водах.
Опыт 1. Постояннотоковая полярография
Построение калибровочной кривой. Стандартными растворами заполняют две бюретки на 50 см3 с соответствующей маркировкой. В третью бюретку наливают фоновый раствор. В мерные колбы на 25 см3 наливают 1,00; 2,00 и 3,00 см3 раствора меди, а в другие три колбы - такие же объемы раствора никеля. Отдельно готовят раствор учебной задачи: по 2,00 см3 рабочих растворов меди и никеля и получают контрольную задачу. Во все колбы добавляют по 2 капли раствора желатина и доливают фоном до метки. Перед снятием полярограммы каждый раствор продувают 10 мин азотом для удаления растворенного кислорода.
Записывают постояннотоковые полярограммы всех растворов. Концентрацию определяют методом градуировочного графика. Для этого проводят обмер полярограмм в соответствии с рис. 17.
Затем строят калибровочный график в координатах h – C и определяют концентрацию металлов в анализируемых образцах.
Опыт 2. Переменнотоковая полярография
Построение калибровочной кривой. Из имеющихся стандартных растворов путем 10-кратного разбавления водой в мерных колбах на 100 см3 готовят рабочие растворы с концентрацией 0,100 г/дм3 и наливают их в бюретки с соответствующей маркировкой. Затем точно так же, как и в описанном выше варианте постояннотоковой полярографии, готовят растворы для измерения силы тока и последующего построения градуировочного графика, одновременно проводят измерение силы тока растворов-задач. Записывают переменнотоковые полярограммы. Измерят высоты пиков в соответствии с рис. 18.
Затем строят градуировочный график в координатах h – c и по нему определяют концентрации металлов в анализируемом образце.
Переменнотоковая полярография методом добавок. В этой методе нет необходимости отроить градуировочный график. Записывают полярограмму для учебной задачи. Затем выливают раствор в мерную колбу на 25 см3 и добавляют по 1,00 см3 рабочих растворов меда и никеля, перемешивают и снова записывают полярограмму в том же режиме.
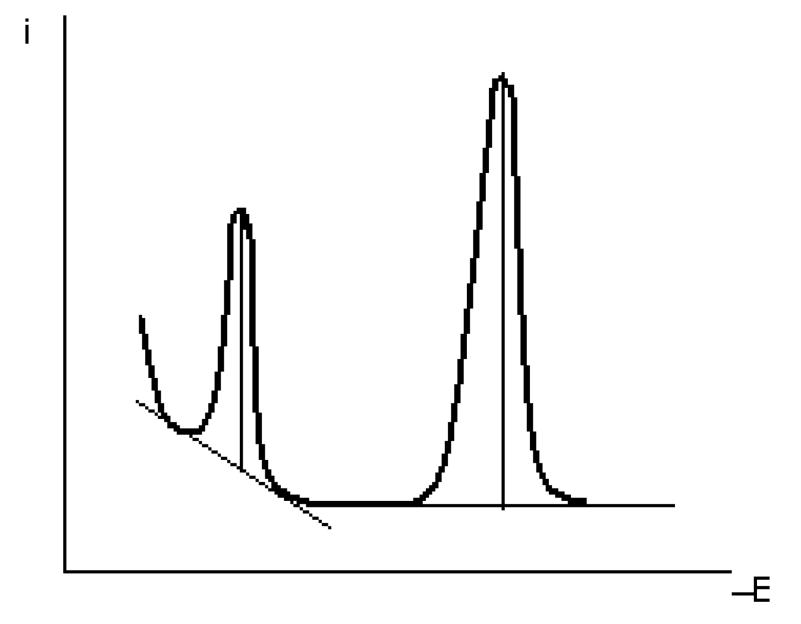
Рис. 18. Переменнотоковая полярограмма и измерениевысот пиков
Аналогично записывают полярограмму контрольной задачи и повторную запись с добавкой во 1,00 см3 рабочих растворов меди и никеля. Расчет массы mX проводятпо формуле:
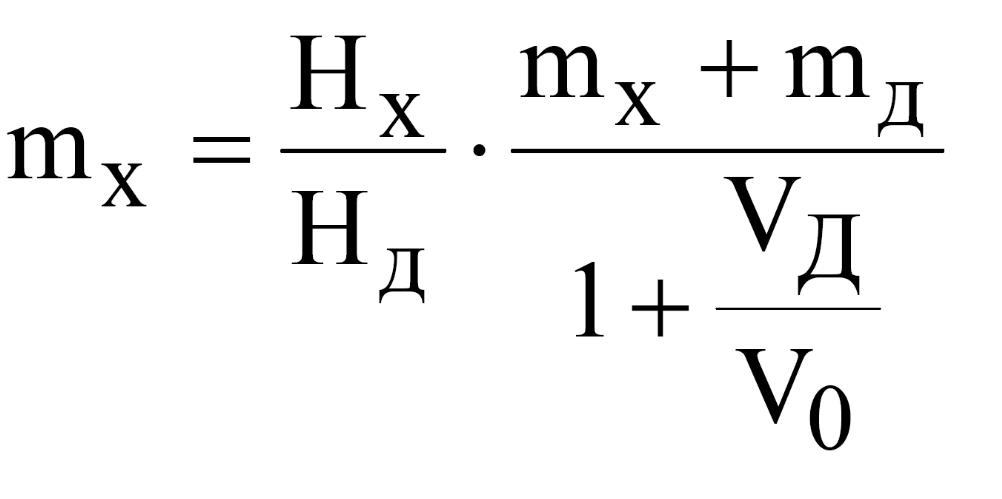
где mX – концентрация металла, г; mД – масса металла в добавленном стандартном растворе, г; V0 – объём раствора в мерной колбе, см3; VД – объем добавки, см3; НХ – высота пика без добавки, мм; НД – высота пика с добавкой, мм.
