
- •Методология санитарно-гигиенического нормирования
- •Нормирование загрязняющих в-в в воде
- •1) Проведение острого опыта; 2) Изучение хронического действия; 3) Санитарно-эпидемиологич. Эксперимента для установления max недействующей дозы в-ва.
- •Биобезопасность
- •Биоиндикация
- •Экологические основы биоиндикации
- •Загрязнение окруж. Среды и его виды
- •Общие принципы исп. Биоиндикаторов
- •Особенности исп. Животных в качестве биоиндикаторов
- •Биондикация состояния почвы
- •Биоиндикация состояния водной среды
- •Биологические индексы и коэф., исп. При индикационных исследованиях.
- •Биотестирование
- •Общие требования к объектам биотестирования
- •Тест-функции объектов биотестирования
- •Подходы к биотестированию
- •Преимущества методов биоиндикации и биотестирования
- •Основные классы ферментов
- •Антитела
- •Медиаторные биосенсоры
- •Биосенсоры на основе прямого переноса электронов
- •Биосенсор на основе оптического волокна
- •Биосенсоры на основе поверхностного плазмонного анализа
- •Биосенсоры на основе жидких кристаллов
- •Пьезоакустические биосенсоры
- •Аналитические и метрологические характеристики биосенсоров
Преимущества методов биоиндикации и биотестирования
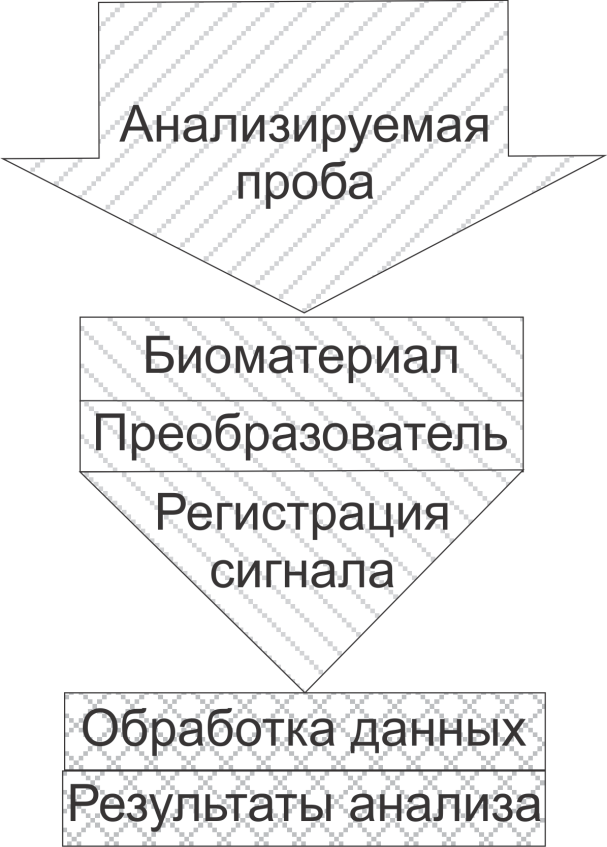
Основное преимущество перед физико-хим. методами анализа - является интегральный характер ответных реакций организмов. Такие ре-ции суммируют все без исключения важные данные об окр. среде, выявляют наличие в среде целого комплекса загрязнителей, фиксируют скорость происходящих в окружающей среде изменений указывают пути поступления и места скоплений загрязняющих ве-в. Биосенсор - это интегральная система, которая способна воспринимать и преобразовывать специчную количесвенную или полуколичественную аналитическую информацию с исп. биологического распознающего элемента (Биохим. рецептора), находящегося в тесном контакте с преобразователем. С1
Биоматериал-основной анализирующий материал сенсора, содерж. биологический материал, ре-ция которого регистрируется преобразователем. Преобразователь-физический сенсор, регистрирующий изменение физико-хим. св-в биоматериала, сост. биорецептор. Блок регистрации и обработки данных-аналоговый или цифровой блок, производящий регистрацию сигнала преобразователя, его предварительную обработку и оценку основных параметров. Биосенсоры разделяют в соответствии с типом исп. преобразователя и типом исп. биологического материала:
По
типу преобразователя: *калориметрические;
*пьезоэлектрические;
*оптические
(спектрофотометрические; флуоресцентные;
на основе поверхностного плазмонного
резонанса; на основе жидких кристаллов);
*электрохим.(амперо-,
потенцио-, кондукто- метрические). По
типу биологического материала: *аффинные
(Ag+Ab [Ag
Ab];
Антитела/ антигены; Лектины; Рецепторы
животных клеток; Нуклеиновые ки-ты);
*Гибридные
(Ферменты+Антитела/ антигены;Ферменты+ДНК);
*каталитические
(E+S
[ES]
[Ag
Ab];
Антитела/ антигены; Лектины; Рецепторы
животных клеток; Нуклеиновые ки-ты);
*Гибридные
(Ферменты+Антитела/ антигены;Ферменты+ДНК);
*каталитические
(E+S
[ES] E+P;
Ферменты; Клетки микроорганизмов; Срезы
тканей).
E+P;
Ферменты; Клетки микроорганизмов; Срезы
тканей).
Основная особенность каталитических биосенсоров состоит в расходовании анализируемого соединения в биохим. ре-циях его трансформации. Особенности афинных биосенсоров явл. процессы высокоспецифического связывания анализируемого соед. с биораспознающим элементом сенсора.
Особенности биосенсорного анализа
*Безреагентность (для выполн. анализа обычно не требуется производить добавление к исследуемому образцу каких-либо соед.); *Простота анализа (отсутствует необходимость привлечения к его выполнению высококвалифицированного персонала); *Низкая стоимость (простота аппаратуры); *Высокая чувствительность и специфич
ность (применение биологич. материала); *Многократность (возможность многоразового определения); *Возможность исп. в полевых или домашних условиях
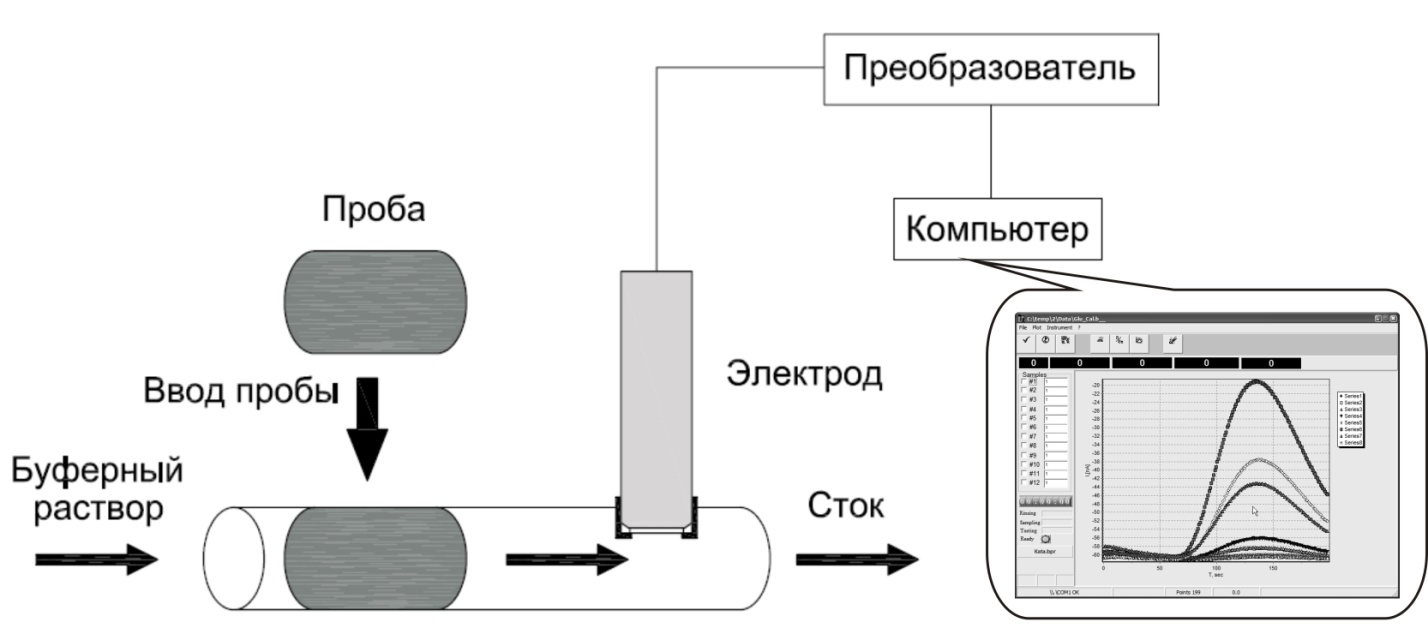
Способы подачи проб при измерении
Чтобы с помощью биосенсоров произвести оценку конц. ве-ва необходимо ввести пробу в среду, в которой находится распознающий элемент. Сущ. два основных типа подачи пробы: кюветный и проточно-инжекционный. В кюветном способе сенсор погружен в измерительную ячейку, содержащую перемешиваемый буферный ра-р. Анализируемая проба вводится в измерительную кювету с исп. различных дозирующих устройств, при этом происходит значительное разведение пробы, что приводит к снижению чувствительности метода. Особенностью кюветного способа изменения явл.: введение пробы при перемешенивании ра-ра приводит к быстрому установлению стационарного уровня конц. ве-в в кювете. Р3
В проточно-инжекционном варианте измерения биосенсор встроен в канал, по которому прокачивается буферный ра-р. В пробу впрыскивается поток буфера и через определённое время поступает в зону рецепторного элемента. Время контакта пробы с биорецептором определяется скоростью потока и объёмом пробы, в отличие от кюветного варианта конц. ве-ва в пробе не изменяется. Т.О. биосенсоры на основе (2) способа измерения более чувствительны, чем биосенсоры (1). Р4
Ещё один способом явл. количественный анализ «в капле». Тест-полоски биодатчиков обладают многофункциональным действием, они позволяют производить предварительное разделение или концентрирование ве-в и их трансформацию или связывание с антителами. Рабочая зона таких тест-полосок относительно невелика, поэтому для запуска биохим. ре-ции необходимо 1-2 мкл пробы. Проба наносится на полимерную поверхность тест-полосок. Крупные молекулы и целые клетки задерживаются в поли
 С1
С1
 Р3
Р3
 Р4
Р4
мерной слое, а ра-р низкомолекулярного анализ. в-ва проникает в зону, где в сухом состоянии имобилизированы хим. и биохим. реагенты. В результате происходит растворение реагентов и запускается биохим. ре-ция.
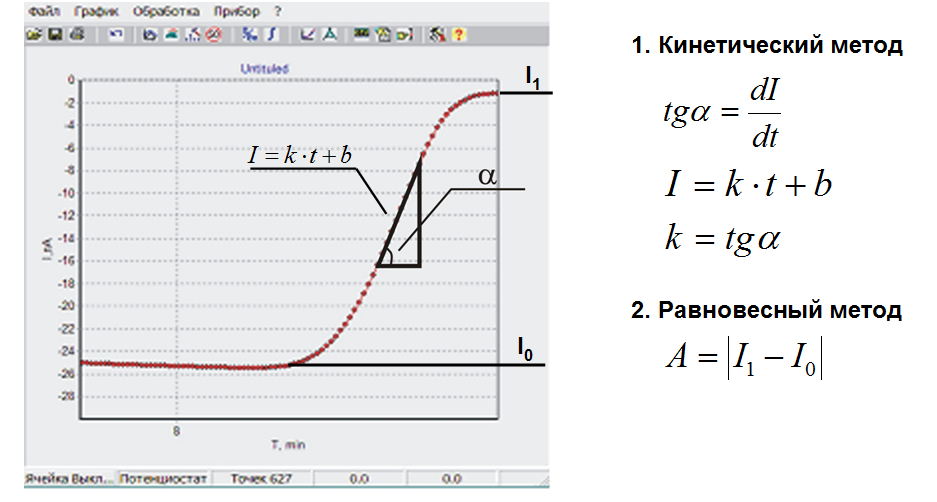
Типы регистрации ответа биосенсора
В качестве измеряемого параметра биосенсора могут использованы начальная скорость развития сигнала (кинетический метод) или величина амплитуды сигнала (равновесный метод). Преимущества исп. кинетического метода состоит в возможности сокращения времени измерения пробы. Р5
Ре-ция окисления глюкозы:

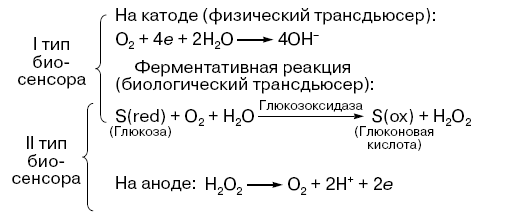
Типы биорецепторных элементов биосенсоров
Бывают каталитические и афинные. Биосенсоры каталитического типа-многоразовые. Они могут позволить производить анализ в непрерывном режиме. ДОК биосенсоров каталитического типа 10-6 - 10-3 моль/л. Биосенсоры афинного типа в чаще явл. одноразовыми. Типичный ДОК афинных биосенсоров 10-12 - 10-6 моль/л. Р6(а, б)
В гибридных биосенсорах элементы афинного взаимодействия сопряжены с ферментным усилением сигнала. Такие биосенсоры характеризуются повышенной чувствительностью и позволяют производить анализ в диапазоне 10-15 - 10-12 моль/л.
Основы строения ферментов
Фермент(Ф)-биокатализаторы, образующиеся в клетке и представляющие собой белки. Специфичность Ф позволяет обнаруживать соед., явл. субстратами в ферментативных ре-циях. С точки зрения строения большая часть Ф явл. сложными белками, т.е. они явл. комплексами полипептидных цепей и молекул неаминокислотной природы. Неаминокислот. часть Ф-коферментом, а белковую часть-апоферментом.



общ. ф-ла АК строен. пептид. св. фрагмент полипепт. Цепи
 Р5
Р5
 Р6
а
Р6
а
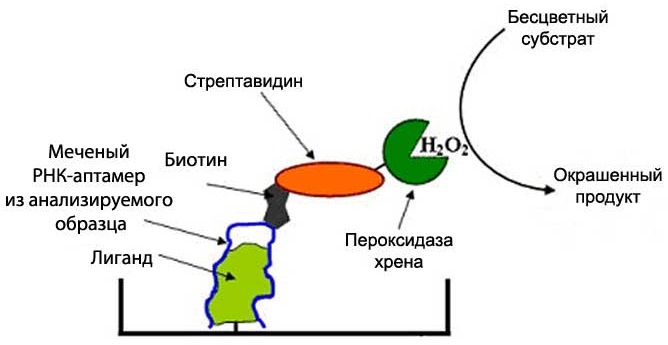 Р6
б
Р6
б
Аминоки-ты отличаются друг от друга радикалами, две молекулы АК, могут ковалентно связываться друг с другом при помощи пептидной связи. Амидная группа в АК представляет собой р-пи сопряженную систему, в которой происходит доп. перекрывание р-орбитали атома азота с пи-орбиталью связи С-О. В результате амидная связь имеет плоское строение. А длины связи С-N и двойной связи С-О имеют соответственно значения меньше и больше обычных величин. Кроме того, отсутствие свободного вращения вокруг связи C-N приводит к существ. цис- и транс- изомеров. Пептидная связь имеет транс-конфигурацию, в которой АК- радикалы наиболее удалены друг от друга. Конец цепи, на котором находится свободная аминогруппа-N-конец. А конец цепи со свободной карбоксильной группой-С-концом.
Первичной структурой назыв. состав и последовательность аминокислотных остатков в полипептидной цепи. Вторичная структура - расположение полипептидной цепи в пространстве за счёт водородных связей, возник. за счёт полипептидными цепями без учёта взаимодействия радикалов. Водородная связь-между группами С-О и N-H.
Выделяют два типа вторичной структуры: альфа-спираль и бета-складчатый слой. Альфа-спираль - это правая спираль с шагом =3,6 аминокислотных остатков. Боковые заместители расположены перпендикулярно плоскости альфа-спирали. В бета-складчатом слое пептидные цепи располагаются параллельно друг другу, при этом в структуре одного белка могут находиться как участки альфа-спирали, так и участки бета-складчатого слоя. Третичная структура определ. взаимодействием белковых заместителей полипептидной цепи. Четвертичная структура - способ укладки в пространстве отдельных полипептидных цепей, обладающих первичной вторичной и третичной структурой. В названии ферментов исп. принцип их классификации по типу катализируемой ре-ции и её механизма. В соответствии с классификацией Ф делятся на классы по типу катализируемой ре-ции, каждый класс делится на подкласс по природе атакуемой хим. группы, подклассы делятся на подподклассы по природе акцептора.
