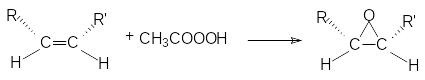Лекция №42
Двухосновные, ненасыщенные и аренкарбоновые кислоты
План.
Дикарбоновые кислоты
-Непредельные карбоновые кислоты.
Ненасыщенные дикарбоновые кислоты.
Аренкарбоновые кислоты.
Дикарбоновые кислоты
Эти соединения могут рассматриваться как результат замещения двух атомов водорода в углеводородах на карбоксильные группы.
Дикарбоновые кислоты можно подразделить на три группы, в зависимости от характера углеводородного остатка – насыщенные, ненасыщенные и арендикарбоновые кислоты.
Методы получения насыщенных дикарбоновых кислот.
Окисление -диолов.
HO(CH2)nOH [O];((( HOOC(CH2)n-2COOH
В качестве окислителей можно использовать KMnO4 в нейтральной или кислой среде или K2Cr2O7 в кислой среде.
О
 кисление
циклоалканов.
кисление
циклоалканов.
Реакцию проводят при повышенных температурах, используя в качестве окислителей KMnO4 или K2Cr2O7 в кислой среде.
Окисление циклических кетонов.
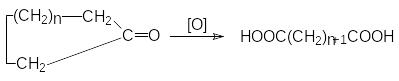
Окислители – те же, что и при окислении цикдлоалкенов. Температура 100-120оС.
Гидролиз динитрилов крабоновых кислот.
a) NC(CH2)nCN + 4H2O + 2H2SO4 HOOC(CH2)nCOOH + 2NH4HSO4
б) NC(CH2)nCN + 2H2O + 2NaOH NaOOC(CH2)nCOONa + 2NH3
Карбонилирование диолов.
HO(CH2)nOH +2CO;[Ni(CO)4 HOOC(CH2)4COOH
Свойства дикарбоновых кислот.
Кислотные свойства дикарбоновых кислот.
К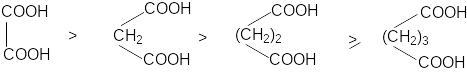 аждая
карбоксильная группа действует на
другую как электроноакцептор, повышая
ее кислотность, причем с увеличением
расстояния между карбоксильными группами
их кислотность падает.
аждая
карбоксильная группа действует на
другую как электроноакцептор, повышая
ее кислотность, причем с увеличением
расстояния между карбоксильными группами
их кислотность падает.
В силу быстрого затухания индуктивного эффекта различие в кислотностях дикарбоновых кислот с ростом длины полиметиленовой кислоты возрастает.
Вторая константа кислотности дикарбоновых кислот ниже, чем первая, поскольку карбоксилат-анион обладает +I – эффектом.
Наиболее важными среди дикарбоновых кислот являются щавелевая, малоновая, янтарная, глутаровая (этан-, пропан-, бутан- и пентандикарбоновая).
Щавелевая кислота – НООС-СООН, бесцветное кристаллическое вещество, растворимое в воде и спиртах и труднорастворимое в углеводородах.
С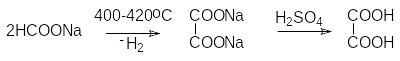 пецифическим
способом получения щавелевой кислоты
является нагревание формиата натрия.
пецифическим
способом получения щавелевой кислоты
является нагревание формиата натрия.
Специфическими реакциями щавелевой кислоты являются разложение в присутствии концентрированной серной кислоты и окисление:
HOOC-COOH H2SO4;((((( CO +CO2 +H2O
HOOC-COOH [O];((( CO2 +H2O
Щ авелевую
кислоту используют как протраву при
крашении тканей и как аналитический
агент. Возможно ее использование для
получения полиэфиров. Из производных
щавелевой кислоты интерес представляет
диэтилоксалат С2Н5ООС-СООС2Н5.
Для него характерны многие реакции
сложных эфиров. Он вступает в реакцию
сложноэфирной конденсации (см. конденсацию
по Клайзену) в качестве реагента, не
содержащего подвижные атомы водорода
(см. синтезы на основе ацетоуксусного
эфира). Подобный же вид конденсации
протекает при взаимодействии диэтилоксалата
с кетонами.
авелевую
кислоту используют как протраву при
крашении тканей и как аналитический
агент. Возможно ее использование для
получения полиэфиров. Из производных
щавелевой кислоты интерес представляет
диэтилоксалат С2Н5ООС-СООС2Н5.
Для него характерны многие реакции
сложных эфиров. Он вступает в реакцию
сложноэфирной конденсации (см. конденсацию
по Клайзену) в качестве реагента, не
содержащего подвижные атомы водорода
(см. синтезы на основе ацетоуксусного
эфира). Подобный же вид конденсации
протекает при взаимодействии диэтилоксалата
с кетонами.
Малоновая кислота
НООС(СН2)СООН – бесцветное кристаллическое вещество, растворимое в воде.
Специфичный способ получения – из хлоруксусной кислоты
ClCH2COONa KCN;- KCl;((((( NCCH2COONa H2O;[H2SO4];(((((( HOOC(CH2)COOH
Малоновая кислота легко декарбоксилируется при нагревании выше 133-135оС или при кипячении водных растворов в присутствии кислот.
HOOCCH2COOH t;(( CH3COOH + CO2
Малоновая кислота содержит очень активную метиленовую группу с подвижными атомами водорода. Поэтому малоновая кислота и ее эфиры вступают в реакции конденсации, протекающие по карбанионному механизму:
а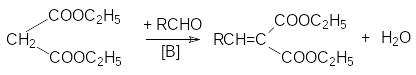 )
конденсация с альдегидами и кетонами
(реакция Кневенагеля):
)
конденсация с альдегидами и кетонами
(реакция Кневенагеля):
б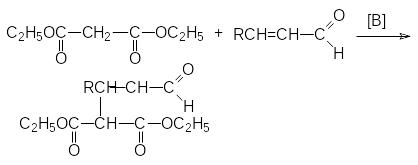 )
реакция Михаэля – сопряженное
присоединение к -ненасыщенным
системам:
)
реакция Михаэля – сопряженное
присоединение к -ненасыщенным
системам:
Янтарная кислота – HOOC(CH2)2COOH – бесцветное кристаллическое вещество, растворимое в воде и спиртах.
В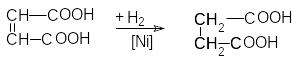 промышленности ее получают гидрированием
малеиновой кислоты
промышленности ее получают гидрированием
малеиновой кислоты
и карбонилированием этиленгликоля
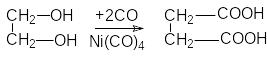
Д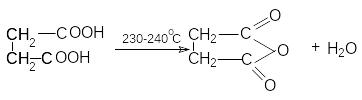 ля
янтарной кислоты характерны все реакции
карбоксильной группы. Особенность
янтарной кислоты – способность к
циклизации. Наиболее важными реакциями
циклизации являются образование
янтарного ангидрида
ля
янтарной кислоты характерны все реакции
карбоксильной группы. Особенность
янтарной кислоты – способность к
циклизации. Наиболее важными реакциями
циклизации являются образование
янтарного ангидрида
и сукцинимида:
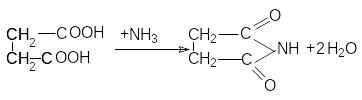
Важным производным сукцинимида является бромсукцинимид, который используется для окисления и бромирования органических соединений (см. аллильное бромирование алкенов).
П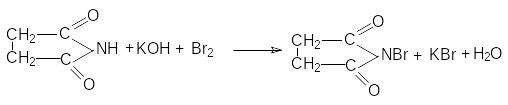 олучается
бромсукцинимид путем бромирования
сукцинимида в присутствии щелочей.
олучается
бромсукцинимид путем бромирования
сукцинимида в присутствии щелочей.
Молекула янтарной кислоты содержит две активированные метиленовые группы. Их активность уступает активности метиленовой группы в малоновой кислоте, но достаточна для осуществления реакций галогенирования и конденсации с альдегидами и ангидридами кислот в более жестких условиях.
Янтарная кислота и ее эфиры - исходные вещества для получения полиэфирных волокон и лекарственных веществ.
Адипиновая кислота.
Получается окислением циклогексанона азотной кислотой:
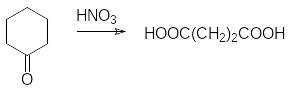
и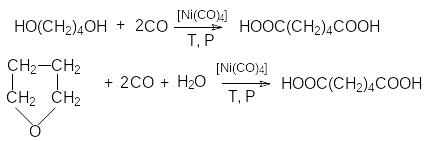 карбонилированием 1,4-бутандиола и
тетрагидрофурана:
карбонилированием 1,4-бутандиола и
тетрагидрофурана:
Адипиновая кислота используется для получения волокна найлон.

Эфиры адипиновой кислоты и ее ближайших гомологов используются для получения средних и больших циклов. В этом плане важными синтезами являются:
Ацилоиновая конденсация:
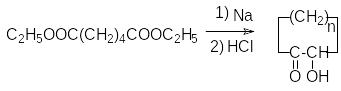
К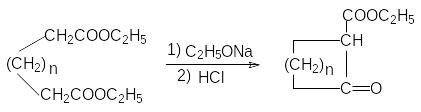 онденсация
по Дикману:
онденсация
по Дикману:
М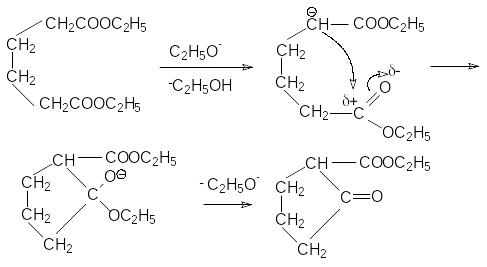 еханизм
последней реакции подобен механизму
конденсации по Кляйзену
еханизм
последней реакции подобен механизму
конденсации по Кляйзену
Непредельные карбоновые кислоты.
Методы синтеза.
Дегидратация -оксикислот
R-CH(OH)CH2COOH t;[Al2O3];(((((( R-CH=CH-COOH
Дегидрогалогенирование галогенкарбоновых кислот
R-CH(Hal)-CH2COOH +NaOH;t;(((( R-CH=CH-COOH + NaHal + H2O
R-CH(Hal)-CH(Hal)-COOH +2NaOH;t;(((( R-CC-COOH + 2NaHal + 2H2O
Гидрокарбоксилирование алкинов
HCCH + CO + H2O [Ni(CO)4];t CH2=CH-COOH
Окисление ненасыщенных спиртов или альдегидов в мягких условиях
RCH=CH-CHO [O];((( RCH=CH-COOH
RCH=CH-CH2OH [O];((( RCH=CHCOOH
Окисление осуществляtтся кислородом при катализе солями кобальта и марганца или неорганическими окислителями (K2Cr2O7 в кислой среде, KMnO4 в кислой или нейтральной среде)
реакция Кневенагеля
RCHO + CH2(COOH)2 [B];((( RCH=C(COOH)2 t;(( RCH=CH-COOH + CO2
р
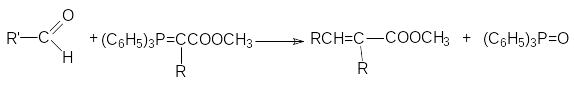 еакция
Виттига (взимодействие альдегидов с
алкоксикарбонилфосфоранами)
еакция
Виттига (взимодействие альдегидов с
алкоксикарбонилфосфоранами)
Химические свойства.
Подобно алкенам двойные связи ненасыщенных кислот могут присоединять бром, эпоксидироваться , гидробромироваться , хотя эти реакции оказываются более медленными по сравнению с соответствующими реакциями алкенов, что связано с дезактивирующим действием карбоксильной группы.
П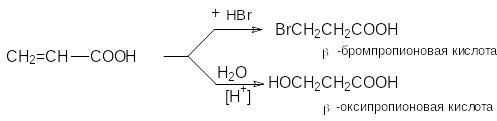 рисоединение
воды, HBr
и других реагентов, имеющих подвижный
водород, идет против правила Марковникова
рисоединение
воды, HBr
и других реагентов, имеющих подвижный
водород, идет против правила Марковникова
П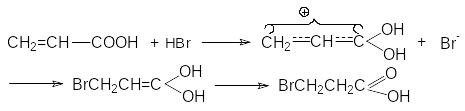 ервый
акт взаимодействия связан с протонированием
карбонильного кислорода, приводящего
к образованию положительно заряженного
реакционного центра на углеродном
атоме:
ервый
акт взаимодействия связан с протонированием
карбонильного кислорода, приводящего
к образованию положительно заряженного
реакционного центра на углеродном
атоме:
Присоединение галогенов идет стерeоспецифично через образование неклассического циклического катиона с последующим присоединением галогенид-аниона в транс-положение
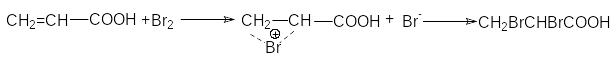
Эпоксидирование происходит с сохранением конфигурации алкена: из цис-алкенов образуются цис-эпоксиды, из транс-алкенов – транс-эпоксиды, например