
Лекции / Лекция_5
.DOC
Лекция №5
СТРУКТУРНЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ МОЛЕКУЛАХ И ИНТЕРМЕДИАТАХ
План
Электронные и пространственные эффекты в органических молекулах и интермедиатах.
Связь структурных эффектов с реакционной способностью органических молекул.
Химическое поведение органических молекул и интермедиатов определяется структурным окружением реакционного центра. Структурные эффекты заместителей на химическую реакцию определяются объемом заместителей и характером их электронного взаимодействия с реакционным центром. Последние подразделяются на индуктивный эффект, эффект сопряжения и эффект сверхсопряжения (гиперконьюгации).
Полярность химических связей в органических молекулах. Индуктивный эффект.
Если химическая связь образуется между двумя различными атомами, то связывающие их электроны смещены в сторону более электроотрицательного атома. В результате центры тяжести положительного и отрицательного заряда смещены и связь становится полярной. Это явление изображается при помощи частичных зарядов например, C- - H+; Cl- – C+ .
Смещение электронов можно также изображать стрелкой по линии связи, C+ Cl-.
Э![]() лектронное
смещение осуществляется также в двойных
и тройных связях, однако в этом случае
имеет место большая поляризация, так
как электроны этих связей более подвижны
(поляризуемы). Для обозначения смещения
электронов в кратных связях применяют
изогнутую стрелку.
лектронное
смещение осуществляется также в двойных
и тройных связях, однако в этом случае
имеет место большая поляризация, так
как электроны этих связей более подвижны
(поляризуемы). Для обозначения смещения
электронов в кратных связях применяют
изогнутую стрелку.
Электронное смещение за счет поляризации вызывает смещение в соседних связях, причем этот эффект затухает по длине цепи. Экспериментально наблюдаемый эффект передачи смещения электронов и поляризации на другие, соседние связи, называется индуктивным эффектом и обозначается I. Если заместитель оттягивает электроны в свою сторону, то его эффект называется отрицательным индуктивным эффектом и обозначается -I. Если заместитель отталкивает от себя электроны в сторону соседних связей или атомов, то такой эффект называется положительным индуктивным эффектом и обозначается +I.
Полярность играет важную роль в химических реакциях. Если в качестве атакующих частиц выступают катионы, то они имеют сродство к отрицательному заряду (электрофильность) и предпочтительно атакуют места в молекуле с повышенной электронной плотностью. Как следствие, заместители с +I эффектом ускоряют такие реакции, а с -I эффектом замедляют. Если атакующим агентом является отрицательно заряженная частица или частица, имеющая неподеленную пару электронов, то эти частицы имеют сродство к положительному заряду (нуклеофильность) и предпочтительно атакуют места с пониженной электронной плотностью. Поэтому заместители с +I эффектом замедляют такие реакции, а с -I эффектом - ускоряют их. Индуктивный эффект быстро затухает по длине цепи.
Полярность молекул - результат векторного сложения дипольных моментов химических связей, входящих в молекулу. Полярность среды, обусловленная полярностью молекул растворителя, является важным фактором скорости химических реакций.
Эффект сопряжения (мезомерный эффект)
Эффект сопряжения проявляется в тех случаях, когда заместитель имеет -связи, заполненные , вакантные или полувакантные р-орбитали и находятся при атоме углерода в состоянии sp2- или sp- гибридизации.
П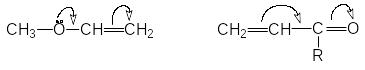 ри
таком сочетании структуры заместителя
и остальной части молекулы происходит
перекрывание р- или -орбиталей
заместителя с -орбиталями
кратных связей остальной части молекулы.
В результате заместитель оказывается
связанным с остатком молекулы кроме
обычной -связи
дополнительно посредством небольшого
-электронного
облака. Такой эффект называется эффектом
сопряжения и изображается с помощью
изогнутых стрелок:
ри
таком сочетании структуры заместителя
и остальной части молекулы происходит
перекрывание р- или -орбиталей
заместителя с -орбиталями
кратных связей остальной части молекулы.
В результате заместитель оказывается
связанным с остатком молекулы кроме
обычной -связи
дополнительно посредством небольшого
-электронного
облака. Такой эффект называется эффектом
сопряжения и изображается с помощью
изогнутых стрелок:
и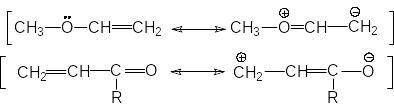 ли
с помощью резонансных структур:
ли
с помощью резонансных структур:
Если заместитель путем сопряжения отдает электроны, то такой эффект называется положительным мезомерным эффектом и обозначается +М.
Если заместитель путем сопряжения оттягивает на себя электроны, то такой эффект называется отрицательным мезомерным эффектом и обозначается -М.
Эффект сопряжения является важным фактором протекания химических реакций. Например, если атом хлора находится при ароматическом ядре, то он дополнительно связан с ароматическим ядром за счет перекрывания его р-орбиталей с -электронами ароматического ядра.
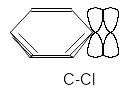
За счет такого дополнительного связывания связь С-CI упрочняется и ее трудно разорвать. Это делает хлор малоподвижным. Например, очень трудно прогидролизовать хлорбензол по сравнению с хлоралканом. Наоборот, аллилхлорид реагирует гораздо быстрее хлоралкана, что связано со стабилизацией образующегося в скорость-определяющей стадией карбкатиона.
C H2=CH-CH2Cl
H2=CH-CH2Cl
![]() CH2=CH-CH2
+Сl-
CH2=CH-CH2
+Сl-
![]()
CH2-CH=CH2
OH-
CH2=CH-CH2-OH
Можно видеть, что стабилизация аллильного карбкатиона обусловлена сопряжением вакантной р-орбитали атома углерода с -орбиталью двойной связи.
Сверхсопряжение.
Под сверхсопряжением понимают эффект --сопряжения, которая заключается во взаимодействии электронов -связи с незаполненной или частично заполненной р-орбитали р-орбиталью. Сильнее всего этот эффект проявляется в случае C-H связей при соседнем с реакционным центром атоме углерода.

и ли
ли
Такое взаимодействие приводит к существенной делокализации положительного заряда, что делает карбкатион более стабильным. Если карбкатион - продукт реакции, то эффект сверхсопряжения ускоряет реакцию, если реагент - замедляет реакцию.
Стерические (объемные) эффекты.
Стерические
эффекты связывают с влиянием объема
заместителей на успех химических
реакций. В этом плане различают 1-3-эффект,
приводящий к торможению реакции. Такой
эффект возникает когда объемные
заместители затрудняют подход атакующего
агента к этому центру. Например, в
б имолекулярной
реакции гидролиза объемные алкильные
заместители блокируют подход
гидроксил-аниона к центральному атому
углерода.
имолекулярной
реакции гидролиза объемные алкильные
заместители блокируют подход
гидроксил-аниона к центральному атому
углерода.
Стерическое ускорение связано со снятием напряжений между валентными углами, имеющей место из-за отталкивания объемных заместителей в молекуле.
О![]() бычно
стерические ускорения имеют место при
реализации реакций отрыва водорода.
бычно
стерические ускорения имеют место при
реализации реакций отрыва водорода.
С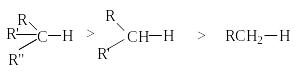 огласно
современной трактовке ряда реакционных
способностей С-Н связей алканов в
реакциях радикального замещения связан
со снижением степени снятия стерических
напряжений в этом ряду.
огласно
современной трактовке ряда реакционных
способностей С-Н связей алканов в
реакциях радикального замещения связан
со снижением степени снятия стерических
напряжений в этом ряду.
