
- •Этиология опухолей
- •1. Канцерогены химической природы
- •2. Радиация
- •Доброкачественные и злокачественные опухоли
- •Супрессоры клеточной пролиферации
- •Супрессоры клеточной пролиферации
- •Неограниченный пролиферативный потенциал
- •Поддержание и стимуляция ангиогенеза.
- •2. Лимфогенный путь
- •3. Гематогенный путь
- •Механизмы противоопухолевой защиты и механизмы избегания опухолью иммунного ответа
- •Клинические проявления опухолей
- •Классификация и проявления паранеопластических синдромов
- •Наиболее широко используемые онкомаркеры
Неограниченный пролиферативный потенциал
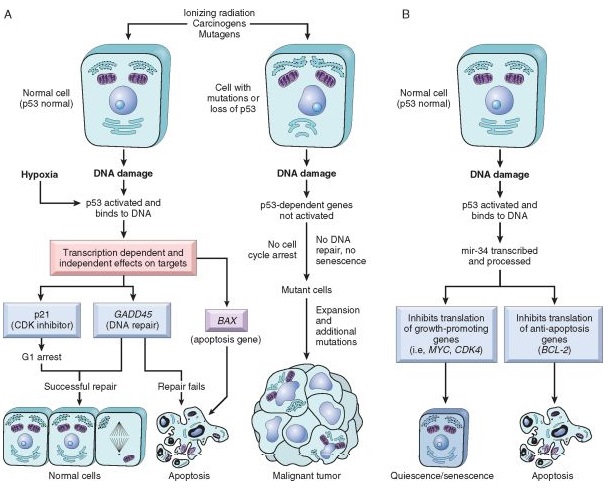
Рисунок. Роль р53 в поддержании интактности генома. Активация нормального р53 при повреждении ДНК или гипоксии ведет к остановке клеточного цикла и запуску репарации ДНК. После успешной репарации ДНК клетка может вернуться в клеточный цикл. При невозможности репарации ДНК, в клетке с помощью р53 запускается программа апоптоза или выход из клеточного цикла с переходом в период покоя. В клетках с мутациями р53 повреждение ДНК не запускает остановку клеточного цикла и репарацию ДНК – деление продолжается, что ведет к формированию клона мутировавших клеток, что является основой формирования злокачественных опухолей.
4. Неограниченный пролиферативный потенциал – неограниченная способность к пролиферации клеток связана с изменением теломер хромосом и активацией теломераз.
Большинство нормальных клеток имеют ограниченную способность к пролиферации (от 60 до 70 делений). После завершения лимита делений клетки утрачивают способность к пролиферации и подвергаются дифференцировки или переходят в состояние покоя. Этот феномен связан с прогрессирующим укорочением теломер, расположенных в концевых участках хромосом. Укорочение теломер распознается молекулами, ответственными за репарацию ДНК, что ведет к остановке клеточного цикла с участием p53 и RB. При мутация p53 or RB1 при нестабильности повышается риск реактивации теломераз. Теломеразы, активные в норме в стволовых клетках, экспрессируются в очень незначительном количестве в нормальных соматических клетках. В отличие от этого, в опухолевых клетках происходит активация теломераз и альтернативное удлинение теломер, которое связывают с рекомбинацией ДНК.
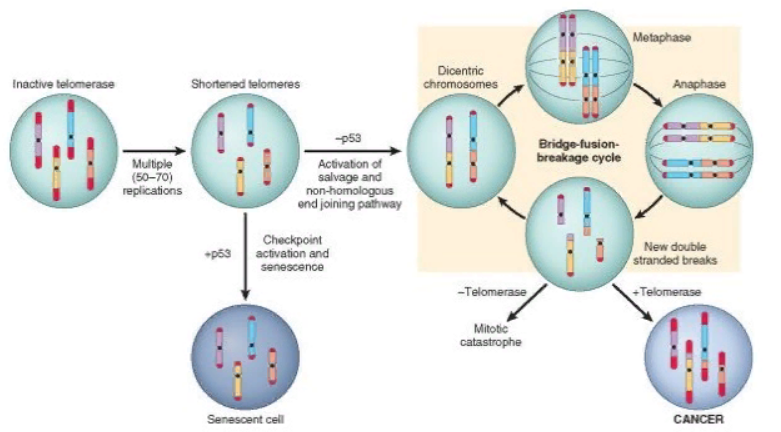
Рисунок. Последовательность событий в развитии нелимитированного пролиферативного потенциала. Репликация соматических клеток, в которых неактивна теломераза, ведет к укорочению теломер, в конечном итоге – к ограниченной способности к делению, после чего клетки переходят в состояние покоя или дифференцировку. При нарушении контроля пролиферации происходит неадекватная активация ДНК-репарарирующих систем, ведущая к формированию дицентрических хромосом, которые при митозе могут формировать мостики, определяющие удлинение теломер. Это возможно только при активации теломераз.
Поддержание и стимуляция ангиогенеза.
5. Поддержание и стимуляция ангиогенеза. Как и нормальные клетки, опухолевые клетки не способны расти без адекватного кровоснабжения. Опухолевые клетки и клетки стромального опухолевого микроокружения, как правило являются источниками стимуляторов ангиогенеза (в первую очередь VEGF). Усиление ангиогенеза в опухоли ведет к прогрессированию опухолевого роста.
Даже при наличии всех выше перечисленных аномальный опухоль не может увеличиться в размере более 1-2 мм до тех пор, пока не получит должную васкуляризацию. Как и нормальные клетки, опухоль нуждается в кислороде и питательных веществах, источником которых является кровь. При размере 1-2 мм достигается максимальное расстояние для диффузии кислорода, питательных веществ, и обратного транспорта катаболитов. Опухолевые клетки способны стимулировать неоангионгенез при котором образующиеся из предсуществующих капилляров сосуды внедряются в опухоль. Сосуды опухоли отличаются от нормальных. Как правило они шире и имеют более высокую проницаемость.
Неоваскуляризация имеет двойной эффект:
1) перфузия обеспечивает опухоль необходимыми питательными веществами
2) эндотелий новообразованных сосудов стимулирует рост соседних опухолевых клеток за счет продукции факторов роста, включая инсулиноподобные факторы роста (IGFs), фактор роста тромбоцитарного происхождения (PDGF), колоние-стимулирующих факторов гранулоцитов и мноцитов.
Поэтому выраженность ангиогенеза напрямую связана с мализнизацией.
Ключевыми стимуляторами неоангиогенеза являются фактор роста сосудистого эндотелия VEGF и основной фактор роста фибробластов (bFGF).
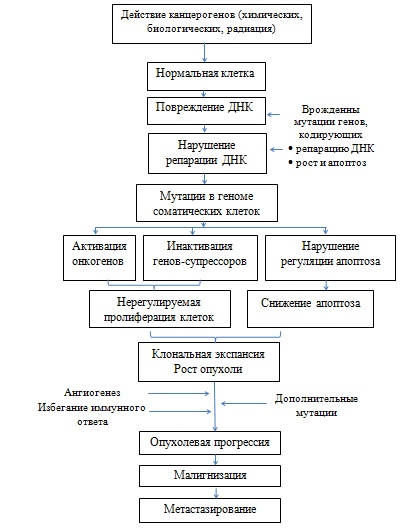
6. Инвазивный потенциал: В основе метастазирования опухолей лежит повышение их инвазивности, что обесловено потерей типичных межклеточных связей и продукцией ферментов, разрушающих базальную мембрану и компоненты межклеточного матрикса.
7. Дефекты репарации ДНК: Сочетание мутации генов под действием канцерогенов и нарушение экспрессии репарантов ДНК ведет к нерегулируемой нестабильности геном и является основой формирования новых мутаций протоонкогенов и супрессоров пролиферации, что лежит в основе прогрессирования опухолевого роста.
ИНВАЗИВНОСТЬ ОПУХОЛЕВЫХ КЛЕТОК И МЕТАСТАЗЫ
Метастазирование – распространение опухоли за пределы первичной локализации. Наличие метастазов отражает злокачественный рост опухоли.
Развитие метастазов сопряжено с повышением инвазивности опухолевых клеток, которые могу пенетрировать стенку кровеносных и лимфатических сосудов, полостей тела, обеспечивая таким образом диссеминацию опухоли. За редким исключением все злокачественные опухоли могут метастазировать. Исключение представляют злокачественные опухоли ЦНС из глиальных клеток – глиомы, и базальноклеточные карциномы кожи. Оба вида опухолей локально инвазивны, но редко метастазируют.
Пути метастазирования
Пути диссеминации опухоли включают:
Прямое распространение по поверхности тела и полостей.
Такой путь характерен для опухолей, расположенных на поверхности кожи и слизистых (пенетрация на «открытом поле»). При этом в процесс распространения метастазов вовлекаются брюшная полость и др. (плевра, перикард, субарахноидальное пространство, поверхность суставов). Такой тип метастазирования характерен для карцином, происходящих из яичников.
