
O |
C |
O |
C |
|
|
NH-NH2 |
|
NH-NH2 |
|
|
. . |
+ CuSO4 |
|
Cu2+ SO42- |
|
|
|
N |
N |
2 |
|
. . |
Далее при нагревании происходит окислительно-восстанови- тельная реакция за счет гидразина. Гидразин окисляется до молекулярного азота (выделяются пузырьки газа), раствор и осадок становятся светло-зеленого, а затем желто-зеленого цвета за счет восстановления меди до Cu2O.
O |
|
|
|
O |
C |
|
|
|
C |
NH-NH |
2 |
|
o |
OH |
. . |
|
|
||
|
2+ |
SO4 |
2- H2O, t C |
+1 |
|
Cu |
2 |
+ Cu2O + N |
|
|
|
|
2 |
|
N |
2 |
|
|
N |
. . |
|
|
|
2. Реакция расщепления пиридинового цикла с 2,4-динитро- хлорбензолом. Пиридиновое кольцо устойчиво к действию водных растворов кислот и оснований, однако соли пиридиния, содержащие электроноакцепторные группы, легко расщепляются в присутствии щелочи.
Появляется буро-красное окрашивание, быстро переходящее в красновато-коричневое.
|
|
O |
|
|
|
|
|
C |
|
|
|
O |
|
NH-NH2 |
|
|
|
C |
Cl |
|
|
|
|
NH-NH2 |
|
|
|
|
|
+ |
NO2 C H OH |
N + |
Cl |
- |
NaOH |
2 5 |
|
||||
N |
|
NO2 |
|
|
|
|
NO2 |
|
|
|
|
|
|
NO2 |
|
|
|
79
C |
O |
C |
O |
C |
O |
|
OH |
OH |
OH |
||||
|
|
|
||||
|
OH |
|
O |
|
O |
|
N |
NH |
|
N |
|
||
H |
H |
H |
||||
|
|
|
||||
|
NO2 |
|
NO2 |
|
NO2 |
|
NO2 |
|
NO2 |
|
|
|
|
|
|
|
NaO |
N |
O |
||||
|
|
|
|
|
|
|
||
Расщепление пиридинового кольца происходит с образованием производного глутаконового альдегида и динитрофениланилина.
|
C |
O |
NH2 |
|
OH |
||
|
|
NO2 |
|
|
|
|
|
C |
|
O |
+ |
H |
C |
|
|
HO |
H |
|
|
|
|
||
|
|
|
|
|
|
|
NO2 |
3. Реакция с аммиачным раствором серебра нитрата. Вначале образуется желтоватый осадок серебряной соли изониазида.
|
O |
|
O |
|
Ag |
|
|
||||
C |
C |
||||
|
NH-NH2 |
|
N-NH2 |
||
|
+ AgNO3 |
|
|
|
|
+ HNO3 |
|
|
|
|
|||
N |
|
N |
||||
Далее при нагревании происходит гидролиз изониазида, образование гидразина, который восстанавливает Ag+ до металлического серебра (темный осадок или серебряное зеркало на стенках пробирки). Гидразин при этом окисляется до молекулярного азота.
80
O |
|
Ag |
O |
|
|||
C |
C |
||
N-NH2 |
ONH4 |
||
|
H2O, NH3, toC |
|
|
+ Ag |
|
+ N2 |
|
|
|
|
|||
|
|
|
|
|
||
N |
|
|
N |
|||
Количественное определение
Йодометрический метод, вариант обратного титрования.
Метод основан на окислении йодом гидразина, который образуется при гидролизе изониазида. Гидролиз проводят в присутствии натрия
гидрокарбоната, при нагревании до 40 С. Титранты – I2, Na2S2O3.
O |
O |
C |
C |
NH-NH2 |
ONa |
|
+ NaHCO3 |
40 oC |
|
|
+ |
NH2-NH2 + CO2 |
|
|
|
|
|||||
|
|
|
|
|
|||
N |
|
|
|
N |
|
||
Гидразин окисляется йодом до молекулярного азота. NH2-NH2 + 2I2 + 4NaHCO3 = N2 + 4NaI + 4CO2 + 4H2O
2N 2 – 4e = N20, fэкв. = 1/4.
Избыток йода титруется натрия тиосульфатом. I2 + 2Na2S2O3 = 2NaI + Na2S4O6
81
Анализ лекарственных препаратов, производных тропана и экгонина
Лекарственные препараты, производные тропана и экгонина
Атропина сульфат, скополамина гидробромид, гоматропина гидробромид, тропацин, тропафен, кокаина гидрохлорид.
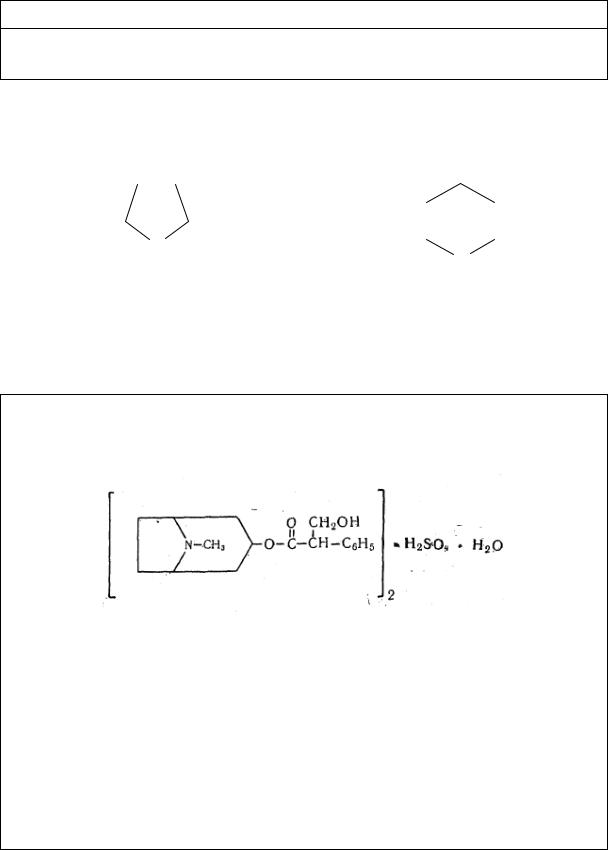
Атропина сульфат производное тропана. Тропан – бициклическая система, содержащая пятичленный пирролидиновый и шестичленный пиперидиновый циклы.
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
||
|
N |
||||
|
H |
|
|||
|
|
|
|
H |
|
Пирролидин |
Пиперидин |
||||
Анализ качества атропина сульфата
Atropini sulfas Атропина сульфат (ГФ Х, с. 109)
Atropinum sulfuricum
Тропинового эфира d,l-троповой кислоты сульфат
(C17H23NО3)2 H2SО4 Н2О, М.в. 694,8
Описание. Белый кристаллический или зернистый порошок без запаха.
Растворимость. Легко растворим в воде и спирте, практически нерастворим в хлороформе и эфире.
Подлинность. 0,01 г препарата смачивают в фарфоровой чашке 1 мл концентрированной азотной кислоты и выпаривают на водяной бане досуха. К остатку прибавляют несколько капель 0,5 н. спиртового раствора едкого кали и ацетона; появляется фиолетовое окрашивание, исчезающее при стоянии.
82

0,2 г препарата растворяют в 12 мл воды, прибавляют 4 мл раствора аммиака; после потирания о стенки сосуда стеклянной палочкой выпадает осадок основания атропина. Осадок отфильтровывают, промывают водой и сушат в эксикаторе над серной кислотой. Температура плавления выделенного основания 115–117°.
Раствор 0,05 г препарата в 2 мл воды дает характерную реакцию на сульфаты (с. 746).
Температура плавления 187–191° (метод 1а, сушат в течение
15 минут при 135°).
Угол вращения не более –0,6° (5 % водный раствор, в трубке длиной 2 дм).
Кислотность. 0,2 г препарата растворяют в 5 мл свежепрокипяченной и охлажденной воды, прибавляют 1 каплю раствора метилового красного. Если появляется красное окрашивание, оно должно переходить в желтое от прибавления не более 0,05 мл 0,05 н. раствора едкого натра.
Апоатропин. 0,2 г препарата растворяют в 12 мл воды и прибавляют 4 мл раствора аммиака; тотчас же после осторожного перемешивания не должно наблюдаться помутнения.
Органические примеси. Раствор 0,02 г препарата в 2 мл концентрированной серной кислоты должен быть бесцветным.
Потеря в весе при высушивании. Около 0,5 г препарата
(точная навеска) сушат при 100–105° до постоянного веса. Потеря в весе не должна превышать 3 %.
Сульфатная зола из 0,5 г препарата не должна превышать 0,1 %.
Количественное определение. Около 0,5 г высушенного при
100–105° до постоянного веса препарата (точная навеска) растворяют в 10 мл безводной уксусной кислоты при слабом нагревании на водяной бане. К охлажденному раствору прибавляют 3 капли раствора кристаллического фиолетового и титруют 0,1 н. раствором хлорной кислоты до ясного зеленого окрашивания.
Параллельно проводят контрольный опыт.
1 мл 0,1 н. раствора хлорной кислоты соответствует 0,06768 г (C17H23NО3)2 H2SО4, которого в высушенном препарате должно быть не менее 99,0 %.
Хранение. Список А. В хорошо укупоренной таре.
Высшая разовая доза внутрь и под кожу 0,001 г. Высшая суточная доза внутрь и под кожу 0,003 г.
Холинолитическое (спазмолитическое, мидриатическое) средство.
83
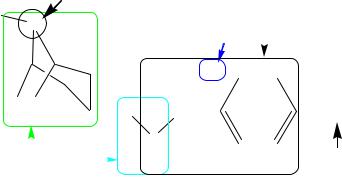
Фармакопейный анализ атропина сульфата
Тропинового эфира d,l-троповой кислоты сульфат.
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
N |
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
O |
CH2OH |
|
|
|
|
|
|
|
x H2SO4 xH2O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
1 |
3 |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
5 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
(C17H23NO3)2 H2SO4 H2O |
|
|
М. в. = 694,8 |
|
|
|||||||||||||||||||||
1.Тропан.
2.Третичный атом азота (основный центр).
3.Сложноэфирная группа (СЭГ).
4.Спиртовой гидроксил.
5.Сульфат-ион.
6.Остаток троповой кислоты.
Подлинность
1.ИК-спектр поглощения препарата, снятый в вазелиновом масле в области 4000–400 см 1 должен полностью совпадать со спектром стандарта.
2.УФ-спектр водного раствора препарата в области 250 300 имеет максимум поглощения при 252, 257, 264 нм.
3.Температура плавления 187 191 С (после высушивания в течение 15 мин при 135 С).
4.ГФ Х. Препарат должен представлять собой рацемическую d и l-изомеров эфиров троповой кислоты. Угол вращения не более – 0,6º (5 %-й водный раствор, в трубке длиной 2 дм).
Химические реакции
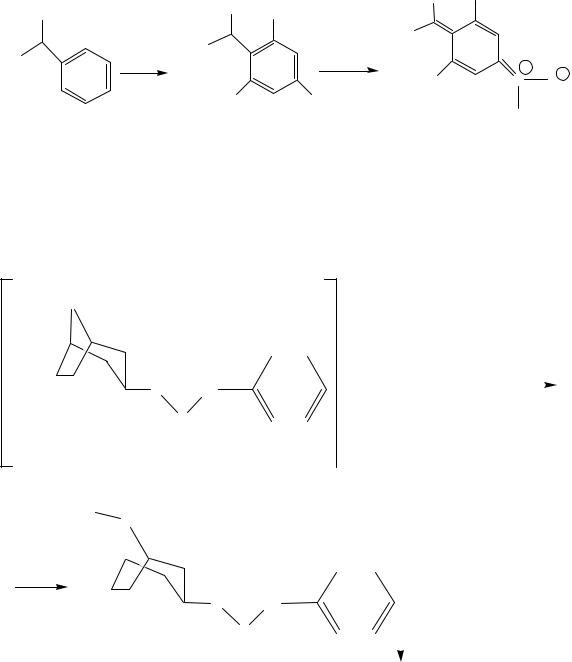
1. Реакция Витали Морена. Дают все производные тропана, кроме гоматропина гидробромида, что позволяет отличать его от других производных тропана.
Реакция основана на гидролизе сложноэфирной группы под действием азотной кислоты: при этом образуется свободная троповая кислота и спирт. Кислота нитруется за счет фенильного радикала и в среде калия гидроксида дает окрашенную в фиолетовый цвет аци-соль:
84
|
|
CH2OH |
CH2OH |
NO2 |
|
|
CH2OH |
NO2 |
|
|
|
|
|
|
|
||
|
|
|
KOOC |
|
|
|
|
HOOC |
2 KOH |
|
|
HOOC |
|
3 HNO3 |
N+ |
_ |
|
|
|
|
|||
|
|
- 3 H2O |
O2N |
O |
|
|
|
NO2 |
|
|
|
|
|
O2N |
OK |
|
|
|
|
|
|
|
2. Реакции вытеснения органических оснований из растворов при действии раствора аммиака или натрия гидроксида.
К раствору атропина сульфата прибавляют раствор аммиака, постепенно! выпадает основание атропина, осадок фильтруют, высушивают над серной кислотой в эксикаторе и определяют темпера-
туру плавления основания атропина (115 117 ºС).
H3C  N
N
|
|
O |
|
|
CH2OH |
|
|
|
|
|
|
|
x H2SO4 xH2O |
NH4OH |
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
CH |
|
|
|
|
|
|
|
|
||||||||
|
|
|
C |
|
|
|
|
|
2 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H3C |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2 |
|
|
|
|
|
|
|
|
CH2OH |
|
|
|
|
|
+ NH4HSO4 + 2H2O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
O |
CH |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Реакция на сульфат-ион: к водному раствору препарата добавляют раствор хлорида бария, образуется белый осадок нерастворимый в минеральных кислотах и щелочах.
SO42 + BaCl2 = BaSO4 + 2Cl
Нефармакопейные реакции
4. ВР-2007. Реакция на третичный атом азота с общеалкалоидными реактивами (пикриновой кислотой). Образуется осадок, его
85
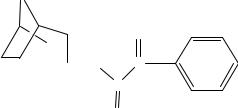
промывают, сушат и определяют температуру плавления пикрата атропина. Температура плавления 174 179 °C.
5. ВР-2007. Реакция на алкалоиды с K[BiI4] реактивом Драгендорфа. Образуется оранжевый или оранжево-красный осадок. Реакция основана на основных свойствах препарата за счет третичного азота.
Чистота
Кислотность, рН водного раствора от 4,5 до 6,2.
Апоатропин – образуется при дегидратации атропина. По ГФ Х испытание проводится с раствором аммиака, НЕ должно быть помутнения, так как в присутствии примеси осадок образуется сразу, а основание атропина из соли выпадает постепенно.
H3C  N
N
CH2

 O C
O C
C
O
ВР-2007 предлагает для определения апоатропина использовать спектрофотометрический метод. Удельное поглощение раствора препарата в HCl при 245 нм в пересчете на сухое вещество должно быть не более 4,0.
ВР-2007. Посторонние алкалоиды и продукты разложения определяют методом ТСХ.
Потеря в весе при высушивании (не более 3 %). Сульфатная зола (не более 0,1 %).
Количественное определение
Ацидиметрия – метод неводного титрования в среде прото-
генного растворителя. Метод основан на усилении слабых основных свойств препарата в среде неводного растворителя.
При титровании атропина сульфата образуются две соли гидросульфат и перхлорат.
Титрант – НСlO4,
индикатор кристаллический фиолетовый.
86
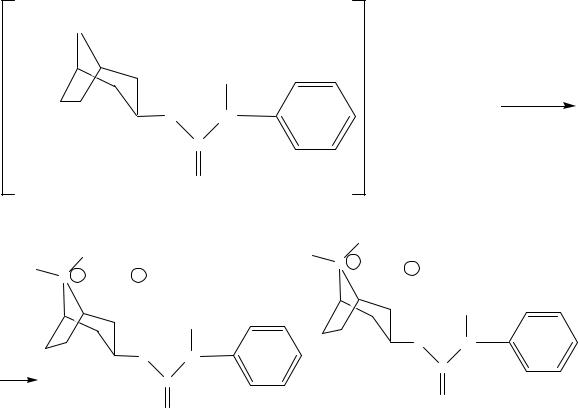
Растворитель – безводная уксусная кислота.
H3C  N
N
|
|
|
CH2OH |
|
|
|
|
|
|
O |
CH |
|
|
x H2SO4 + HClO4 |
|
|
|
|
C |
|
|
|
|
|
|
|
O |
|
|
2 |
|
|
|
H |
|
|
|
H |
|
|
|
|
H3C |
N + |
_ |
|
|
H3C |
N + |
_ |
|
|
|
||
|
|
|
x HSO4 |
|
|||
|
x ClO4 |
|
|
|
|
||
|
|
|
CH2OH |
|
|
|
CH2OH |
|
|
|
|
|
|
|
|
|
|
O |
CH |
|
+ |
O |
CH |
|
|
|
|
C |
|||
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
O |
|
|
|
|
|
|
|
|
Параллельно проводят контрольный опыт, содержание не ме- |
|||||||
нее 99 %. |
|
|
|
|
|
|
|
fэкв (атропина сульфата) = 1. |
|
|
|
|
|||
87

Определение качества лекарственных средств из группы производных хинолина и хинуклидина
Лекарственные препараты, производные хинолина
Производные 4-замещенных хинолина: хинина гидрохлорид,
хинина дигидрохлорид, хинина сульфат, хинидина сульфат; хлорохина фосфат (хингамин), гидроксихлорохина сульфат (плаквенил).
Производные 8-оксихинолина: хинозол, нитроксолин (5-НОК),
хлор-хинальдол.
Фторхинолоны: ломефлоксацин, офлоксацин, ципрофлоксацин.
Хинолины – ароматические 10π-электронные гетероциклические соединения, в которых пиридиновое кольцо сконденсировано с бензольным. Изохинолин – изомер хинолина, отличающийся положением атома азота.
|
N |
N |
|
Хинолин |
Изохинолин |
Анализ качества хинина сульфата
Chinini sulfas Хинина сульфат Quinine Sulfate
(ГФ Х с. 176)
Quinini Sulfas*
(C20H24N2O2)2 H2SО4 2H2О, М.в. 783,0
88
