
|
CH2OH |
|
|
|
Cl |
|||||||||
HO |
|
|
|
CH2OH |
|
|
|
|||||||
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||
H3C |
|
|
|
* HCl + Cl |
|
N |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||||||
N |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|||||||||
Cl
CH2OH
HO
 CH2OH
CH2OH
+ 2 HCl
H3C N
N N
N

 Cl
Cl
 O
O
Cl
2. Реакция комплексообразования на фенольный гидроксил. Появляется красное окрашивание, при добавлении разведенной серной кислоты комплекс разрушается, окраска исчезает.
|
CH OH |
|
|
|
CH2OH |
||||||
|
|
2 |
|
|
|
|
Cl |
|
|
|
CH2OH |
|
|
|
|
|
|
|
|
|
|||
HO |
|
|
|
CH2OH |
|
|
Fe-O |
|
|
|
|
|
|
|
|
* HCl + FeCl |
3 |
|
Cl |
|
|
|
+ HCl |
H3C |
|
|
|
|
H3C |
|
|
|
|||
N |
|
|
N |
||||||||
Нефармакопейные реакции
3.Реакция на хлорид-ион, образование белого осадка хлорида серебра при добавлении AgNO3.
4.Реакция азосочетания с солями диазония (по 6 положению).
5.Реакции на третичный атом азота с общеалкалоидными реактивами.
Чистота
Специфическая примесь метиловый эфир пиридоксина (побочный продукт синтеза) по реакции с 2,6-дихлорхинонхлоримидом в присутствии бутанола.
69
CH2OCH3
HO  CH2OH
CH2OH
H3C
 N
N
метиловый эфир пиридоксина
В слое бутилового спирта не должно появляться голубое окрашивание. Пиридоксина гидрохлорид предварительно связывают борной кислотой в комплексное соединение, растворимое в воде. Так как в метиловом эфире пиридоксина нет соседних свободных ОН-групп, реакция с 2,6-дихлорхинонхлоримидом не идет.
|
|
CH2OH |
|
|
CH2O |
|
|
|
|
|
OCH2 |
|||||||
|
|
|
|
|
B O |
|
||||||||||||
HO |
|
|
|
CH2OH |
|
HOH2C |
|
|
O |
|
|
|
|
CH2OH |
||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|||||||||||||||
H3C |
|
|
|
+ H3BO3 |
|
|
|
|
|
CH3 H3C |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
N |
|
|
N |
N |
||||||||||||||
Количественное определение
1. Ацидиметрический метод неводного титрования. Метод основан на слабых основных свойствах пиридинового атома азота, которые усиливаются при растворении препарата в протогенном растворителе, ледяной СН3СООН. Ацетат окисной ртути добавля-
ют для связывания хлорид-ионов.
Титрант – HClO4, Индикатор кристаллический фиолетовый,
fэкв(ЛВ) = 1.
CH2OH
HO
 CH2OH
CH2OH
* HCl + HClO4 + Hg(CH3COO)2
H3C
 N
N
|
|
CH2OH |
|
|
||||
HO |
|
|
|
CH2OH |
|
ClO4- |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
H3C |
|
|
|
+ HgCl2 |
+ CH3COOH |
|||
N + |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|||||
70
2. Алкалиметрический метод, вариант вытеснения. Метод ос-
нован на реакции вытеснения слабого органического основания пиридоксина сильным основанием NaOH. Титрант – NaOH, индика-
тор бромтимоловый синий.
fэкв = 1.
|
|
CH2OH |
|
|
|
CH2OH |
||||
HO |
|
|
|
CH2OH |
|
HO |
|
|
|
CH2OH |
|
|
|
|
|
|
|
||||
H3C |
|
|
|
* HCl + NaOH |
|
H3C |
|
|
|
+ NaCl + H2O |
|
|
|
|
|
|
|
||||
N |
|
N |
||||||||
Анализ качества кислоты никотиновой
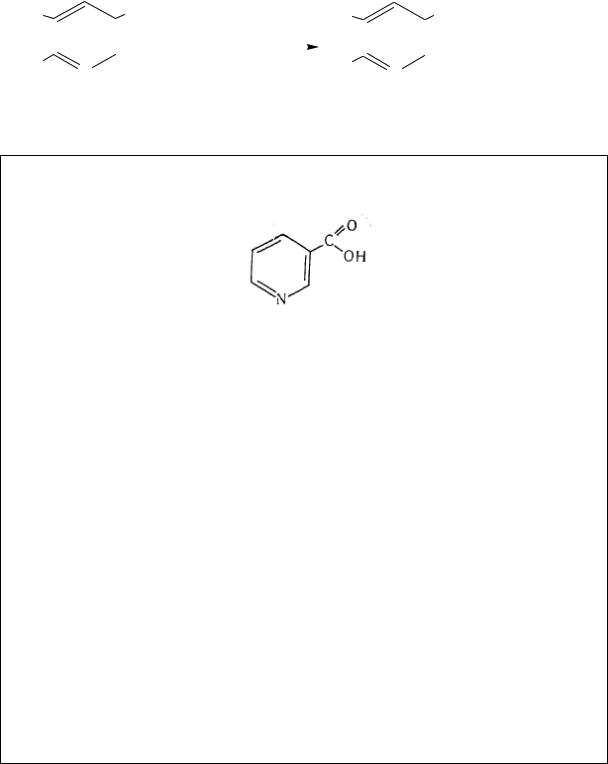
Acidum nicotinicum Кислота никотиновая (ГФ Х, с. 56)
Пиридинкарбоновая-3 кислота
C6H5NО2, М. в. 123,11
Описание. Белый кристаллический порошок без запаха, слабокислого вкуса.
Растворимость. Трудно растворим в воде и 95 % спирте, растворим в горячей воде, очень мало растворим в эфире.
Подлинность. 0,1 г препарата нагревают с 0,1 г безводного карбоната натрия; развивается запах пиридина.
К3 мл теплого раствора препарата (1:100) приливают 1 мл раствора сульфата меди; выпадает осадок синего цвета.
К10 мл такого же раствора прибавляют 0,5 мл раствора сульфата меди и 2 мл раствора роданида аммония; появляется зеленое окрашивание.
Температура плавления 234–238°.
Прозрачность и цветность раствора. 0,2 г препарата рас-
творяют при нагревании в 10 мл воды; раствор должен быть прозрачным и бесцветным.
Хлориды. 0,25 г препарата растворяют в 25 мл воды. 10 мл этого раствора должны выдерживать испытание на хлориды (не более 0,02 % в препарате).
71

Сульфаты. 10 мл того же раствора не должны давать реакцию на сульфаты.
Нитраты. К 0,01 г препарата прибавляют 2 мл раствора дифениламина; не должно появляться голубое окрашивание.
2,6-Пиридин-дикарбоновая кислота. 0,1 г препарата раство-
ряют в 10 мл воды, прибавляют 0,5 мл свежеприготовленного 5 % раствора сульфата закиси железа. Окраска раствора не должна быть интенсивнее эталона № 5а.
Потеря в весе при высушивании. Около 0,5 г препарата
(точная навеска) сушат при 100–105° до постоянного веса. Потеря в весе не должна превышать 0,5 %.
Сульфатная зола и тяжелые металлы. Сульфатная зола из
0,5 г препарата не должна превышать 0,1 % и должна выдерживать испытание на тяжелые металлы (не более 0,001 % в препарате).
Количественное определение. Около 0,3 г препарата (точная навеска) помещают в коническую колбу емкостью 100 мл, растворяют в 25 мл свежепрокипяченной горячей воды и по охлаждении титруют 0,1 н. раствором едкого натра до не исчезающего в течение 1–2 минут розового окрашивания (индикатор фенолфталеин).
1 мл 0,1 н. раствора едкого натра соответствует 0,01231 г C6H5NО2, которой в препарате должно быть не менее 99,5 % в пересчете на сухое вещество.
Хранение. Список Б. В хорошо укупоренной таре, предохраняющей от действия света.
Высшая разовая доза внутрь 0,1 г. Высшая суточная доза внутрь 0,5 г.
Высшая разовая доза в вену (в виде натриевой соли) 0,1 г. Высшая суточная доза в вену 0,3 г.
При приеме внутрь разовая доза может быть постепенно увеличена (при отсутствии побочных явлений) до 0,5–1 г, а суточная доза – до 3–5 г.
Витаминный препарат комплекса В; сосудорасширяющее и гипохолестеринемическое средство.
Фармакопейный анализ кислоты никотиновой
O |
|
|
C |
|
карбоксильная группа |
|
OH |
|
|
|
N  пиридин
пиридин
72
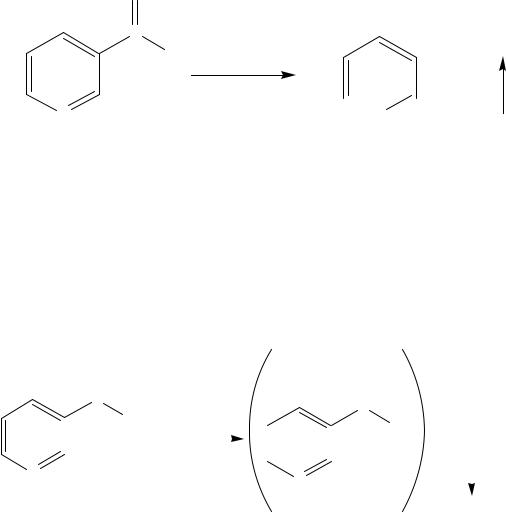
Подлинность
1.ИК-спектр, снятый в таблетках с бромидом калия, должен иметь полное совпадение полос поглощения и их интенсивности
сприлагаемыми к ФС рисунками спектров.
2.УФ-спектр 0,002 % раствора в 0,1 М растворе гидроксида натрия должен иметь в области 230 320 нм максимумы поглощения при 258, 264, 270 нм; минимум поглощения при 240 нм и два плеча в
области 240 258 нм.
3. ГФ Х. Температура плавления 234 238 С.
Химические реакции
1. ГФ Х. Реакция декарбоксилирования (нагревание с натрия карбонатом кристаллическим). Развивается характерный запах пиридина.
O
C
OH Na2CO3,to
+ CO2
N  N
N 
характерный
запах
пиридина
2. Реакция комплексообразования с солями Cu2+ по карбоксильной группе. К теплому раствору кислоты никотиновой прибавляют раствор меди сульфата (II). Выпадает синий осадок никотината меди.
|
O |
|
|
|
|
O |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
C |
|
|
||||
|
|
|
OH |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
O- |
Cu2+ |
+ H2SO4 |
|
|
||||||||||||
|
|
|
+ CuSO4 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||
N |
|
|
|
|
|
|
|
|
|
|||
|
|
|
N |
|
|
|||||||
|
|
|
|
|
никотинат меди |
2 |
|
|||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
осадок синего цвета |
|
|
|||||
73
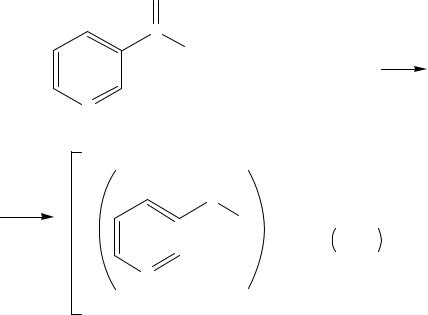
3. Реакция комплексообразования, образуются комплексные соли по типу аммиакатов. К водному раствору препарата прибавляют раствор меди сульфата (II) и раствор роданида аммония NH4SCN. Появляется устойчивое зеленое окрашивание.
O
C
OH
+ CuSO4 + 2NH4SCN
N
|
O |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
||
|
|
|
OH |
2+ |
|
|
+ (NH4)2SO4 |
|
|
|
|
||||||
|
|
|
|
Cu |
SCN |
2 |
||
N |
4 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
зеленое окрашивание
Нефармакопейные реакции
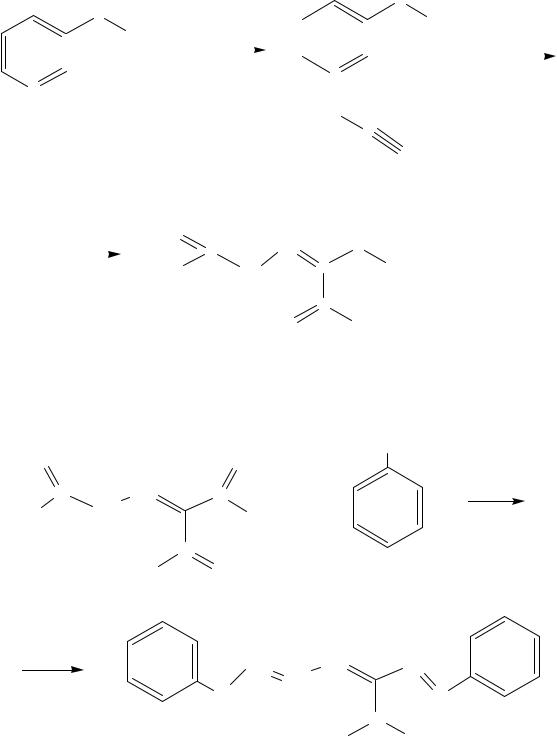
4. ВР-2007. Реакция расщепления пиридинового кольца в присутствии бромродана (тиоцианата брома) или бромциана (цианата брома) и анилина.
Пиридиновое кольцо устойчиво к действию водных растворов кислот и оснований, однако соли пиридиния, содержащие электроноакцепторные группы, легко расщепляются в присутствии щелочи. Такие соли пиридиния образуются при действии бромродана или бромциана.
Сначала получают тиоцианат брома при добавлении к бромной воде тиоцианата аммония до обесцвечивания.
Br2 + NH4SCN = BrSCN + NH4Br
При действии бромродана на кислоту никотиновую образуется производное пиридина, содержащее сильный электроноакцепторный заместитель (SСN). Далее происходит расщепление пиридинового кольца с образованием производного глутаконового альдегида.
HO-CH=CH-CH=CH-CHO – глутаконовый альдегид.
74
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|||
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
_ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
+ BrSCN |
|
|
|
|
|
|
+ |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|||
N |
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||||
|
NaOH |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
C |
|||||||||||||||
|
|
|
|
|
|
C |
|
|
|
|
|||||||||||||
_ |
2H2O |
|
|
|
H |
CH2 |
|
|
|
C |
|
|
|
|
|
H + NH4SCN + HBr |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
C
O OH
Глутаконовый альдегид вступает в реакцию конденсации с ароматическим амином анилином. Образуется основание Шиффа, окрашенное в желтый цвет.
O |
|
O |
NH2 |
|
|
||
C |
CH |
C |
+ 2 |
H |
CH2 |
H |
|
|
|
C |
|
|
HO |
O |
|
CH |
CH |
CH |
NH |
CH |
N |
|
C
HO  O
O
Чистота
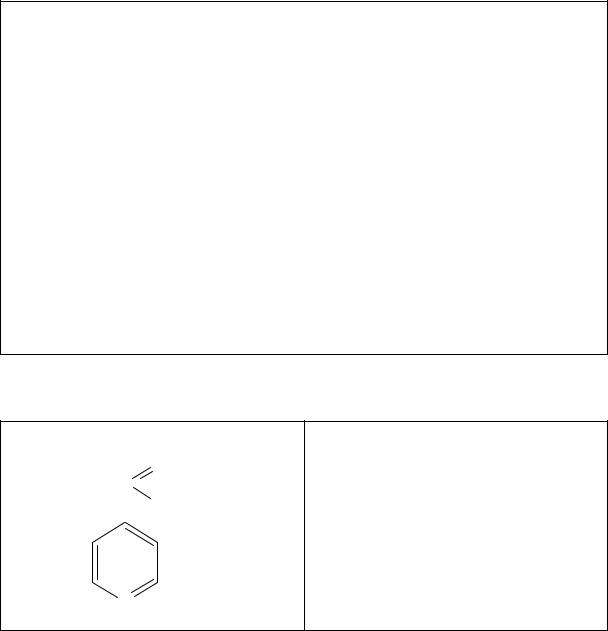
Специфическую примесь 2,6-пиридин-дикарбоновую кислоту определяют по реакции с сульфатом железа (II).
75
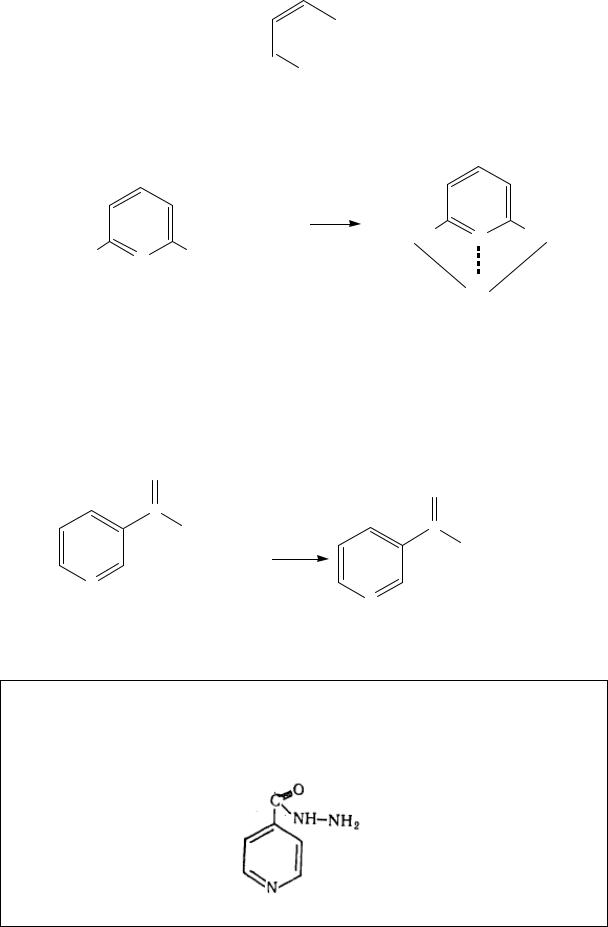
6 2 

HOOC N
N COOH
COOH
Реакция основана на свойстве пиридин-дикарбоновых кислот образовывать с Fe2+ окрашенные комплексные соединения. Окраска раствора не должна быть интенсивнее эталона.
|
|
+ FeSO4 |
6 |
|
2 |
6 |
2 |
OOC |
N |
COO |
|
HOOC |
N |
COOH |
|
|
|
Fe
Количественное определение
Алкалиметрия, вариант нейтрализации. Метод основан на кис-
лотных свойствах никотиновой кислоты.
Титрант – 0,1 М NaOH.
Индикатор – фенолфталеин, титруют до розового окрашивания. f = 1.
O
|
|
O |
C |
|
|
OH |
|
C |
|
+ NaOH |
ONa |
|
+ H2O |
|
N |
|
|
|
|
|
|
|
N |
Анализ качества изониазида
Isoniazidum – Изониазид (ГФ Х, с. 378)
Tubazidum
Тубазид Гидразид изоникотиновой кислоты
C6H7N3О, М. в. 137,14
76

Описание. Белый кристаллический порошок без запаха, горького вкуса.
Растворимость. Легко растворим в воде, трудно растворим в 95 % спирте, очень мало растворим в хлороформе, практически нерастворим в эфире.
Подлинность. 0,1 г препарата растворяют в 5 мл воды и прибавляют 4–5 капель раствора сульфата меди; выделяется голубой осадок; при встряхивании раствор окрашивается также в голубой цвет. При нагревании раствор и осадок становятся светло-зеле- ного, а затем желто-зеленого цвета и выделяются пузырьки газа.
К нескольким кристаллам препарата прибавляют 0,05 г 2,4-ди- нитрохлорбензола, 3 мл 95 % спирта и кипятят 1–1½ минуты. После охлаждения прибавляют 2 капли раствора едкого натра; появляется буро-красное окрашивание, быстро переходящее в крас- новато-коричневое.
0,01 г препарата растворяют в 2 мл воды и прибавляют 1 мл аммиачного раствора нитрата серебра; появляется желтоватый осадок, который при нагревании на водяной бане темнеет и на стенках пробирки образуется серебряное зеркало.
Температура плавления 170–174°.
Прозрачность и цветность раствора. Раствор 0,5 г препара-
та в 10 мл свежепрокипяченной и охлажденной воды должен быть прозрачным и бесцветным.
Щелочность или кислотность. Тот же раствор после прибав-
ления 5 капель раствора фенолфталеина должен быть бесцветным. Розовое окрашивание должно появиться от прибавления не более 0,1 мл 0,1 н. раствора едкого натра.
Хлориды. 0,5 г препарата растворяют в 25 мл воды. 10 мл этого раствора должны выдерживать испытание на хлориды (не более 0,01 % в препарате).
Сульфаты. 10 мл того же раствора должны выдерживать испытание на сульфаты (не более 0,05 % в препарате).
Потеря в весе при высушивании. Около 0,5 г препарата
(точная навеска) сушат при 100–105° до постоянного веса. Потеря в весе не должна превышать 0,5 %.
Сульфатная зола и тяжелые металлы. Сульфатная зола из
0,5 г препарата не должна превышать 0,1 % и должна выдерживать испытание на тяжелые металлы (не более 0,001 % в препарате).
Количественное определение. Около 0,1 г препарата (точная навеска) помещают в коническую колбу емкостью 500 мл с притертой пробкой, растворяют в 100 мл воды, прибавляют 2 г гидрокарбоната натрия, 50 мл.
77
0,1 н. раствора йода и оставляют на 30 минут при 38–40° в темном месте. После этого ставят на 10 минут в баню со льдом и затем прибавляют небольшими порциями 20 мл смеси 1 объема концентрированной соляной кислоты с 2 объемами воды (при охлаждении раствора). Избыток йода оттитровывают 0,1 н. раствором тиосульфата натрия (индикатор – крахмал).
Параллельно проводят контрольный опыт.
1 мл 0,1 н. раствора йода соответствует 0,003428 г C6H7N3O, которого в препарате должно быть не менее 98,0 %.
Хранение. Список Б. В хорошо укупоренных банках оранжевого стекла, в защищенном от света месте.
Высшая разовая доза внутрь 0,6 г. Высшая суточная доза внутрь 0,9 г.
Противотуберкулезное средство.
Фармакопейный анализ изониазида
Химическая структура |
Функциональные группы |
|
|
|
|
|
O |
1) Гидразидная группа |
C |
2) Третичная аминогруппа |
|
|
NH-NH2 |
|
|
|
|
N
Подлинность
1.Определяют температуру плавления.
2.ИК-спектр препарата должен полностью совпадать со спектром стандарта.
3.УФ-спектр препарата имеет характерные максимумы и мини-
мумы.
Химические реакции
1. Реакция с сульфатом меди (II). Реакция идет в две стадии – сначала образуется комплексное соединение выделяется голубой осадок; при встряхивании раствор окрашивается в голубой цвет.
78
