
Лекции / Kurs_lektsiy_po_patofiziologii_Ch_1_2018_1
.pdfфорно-кальциевыми солями); 8) реканализация (прорастание омертвевших тканей вновь образованными микрососудами).
Современным методом диагностики и прогноза различных, в том числе, деструктивных, заболеваний, а также контроля за эффективно-
стью их лечения является биопсия органов, т.е. прижизненное взятие поврежденных и живых кусочков ткани на гистологический анализ.
2.2. Апоптоз и его роль в патологии
Понятие «апоптоз» было обстоятельно сформулировано Вилли только в 1980 г. Данное понятие было связано с деградацией хроматина, катализируемой эндонуклеазами. Биохимически активный характер апоптоза подтвержден в лаборатории этого автора в 1984 г., где была показана значимость макромолекулярного синтеза для реализации процесса апоптоза. В 1987 г. Вилли сформулировал четыре основных элемента апоптоза: 1) уменьшение объема апоптотирующей клетки; 2) конденсация и фрагментация хроматина на ранних стадиях апоптоза с формированием, так называемых, апоптотических телец; 3) изменение мембраны апоптотирующей клетки, приводящее к распознаванию ее фагоцитами; 4) сопряженность апоптоза с активным белковым синтезом.
Возникшее с конца 1980-х годов большое внимание к апоптозу стало в последние годы XX века и первые годы XXI века всеобщим, особенно в связи с тем, что появились методические возможности регистрации различных проявлений апоптоза и анализа его молекулярных механизмов. Изучение апоптоза оказалось очень продуктивным для понимания ряда жизненно важных явлений и процессов, включая индивидуальное развитие организма, иммунный гомеостаз и онкогенез. В связи с развитием учения об апоптозе возникла необходимость пересмотра концептуальных основ не только физиологии, но и патологии. Вместо прежних представлений о гибели клеток многоклеточного организма как отрицательном биологическом явлении, идентифицируемом с некрозом, сформировался новый взгляд, согласно которому гибель части клеток в пределах организма является закономерным и необходимым гомеостатическим процессом, обусловленным апоптозом. Само существование многоклеточного организма подразумевает баланс жизни и смерти на уровне составляющих его клеточных популяций. В нормальных условиях в процессе жизни
229
многоклеточного организма отмечаются два взаимо-уравновешенных процесса: гибель и пролиферация клеток, что обеспечивает сохранение постоянства клеточного состава данного организма.
2.2.1. Определение понятия «апоптоз»
Апоптоз, или запрограммированная (контролируемая) клеточная гибель, представляет собой активную форму гибели клетки многоклеточного организма, являющуюся результатом реализации ее генетической программы в ответ на внешние и / или внутренние сигналы и требующую затрат энергии и синтеза макромолекул de novo.
Морфологически апоптоз проявляется в уменьшении размера клетки, конденсации и фрагментации хроматина, уплотнении плазматической
идругих мембран клетки без выхода содержимого последней в окружающую (внеклеточную) среду.
2.2.2.Роль апоптоза в жизни здорового организма
Вмногоклеточном организме апоптоз является повсеместно и постоянно происходящим процессом.
Апоптоз играет ключевую роль в эмбриональном развитии, процессе метаморфоза, нормальном обновлении тканей. Благодаря апоптозу обеспечивается возрастная инволюция тимуса, половых желез, гепатоцитов, нейронов, костей, некоторых иммунных процессов
ит.д. В частности, с помощью апоптоза из организма удаляются нежелательные или потенциально опасные клетки, например, аутореактивные Т-лимфоциты, инфицированные вирусами клетки, опухолевые клетки и т.д. Цитотоксические Т-лимфоциты и натуральные киллеры (NK) осуществляют элиминацию аллогенных и злокачественно трансформированных клеток путем индукции в них апоптоза. Апоптоз может нести ответственность и за ослабление или прекращение иммунных реакций.
Доказана роль апоптоза в развитии старения. Нарушение процесса физиологической клеточной гибели может привести к развитию патологических состояний и заболеваний, проявлениями которых могут быть как дегенеративные, так и пролиферативные изменения. В частности, активация апоптоза является одним из патогенетических звеньев СПИДа, нейродегенеративных и миелодиспластических про-
230
цессов, ишемических поражений тканей и органов. Ингибирование апоптоза лежит в основе развития опухолей, ряда аутоиммунных и вирусных заболеваний. В последние годы выявлена роль апоптоза как патогенетического фактора в развитии атеросклероза, инфаркта миокарда, травм, ишемии / реперфузии и др. Изучение роли апоптоза в развитии различных видов патологии может дать возможность его направленной коррекции и повысить тем самым эффективность лечения многих заболеваний.
Тонкий, строго контролируемый баланс процессов апоптоза, пролиферации, дифференцировки и стабильного функционирования клеток (адгезии, передвижения и т.д.) рассматривается не только как ведущий механизм клеточного гомеостаза на уровне целостного многоклеточного организма, но и как главное условие его нормальной жизни. Показано, что роль апоптоза в популяциях неделящихся или слабо делящихся клеток минимальна или незначительна. В то же время в популяциях интенсивно делящихся клеток роль апоптоза огромна в силу того, что процесс апоптоза уравновешивает процессы пролиферации и дифференцировки клеток и поддерживает необходимую численность клеточной популяции.
Принято считать, что интенсивность апоптоза наиболее высока в период эмбриогенеза. В последующие периоды онтогенеза она снижается и достигает минимума в старости, сохраняясь лишь в тканях с интенсивно делящимися клетками (гемопоэтическая ткань костного мозга, ворсинки слизистой тонкого кишечника и др.). Чем плотнее контакты между клетками и с межклеточным матриксом, тем слабее выражен их апоптоз, и наоборот. Установлено, что в обеспечении межклеточных контактов важная роль принадлежит мембранным ФАВ – интегринам. Среди ФАВ, защищающих клетки от апоптоза, следует назвать такие цитокины, как фактор роста фибробластов, коллаген II, фактор роста нервов, эритропоэтин, ИЛ-10, ИЛ-7 и многие другие, обеспечивающие жизненную активность соответственно фибробластов, хондроцитов, нейронов, эритроидных клеток, клеток миелоидного ряда, клеток лимфоидного ряда и пр. К цитокинам, способствующим развитию апоптоза, относятся фактор некроза опухолей α-ФНО (TNF-α), трансформирующий фактор роста β (TGFb), хемокин MIP-1, ИФН-7 и др.
Роль апоптоза в жизни здорового организма заключается в сле-
дующем: 1) поддержание численности клеточной популяции на необ-
231
ходимом для организма уровне; 2) определение формы и размеров организма и его составных частей; 3) обеспечение правильного, адекватного потребностям организма соотношения численности, размеров и формы клеток различных типов; 4) адекватное изменение числа клеток под влиянием различных как экзогенных, так и эндогенных сигналов; 5) обеспечение селекции разновидностей клеток внутри популяции, в том числе в удалении из нее генетически дефектных клеток.
2.2.3. Основные типы гибели клеток и их отличия
Гибель клеток реализуется в виде либо некроза, либо апоптоза. Некроз – патологический процесс, возникающий в результате
воздействия на организм патогенного агента. Некроз клетки – результат прямого цитотоксического воздействия на нее внешних повреждающих факторов и, как правило, сопровождается развитием воспаления.
Апоптоз в нормальных условиях является физиологическим процессом, в основе которого лежит генетически запрограммированная в генотипе гибель клетки.
Таким образом, некроз следует рассматривать как патологическую форму клеточной гибели, развивающуюся в результате острого клеточного повреждения, быстро приводящего к лизису клетки.
Апоптоз – естественная, «физиологическая» форма гибели клетки, представляющая собой активный и строго контролируемый процесс ее самоуничтожения. Между апоптозом и некрозом имеется ряд существенных различий. Апоптоз подвергается фармакологической коррекции, т.е. его можно корригировать. При некрозе фармакологическая коррекция неэффективна.
Последовательность морфологических изменений клетки при апоптозе и некрозе, согласно данным Хармон и др. (1990), М.А. Пальцева и др. (2003), представлена на рис. 15.
Апоптоз – довольно быстро протекающий процесс, занимающий обычно в культуре тканей несколько минут, а в организме – несколько часов.
Самый ранний признак апоптоза, выявляемый на электронномикроскопическом уровне, – резко очерченные уплотнения ядерного хроматина в виде гомогенной массы, а также некоторая конденсация
232
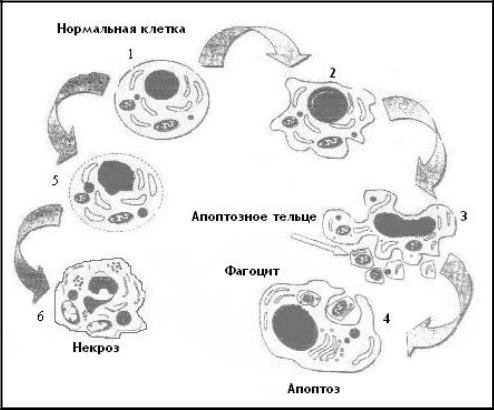
(уплотнение) цитоплазмы. Затем ядро, молекулы ДНК и цитоплазма распадаются на фрагменты, причем цитоплазматические фрагменты разделяются цитоплазматической мембраной. Один из главных отличительных признаков апоптоза – сохранность мембраны, а также фрагментов цитоплазмы, ядра и ДНК.
Рис. 15. Последовательность ультраструктурных изменений при некрозе (слева) и апоптозе (справа): 1 – исходно интактная клетка; 2 – уплотнение и сегрегация хроматина в ядре; 3 – распад ядра на фрагменты и образование апоптозных телец; 4 – фагоцитоз апоптозных телец соседней клеткой; 5 – ранняя стадия некроза, включающая конденсацию хроматина в нерезко очерченные массы и деградацию цитоплазматических структур; 6 – разрушение мембран и дезинтеграция клетки
Сохранение целостности цитоплазматической мембраны апоптотических телец позволяет, в отличие от некроза, избежать попадания содержимого клетки (лизосомальных гидролаз и других белков, цитокинов, ионов калия, кальция) в межклеточное пространство и дает возможность макроорганизму сохранить толерантность к данному
233
процессу. Это обстоятельство особенно важно, если учесть, что в течение жизни в макроорганизме отмирает путем апоптоза астрономическое количество клеток (только масса кроветворных клеток составляет около 5 т).
В результате апоптоза клетка превращается в совокупность окруженных плазматической мембраной апоптотических телец, в которых плотно упакованные органеллы могут выглядеть интакт-
ными. В одних апоптотических тельцах ядерные компоненты отсутствуют, а в других – присутствуют (хроматин в них всегда очень плотный, резко очерчен и сконденсирован у ядерной мембраны). Апоптотические тельца быстро фагоцитируются окружающими соседними клетками (где они утилизируются с помощью лизосом). Эти клетки довольно быстро сближаются, при этом изменений цитоархитектоники тканей не происходит. Некоторые апоптотические тельца (например, в поверхностном эпителии) слущиваются. При апоптозе полностью отсутствуют признаки воспаления.
Ультраструктурные проявления некроза значительно отличаются от характерной для апоптоза картины и проявляются сморщиванием органелл и дезинтеграцией цитоплазмы. Хотя хроматин в некротизирующихся клетках, как и при апоптозе, конденсируется у ядерной мембраны, его компактные массы менее однородны и менее четко очерчены по краям ядра. При некрозе всегда, в отличие от апоптоза, происходит разрушение клеточных и внутриклеточных мембран. Повреждение мембран лизосом всегда приводит к высвобождению лизосомальных гидролаз и последующему распаду клетки.
На более поздней стадии некроза хроматин из ядра исчезает в результате кариолизиса. Некроз обычно сопровождается развитием воспаления (чаще экссудативного).
При некрозе, в отличие от апоптоза, восстановления цитоархитектоники поврежденной ткани не происходит (оно невозмож-
но).
Основные отличия апоптоза и некроза представлены в табл. 5. Важно подчеркнуть, что на ранней стадии некроза, возникающие
изменения в виде нарушения ионно-обменной функции мембранных каналов и уменьшения содержания в клетке макроэргов потенциально обратимы. При нарастании этих изменений в клетке развиваются необратимые процессы.
234

Таблица 5 Основные морфологические и биохимические отличия
апоптоза и некроза
ПОКАЗАТЕЛИ |
АПОПТОЗ |
НЕКРОЗ |
|
|
|
|
|
МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ |
|||
|
|
|
|
Цитоплазма |
Конденсация, фрагмен- |
Лизис |
|
|
тация |
|
|
|
|
|
|
Мембрана |
Долго сохраняется |
Рано разрушается |
|
|
|
|
|
Ядро |
Хроматин |
конденсиро- |
Пикноз |
|
ван, чётко очерчен |
|
|
|
|
|
|
Образование |
Всегда имеет место |
Отсутствует |
|
апоптозных телец |
|
|
|
|
|
|
|
Аутофагия |
Отсутствует |
|
Отсутствует |
|
|
|
|
Фагоцитоз |
Длится от |
нескольких |
Отсутствует |
апоптозных телец |
минут до одного часа |
|
|
|
|
|
|
Возможность бло- |
Иногда актиномицином |
Не блокируется |
|
кады клеточной |
D1, блокаторами каль- |
|
|
смерти |
циевых каналов, специ- |
|
|
|
фическиими |
ингибито- |
|
|
рами |
|
|
|
|
|
|
БИОХИМИЧЕСКИЕ ИЗМЕНЕНИЯ
Первичные прояв- |
Активация эндонуклеаз |
Активация |
лизосо- |
||
ления изменения |
|
|
|
мальных |
|
ферментов |
|
|
|
гидролаз |
|
Биохимические |
Разрывы |
ДНК |
между |
Диффузная |
дегра- |
изменения в ядре |
нуклеосомами |
|
дация |
|
|
Биохимические |
Количество |
лизосо- |
Разрушение |
лизо- |
|
изменения в цито- |
мальных |
ферментов не |
сом, прекращение |
||
плазме |
увеличивается |
|
процессов белково- |
||
|
|
|
|
го синтеза |
|
235
Этиологические |
Генетические, трофиче- |
Биологические, |
|||
факторы |
|
ские гормоны или тро- |
химические |
и фи- |
|
|
|
фические стимулы |
зические |
повре- |
|
|
|
|
ждающие факторы |
||
|
|
|
|
|
|
Наиболее |
типич- |
Тимоциты, лимфоциты |
Печень |
и |
другие |
ная локализация |
после воздействия глю- |
органы под воздей- |
|||
проявлений |
у |
ко-кортикоидов, пред- |
ствием |
|
органо- |
высших |
позво- |
стательная железа после |
тропных (в частно- |
||
ночных |
|
кастрации |
сти, |
гепатотроп- |
|
Воспалительный |
Отсутствует |
Присутствует |
|||
процесс |
|
|
|
|
|
|
|
|
|
|
|
|
2.2.4.Основные типы проявлений апоптоза |
|
|||
Смерть клетки в процессе эмбриогенеза позвоночных
Несмотря на то, что апоптоз отвечает за реализацию многих морфогенетических процессов в динамике эмбриогенеза, гибель клетки в раннем онтогенезе не является жестко детерминированной. Чтобы погибнуть, клетки должны заблаговременно получить сигнал к включению генетической программы апоптоза.
Смерть клеток в интактных тканях взрослых особей
Апоптоз характерен как для медленно пролиферирующих клеточных популяций (гепатоцитов, клеток эпителия коры надпочечников), так и для быстро пролиферирующих (клеток кишечного эпителия, сперматогониев в период дифференцировки). В первом случае апоптоз уравновешивает процессы митоза, а во втором – большая часть митозов компенсируется не только апоптозом, но и в результате потери клеток за счет миграции. Гомеостатическая регуляция нормального количества и объема клеток осуществляется циклической продукцией факторов роста, стимулирующих митоз, и эндогенных «факторов смерти», индуцирующих апоптоз.
Доказано, что вследствие апоптоза разрушаются лимфоциты тимуса и других тканей, выполняющие определенные функции иммунной системы; мегакариоциты, распадающиеся на кровяные пластин-
236
ки; стареющие гранулоциты, особенно нейтрофильные лейкоциты; желтое тело яичника, семенники и другие клетки, структуры которых подвергаются инволютивным процессам в динамике их старения, также разрушаются путем апоптоза.
Смерть клеток в процессе патологической атрофии и гиперплазии
Апоптоз лежит в основе развития патологической атрофии, особенно в эндокринно зависимых тканях. Например, благодаря апоптозу, после кастрации атрофируется предстательная железа. Кора надпочечников атрофируется после супрессии секреции АКТГ с помощью глюкокортикоидов. Патологическое разрастание тканей (за счет их гиперплазии) вызывается путем стимуляции митозов и торможения апоптоза. Возвращение же этих тканей к нормальному объему происходит путем стимуляции апоптоза.
Альтруистический суицид клеток
Смерть клеток-мутантов и клеток, пораженных вирусом, может играть биологически полезную роль в их элиминации из организма. Выживание же этих клеток – вредно для организма в целом. Проникающая радиация вызывает апоптоз в популяции пролиферирующих клеток эпителия крипт кишечника, а не в пролиферирующих клетках лимфоидных органов, где лимфоциты, мутировавшие после облучения, могут стать причиной различных аутоиммунных заболеваний. Апоптоз стимулируется препаратами, применяемыми для химиотерапии опухолевых заболеваний. Уничтожение пораженных вирусами клеток путем апоптоза обеспечивает минимальное повреждение тканей, в то время как благодаря некрозу гибнет огромное число клеточ- но-тканевых структур.
Клеточная смерть, вызванная минимальным повреждением
При слабом повреждающем воздействии на клетки активируется апоптоз, благодаря которому частично измененные клетки выбраковываются из популяции. При сильном повреждающем воздействии развивается некроз. Так, нагревание клеток в культуре тканей до температуры +43–44 С в течение 30 мин вызывает апоптоз отдельных
237
клеток, а гипертермия клеток, достигающая +46–47 С, приводит к массированному их некрозу.
Апоптоз, как видно из табл. 1, идентифицируется не только морфологически, но и биохимически (причем биохимическая идентификация апоптоза хорошо изучена in vitro и плохо in vivo). Доказано, что в основе апоптоза лежат как изменения ионного состава цитоплазмы клетки, приводящие к уменьшению содержания в ней внутриклеточных ионов кальция, так и снижение содержания макроэргических фосфорных соединений.
2.2.5. Генетический контроль физиологической гибели клеток
Роль генов в регуляции апоптоза, как и других физиологических процессов в клетке – пролиферации и дифференцировки, считают общепризнанной. В реализации (как запуске, так и модуляции) естественной клеточной гибели доказана роль генотипа, определяющего с участием различных генов последовательность биохимических и морфологических событий апоптоза (поглощения фагоцитами апоптотических телец, пикноз ядра, разделение ядра на фрагменты, повреждение ДНК и др.).
Индукция и осуществление различных этапов апоптоза клеток различных тканей и органов контролируется набором генов, которые обусловливают выбор апоптотического пути, реализацию или ингибирование апоптоза, а также расщепление погибших клеток и их фагоцитоз.
Доказано, что в модуляции апоптоза клеток принимают участие изменения активности следующих генов: p53, ras, Fas / APO-1, c-mys, c-jun, c-fos, nur-77, bax, bcl-2.
Вразвитии апоптоза, наряду с внутренней (генетической информацией), немаловажное значение придают влиянию на организм (его клеточные и субклеточные структуры) внешней информации в виде наличия или отсутствия, во-первых, растворимых сигнальных молекул, во-вторых, взаимодействия с другими клетками, в-третьих, взаимодействия с определенными субстратами.
2.2.6.Пусковые и внутриклеточные механизмы апоптоза
Вразвитии апоптоза выделяют три стадии: индукторную, эф-
фекторную и стадию деградации. Две последние стадии едины для
238
