
- •Вопрос11 Конформационная лабильность белков. Денатурация, признаки и факторы ее вызывающие. Защита от денатурации специализированными белками теплового шока (шаперонами).
- •Вопрос 12 Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •Вопрос 13 Иммуноглобулины, классы иммуноглобулинов, особенности строения и функционирования.
- •Вопрос 14 Ферменты, определение. Особенности ферментативного катализа. Специфичность действия ферментов, виды. Классификация и номенклатура ферментов, примеры.
- •4. Каталитическая специфичность (специфичность пути превращения
- •1. Оксидоредуктазы - катализируют различные овр с участием 2 субстратов
- •2. Трансферазы – катализируют перенос функц. Гр. От одного соед-я к другому.
- •3. Гидролазы – катализируют реакции гидролиза (расщепления ковалентной
- •4. Лиазы - ферменты, отщепляющие от субстратов негидролитическим путём
- •5. Изомеразы - катализируют различные внутримолекуляр. Превращения.
- •6. Лигазы (синтетазы) – катализируют реакции присоединения друг к другу
Вопрос 13 Иммуноглобулины, классы иммуноглобулинов, особенности строения и функционирования.
Иммуноглобулины, или антитела – специфические белки, вырабатываемые В-
лимфоцитами в ответ на попадание в организм чужеродных структур (антигенов)
Строение на примере IgG: молекула состоит из 4х ППЦ: двух идентичных лёгких,
содержащих около 220 аминокислотных остатков, и двух тяжёлых, состоящих из 440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидными связями. Поэтому молекулу IgG относят к мономерам.
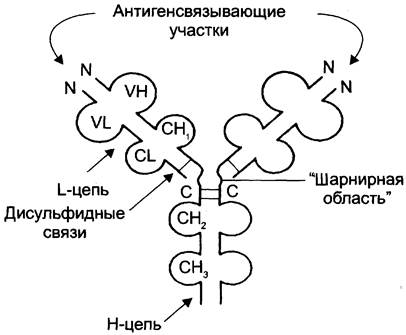
Лёгкие цепи IgG состоят из 2 доменов:
Вариабельного (VL), находящегося в N-концевой области полипептидной цепи,
Константного (CL), расположенного на С-конце.
Каждый из доменов состоит из 2 слоёв с β-складчатой структурой, где участки
полипептидной цепи лежат антипараллельно. β-Слои связаны ковалентно дисульфидной связью примерно в середине домена.
Тяжёлые цепи IgG имеют 4 домена:
Один вариабельный (VH), находящийся на N-конце
Три константных (СН1, СН2, СH3)
Домены тяжёлых цепей IgG имеют гомологичное строение с доменами лёгких цепей.
Между двумя константными доменами тяжёлых цепей СН1 и СН2 есть т.н. «шарнирная область», содержащая большое количество остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке – она придает молекуле гибкость.
Между вариабельными доменами тяжёлых и лёгких цепей находятся два
идентичных участка, связывающих два одинаковых специфических антигена, поэтому такие антитела часто называют «биваленты».
В связывании антигена с антителом участвует не вся АК последовательность
вариабельных доменов обеих цепей, а всего лишь 20-30 аминокислот, расположенных в гипервариабельных областях каждой цепи. Именно эти области определяют уникальные способности каждого клона антител взаимодействовать с соответствующим антигеном.
Функции: обнаружение и связывание чужеродных антигенов, находящихся в
организме вне его клеток. Благодаря связыванию антигена с антителом облегчается процесс дальнейшего разрушения чужеродных веществ.
Особенности строения тяжёлых цепей придают их «шарнирным участкам» и
С-концевым областям, характерную для каждого класса конформацию. Связывание антигена с антителом изменяет конформацию константных доменов тяжёлых цепей, что определяет путь разрушения комплекса в организме (связывание с белками системы комплемента или поглощение комплекса фагоцитирующими клетками).
Специфичность пути разрушения комплекса антиген-антитело зависит от класса антител.
Классы иммуноглобулинов: существует 5 классов тяжелых цепей
иммуноглобулинов, отличающихся по строению константных доменов, в соответствии с ними выделяют и 5 классов иммуноглобулинов
1. Иммуноглобулины М – первый класс антител, синтезирующийся в
развивающихся В-лимфоцитах. Различают 2 формы иммуноглобулинов М: мономерная (мембранно-связанная форма) и пентамерная (секретируемая В-лимфоцитами, в кровь):
Мембранно-связанная форма – мономерная. Созревающие В-лимфоциты,
синтезируют мономерные бивалентные молекулы IgM, которые встраиваются в плазматическую мембрану клеток и играют роль первых антиген-распознающих рецепторов.
Прикрепление IgM к мембране осуществляется с помощью гидрофобного участка,
находящегося в С-концевой («хвостовой») области тяжёлых цепей. Взаимодействие антигена с рецептором на поверхности В-лимфоцита, вызывает его размножение и образование целого клона лимфоцитов, происходящих из одной, стимулированной антигеном клетки.
Секреторная форма - пентамерная. Когда В-лимфоциты впервые встречаются в
жидкостях организма с неизвестным ранее антигеном, они синтезируют и секретируют в кровь IgM, которые содержат пять мономерных субъединиц, связанных друг с другом дисульфидными связями и дополнительной полипептидной J-цепью. В тяжёлых цепях их мономеров отсутствует гидрофобная «хвостовая» часть.
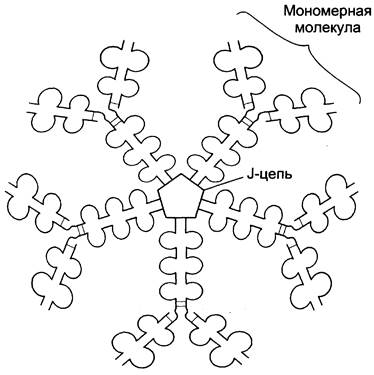
Пентамерная молекула содержит 10 участков связывания с антигеном, что
облегчает вероятность прикрепления неизвестного ранее антигена к иммуноглобулину. Взаимодействие антигена с IgM изменяет его конформацию и индуцирует связывание его «хвостовой» области с первым компонентом системы комплемента. Если антиген расположен на поверхности микроорганизма, активирование системы комплемента вызывает нарушение целостности клеточной мембраны и гибель бактериальной клетки.
2. Иммуноглобулины G – секретируются активированными В-лимфоцитами,
в больших количествах при вторичном иммунном ответе, когда антиген повторно попадает в организм.
У человека обнаружено 4 подкласса IgG: IgGg1, IgGg2, IgGg3, IgGg4
Порядковый номер указывает на содержание подкласса в сыворотке
(в наибол. кол-ве содержится IgGg1, а в наименьшем – IgGg4)
IgG эффективно связывают и инактивируют чужеродные молекулы и клетки,
попавшие в организм, и облегчают их дальнейшее уничтожение. Конформационные изменения в «хвостовой» области IgG после его взаимодействия с антигеном приводят к связыванию и активации белков системы комплемента.
С-концевая область IgG способна взаимодействовать со специфическими
рецепторами макрофагов и нейтрофилов, что приводит к фагоцитозу комплексов антиген-антитело и разрушению их в фагосомах.
Единственный класс, который может проникать через плацентарный барьер
3. Иммуноглобулины А – основной класс антител, присутствующий в секретах
желёз организмат (слюна, пищеварит. сок). Мономерная форма по строению напоминает IgG, но секретах IgA находится в основном в форме димера, где мономеры соединены доп. пептидной цепью J.
Транспорт IgA через эпител. кл. в протоки желез: на базальной поверхности
эпителиальных клеток димер IgA специфически взаимодействует с белками клеточной поверхности (эти белки – т.н. секреторный компонент) и этот комплекс эндоцитозом поглощается внутрь клетки, где подвергается действию протеолитических ферментов, и свободный димер высвобождается во внеклеточное пространство.
Образующийся при взаимодействии IgA с антигеном комплекс не взаимодействует
с белками системы комплемента и фагоцитирующими клетками, но препятствует прикреплению антигенов к поверхности эпителиальных клеток и проникновению их в организм.
4. Иммуноглобулины E – мономеры, содержат 4 константных домена.
После синтеза и секреции в кровь В-лимфоцитами IgE связываются своими
С-концевыми участками с соответствующими рецепторами на поверхности тучных клеток и базофилов и становятся рецепторами антигенов на их пов-ти.
После присоединения антигена хотя бы к двум антигенсвязывающим участкам
двух соседних IgE клетка получает сигнал к секреции биолог. акт. в-в (серотонина, гистамина), хранящихся в секреторных пузырьках. Выброс этих веществ ответственен за развитие воспалительной и аллергической реакций
5. Иммуноглобулины D - играют роль рецепторов В-лимфоцитов; других
функций у IgD пока не выявлено.
