
2 курс летняя сессия / Бодунов Физика учебник
.pdf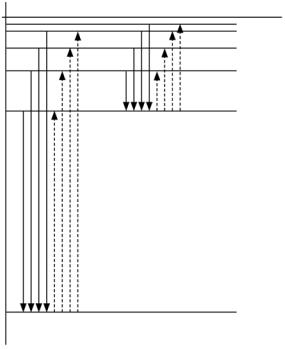
0 |
Е, эВ |
|
|
|||
|
|
|
|
|
|
|
–0,9 |
|
|
|
|
|
|
|
|
|
|
n = 4 |
|
|
–1,6 |
|
|
|
|
n = 3 |
|
|
|
|
|
|
|
|
–3,4 |
|
|
|
|
n = 2 |
|
|
|
|
Серия Бальмера |
|
|
|
|
|
|
||||
–13,6 |
|
|
n = 1 |
|
Серия Лаймана |
||||
|
||||
|
Рис. 3.2 |
|
||
Количественное описание все перечисленные эффекты находят в квантовой механике. Примечательно, что решение уравнения Шредингера для атома водорода дает те же квантовые значения энергии (En = –hR/n2), что и теория Бора, а радиус боровской орбиты rn = a0n2 в квантовой механике имеет смысл расстояния, на котором с наибольшей вероятностью может быть обнаружен электрон в состоянии c главным квантовым числом n.
3.2. Рентгеновское излучение
Рентгеновским излучением называется электромагнитное излучение
(электромагнитные волны) с длиной волн λ, значения которой лежат в диапазоне от 1 пм (10–12 м) до 10 нм (10–8 м). Рентгеновское излучение способ-
но глубоко проникать во все вещества.
Рентгеновское излучение (X-лучи) открыл в 1895 г. В. К. Рентген. Он сконструировал трубку для получения X-лучей и исследовал их основные свойства.
В зависимости от механизмов возникновения различают тормозное и характеристическое рентгеновское излучение.
Рентгеновская трубка и тормозное рентгеновское излучение. Есте-
ственными источниками рентгеновского излучения являются Солнце и другие космические объекты. Самым распространенным искусственным источ-
70
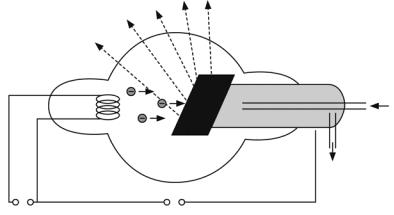
ником рентгеновского излучения является рентгеновская трубка (рис. 3.3). Она представляет собой вакуумный баллон с двумя электродами – катодом К и анодом А. Катод К нагревается током, создаваемым разностью потенциалов Uh, и испускает (вследствие термоэлектронной эмиссии) электроны. Они ускоряются в электрическом поле, создаваемом между катодом и анодом высокой разностью потенциалов Ua.
Мишенью для электронов является анод А (его часто называют антикатодом), который изготавливают из тяжелых металлов (W, Cu, Ag, Pt и др.). При резком торможении электронов на аноде возникает рентгеновское излучение. При этом в излучение превращается примерно 1–3% энергии электронов. Остальная часть энергии выделяется в виде теплоты, поэтому в мощных трубках анод интенсивно охлаждается (система охлаждения С).
Рентгеновское
излучение
|
K |
C |
|
A |
|
|
|
|
|
|
– + |
Uh |
|
Ua |
|
|
Рис. 3.3 |
Возникающее в рентгеновской трубке излучение называется тормоз-
ным рентгеновским излучением.
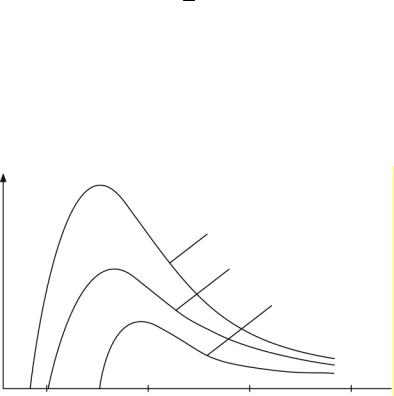
На рис. 3.4 приведены спектры этого излучения для разных значений энергии электронов Е. Как видно из рисунка, тормозное излучение имеет сплошной спектр (P(λ) – относительная интенсивность излучения). Его важная особенность – наличие коротковолновой границы λmin (длина волн λ1, λ2 и λ3 на рис. 3.4), существование которой объясняется квантовой природой излучения.
Действительно, излучение возникает благодаря энергии, теряемой электроном при торможении. Согласно закону сохранения энергии энергия излучаемого кванта (рентгеновского фотона) hν не может быть больше энергии электрона E:
hν ≤ Е.
71
Здесь ν – частота рентгеновского излучения. Таким образом, для длины волн излучения должно выполняться неравенство
c hc ,
E
и, следовательно,
min hcE .
P( )
E1 = 50 кэВ
E2 = 40 кэВ
E3 = 30 кэВ
1 |
2 |
3 |
|
|
|
0,03 |
0,05 |
0,07 |
0,09 , нм |
Рис. 3.4
При энергиях электронов Е1 = 50, Е2 = 40 и Е3 = 30 кэВ коротковолноваяграница λmin равна соответственно λ1 = 0,025, λ2 = 0,031 и λ3 = 0,041 нм.
Характеристическое рентгеновское излучение. Состояние электрона в атоме характеризуется главным квантовым числом n. Электроны с одинаковым значением главного квантового числа n образуют оболочки. Ближайшие к ядру оболочки обозначают латинскими буквами K (n = 1), L (n = 2), M (n = 3), N (n = 4), ... При столкновении с атомом быстрые электроны могут выбить электрон из внутренней оболочки атома. На образовавшееся вакантное место переходит электрон из более удаленных от ядра оболочек. Этот переход сопровождается излучением рентгеновского фотона, энергия которого равна разности энергии начального и конечного состояний электрона (hν = Eнач – Eкон). Следовательно, спектр возникающего излучения является линейчатым и определяется структурой электронных оболочек конкретного атома. В связи с этим такое рентгеновское излучение называют характеристиче-
ским.
72
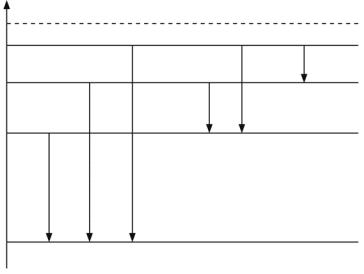
При переходе электрона с оболочек L, M, N,… на оболочку K возникает спектральная K-серия, состоящая из линий, обозначаемых как Kα (пе-
реход L→K), Kβ (M→K), Kγ (N→K),… (рис. 3.5).
E |
|
E = 0 |
|
|
|
||
N |
Mα |
n = 4 |
|
M |
n = 3 |
||
|
|||
Lα |
Lβ |
|
|
L |
|
n = 2 |
|
Kν |
|
|
|
Kβ |
|
|
|
Kα |
|
|
|
K |
|
n = 1 |
Рис. 3.5
Аналогично возникают и другие спектральные серии (L, M, N и O), наблюдаемые, впрочем, лишь для тяжелых элементов.
В 1913 г. Г. Мозли предложил формулу, являющуюся аналогом обобщенной формулы Бальмера для атома водорода и связывающую частоту ν характеристического рентгеновского излучения с атомным номером Z излучающего элемента (закон Мозли):
R(Z ) |
2 |
|
1 |
|
1 |
|
|
|
|
|
. |
||
|
n2 |
n2 |
||||
|
|
|
|
|
||
|
|
1 |
|
2 |
Здесь R = 0,329·1016 с–1 – постоянная Ридберга; σ – постоянная экранирования, определяемая структурой электронных оболочек атомов; n1 и n2 – главные квантовые числа начального и конечного состояний атома; Z – порядковый номер химического элемента в Периодической таблице элементов Д. И. Менделеева. Смысл постоянной экранирования σ состоит в том, что на электрон, совершающий переход с одной внутренней оболочки на другую, действует не весь заряд ядра Ze, а его часть (Z – σ)e, учитывающая экранирующее действие других электронов.
Рентгеновские спектры разных элементов похожи, так как возникают при переходах электронов между внутренними оболочками атомов, которые имеют сходное строение.
73
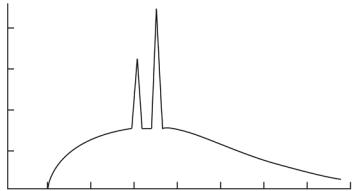
Отметим, что реальные рентгеновские спектры (рис. 3.6), как правило, представляют собой комбинацию тормозного и характеристического излучения.
P( )
4 |
|
Kα |
|
|
|
|
|
|
|
3 |
|
Kβ |
|
|
|
|
|
|
|
2 |
|
|
|
|
1 |
|
|
|
|
0 |
0,04 |
0,08 |
0,12 |
|
Рис. 3.6
Практическое применение рентгеновского излучения основано на использовании его свойств.
Рентгеноструктурный анализ (определение атомной структуры кристаллических тел, строения пористых и мелкодисперсных материалов, сложных биологических объектов – вирусов, хромосом, молекул ДНК и т. п.) базируется на использовании дифракции рентгеновского излучения.
Рентгеновская дефектоскопия (обнаружение различных дефектов в материалах и конструкциях) основана на проникающей способности рентгеновского излучения и особенностях его поглощения в материалах.
Рентгеновский спектральный анализ (определение химического соста-
ва вещества) строится на использовании свойств характеристического рентгеновского излучения: его спектр определяется только структурой электронных оболочек конкретного атома и не зависит от типа соединения, в состав которого входит.
3.3. Люминесценция
Вторичное излучение и люминесценция. Взаимодействие электро-
магнитного излучения с веществом сопровождается испусканием вторичного электромагнитного излучения. Вторичное излучение может быть вызвано разными процессами: отражением, рассеянием, люминесценцией. Все виды вторичного излучения прекращаются после прекращения облучения кроме люминесценции.
74
Люминесценция – это процесс излучения света холодными телами, который может продолжаться длительное время (до нескольких часов) после прекращения возбуждающего излучения.
По продолжительности свечения люминесценция делится на флуоресценцию (ее продолжительность мала – 10–9–10–5 с) и фосфоресценцию (ее продолжительность велика – до нескольких часов).
По методу возбуждения она делится на:
а) фотолюминесценцию – возбуждается светом; б) электролюминесценцию – создается электрическим полем;
в) радиолюминесценцию – инициируется радиоактивным излучением; г) рентгенолюминесценцию– результат действиярентгеновских лучей; д) хемилюминесценцию – возникает в химических реакциях; е) триболюминесценцию – наблюдается при трении.
Вещества, излучающие свет (люминесцирующие) после облучения их светом, рентгеновскими лучами, радиоактивными α-, β-, γ-лучами и т. д., на-
зываются люминофорами.
Основные характеристики люминесценции.
1.Спектр люминесценции I(λ) или I(ν) – распределение энергии излучения по длине волн λ или частоте ν. Люминофоры могут излучать в ультрафиолетовой, видимойиинфракрасной областях спектра. Спектр люминесценции не зависит от длины волны возбуждающего света. Каждое вещество имеет свой, особый спектр люминесценции. Именно поэтому она используется в спектральном анализе для определения химического состава веществ.
2.Интенсивность люминесценции I – световая энергия, излучаемая люминофором в единицу времени.
3.Длительность люминесценции τ – зависимость ее интенсивности I(t) от времени t. В простейшем случае после прекращения облучающего излучения интенсивность люминесценции убывает по экспоненциальному закону:
I (t) I0e t/ ,
где I0 – начальная интенсивность люминесценции; τ – длительность, или время ее затухания, т. е. время, в течение которого интенсивность люминесценции уменьшается в е раз.
4. Квантовый выход люминесценции q – отношение числа квантов элек-
тромагнитного излучения, испущенных в единицу времени, к числу квантов, поглощенных за то же время. Он определяет эффективность превращения энергии возбуждающего света в энергию люминесценции.
Люминесценция отдельных молекул и твердых тел определяется структурой их энергетических уровней.
Диаграмма энергетических уровней молекул. Молекула имеет дис-
кретные энергетические состояния (уровни). При поглощении кванта света
75
(фотона) она переходит с более низкого на более высокий энергетический уровень. Полная энергия молекулы Е складывается из энергии электронного возбуждения Еэл, энергии колебания ядер Екол и энергии вращения молекулы как целого Евр:
Е = Еэл + Екол + Евр.
Из теоретических и экспериментальных оценок известно, что
Еэл > Екол > Евр.
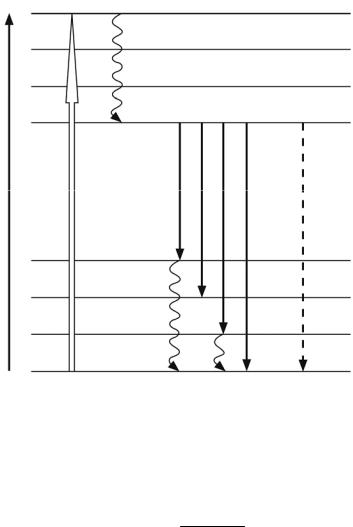
На рис. 3.7 представлена упрощенная схема энергетических уровней молекулы. Каждому электронному состоянию (на схеме они обозначены S0 и S1) соответствует система колебательно-вращательных уровней 0, 1, 2, …).
|
S1 |
Колебательная релаксация |
|
|
|
|
|
|
|
|
|
|
|
вр |
|
|
|
|
|
|
Поглощение |
|
) |
|
учательныйБезызлпереход |
||
E |
|
|
(улюминесценциячениеИзл |
|
||
E + |
|
|
|
|
|
|
кол |
|
|
|
|
|
|
E + |
|
|
|
|
|
|
эл |
|
|
|
|
|
|
|
S0 |
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 3.7
3
2
1
0
3
2
1
0
Равновесное распределение молекул по колебательно-вращательным уровням невозбужденного S0 и возбужденного S1 электронных состояний описывается формулой Больцмана
ni = n0exp Eiкол-вр ,kT
где n0 – общее число молекул; ni – число молекул на i-м уровне; Eiкол-вр = Екол + Евр – энергия колебательно-вращательного уровня i; k – постоянная
Больцмана; T – температура.
76

При низких температурах подавляющее большинство молекул в соответствии с предыдущей формулой находится на нулевых уровнях электронных состояний S0 и S1. Поэтому при этих температурах переходы с поглощением света в основном происходят с нулевого уровня состояния S0 (широкая стрелка, направленнаявверх, рис. 3.6).
Переходы между электронно-колебательными уровнями могут сопровождаться не только поглощением, но и испусканием света. В соответствии с постулатом Бора частота молекулярных переходов ν определяется изменением энергии системы:
Ehэл Eколh -вр ,
где Еэл, Екол-вр – изменения электронной и колебательно-вращательной энергии соответственно при молекулярных переходах.
Молекулы, попавшие на верхние колебательно-вращательные уровни любого электронного состояния, оченьбыстро теряют избыток колебательновращательной энергии и переходят без излучения на нулевой уровень. Этот процесс называется колебательной релаксацией. На рис. 3.7 такие переходы обозначены волнистыми стрелками. Таким образом, в результате поглощения кванта света молекула в конечном счете оказывается на нижнем (нулевом) уровне возбужденного состояния S1.
Переход с нижнего уровня S1 в невозбужденное состояние S0 может осуществляться двумя путями:
1)безызлучательно (на рис. 3.7 безызлучательный переход обозначен штриховой стрелкой), в этом процессе электронная энергия переходит в колебательную или передается другой молекуле, например, в результате столкновения;
2)излучательно (излучательные переходы обозначены сплошными
стрелками, направленными вниз) – это и есть люминесценция. Отметим, что:
а) частоты, на которых люминесцирует молекула, меньше частоты возбуждающего света из-за колебательной релаксации в возбужденном S1 и основном S0 электронных состояниях;
б) спектр люминесценции не зависит от частоты возбуждающего света, таккакпереходы, дающиевклад в люминесценцию, происходят снулевого уровня состояния S1.
Применительно к элементарным процессам люминесценция – это спонтанное (самопроизвольное) излучение, которое происходит после завершения всех релаксационных процессов и установления теплового равновесия в возбужденном электронном состоянии. Она находит применение в искусстве, клинической диагностике и криминологии, при изготовлении денег, ви-
77
зуализации динамики жидкостей и др. Люминесценция используется в спектральном анализе и в экологии как инструмент для определения структуры и состава веществ и обнаружения микропримесей в окружающей среде. Люминофоры применяются в лампах дневного света, электронно-лучевых трубках и экранах мониторов как детекторы элементарных частиц, при производстве светящихся красок.
3.4. Лазер
Вынужденное излучение. Атом может находиться в разных энергетических состояниях с энергией E1, E2,... В теории Бора эти состояния называются стационарными. На самом деле стационарным состоянием, в котором атом в отсутствие внешних возмущений может находиться бесконечно долго, является только состояние с наименьшей энергией – основное состояние. Все другие состояния (возбужденные) нестабильны. Возбужденный атом может пребывать в этих состояниях очень короткое время – порядка 10–8 с. За это время он самопроизвольно переходит в одно из низших состояний, испуская квант света, частота которого определяется вторым постулатом Бора. Излучение, испускаемое при самопроизвольном переходе атома из одного состояния в другое, называют спонтанным.
Переходы между энергетическими уровнями атома не обязательно связаны с поглощением или испусканием фотонов. Атом может приобрести или отдать часть своей энергии и перейти в другое квантовое состояние в результате взаимодействия с другими атомами или столкновений с электронами, т. е. безызлучательно.
В 1916 г. А. Эйнштейн предсказал, что переход электрона в атоме с верхнего энергетического уровня на нижний может происходить также под влиянием внешнего электромагнитного поля, частота которого равна собственной частоте перехода электрона в атоме. Возникающее при этом излу-
чение называют вынужденным, или индуцированным.
Вынужденное излучение существенно отличается от спонтанного. В результате взаимодействия возбужденного атома с фотоном атом испускает еще один фотон той же частоты и распространяющийся в том женаправлении, что и первоначальный. Согласно волновой теории это означает, что атом излучает электромагнитную волну, частота, фаза, поляризация и направление распространения которой точно такие же, как и у первоначальной волны. В результате вынужденного испускания амплитуда волны, распространяющейся в среде, возрастает.
Оптический квантовый генератор. Название «лазер» происходит от английского laser (light amplification by stimulated emission of radiation) –
78
усиление света посредством вынужденного излучения. Лазер, или оптический квантовый генератор, – это устройство, преобразующее энергию накачки (световую, электрическую, химическую и др.) в энергию когерентного, монохроматического, поляризованного и узконаправленного излучения.
Для усиления проходящей через слой вещества волны в этом веществе (среде) необходимо искусственно создать инверсную населенность уровней, при которой число атомов в возбужденном состоянии превышает число атомов в основном состоянии.
Среда, в которой создана инверсная населенность уровней, называется активной. Она служит резонансным усилителем светового сигнала. Для этого используют обратную связь, помещая активную среду в оптический резо-
натор.
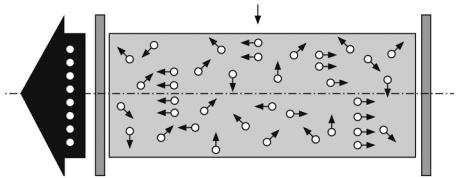
Простейший оптический резонатор (рис. 3.8) состоит из двух параллельных зеркал, между которыми находится активная среда. Вынужденное излучение активной среды отражается зеркалами в обратном направлении, снова проходит через активную среду и в результате усиливается. Это повторяется многократно. Возникает лавинообразный процесс индуцированной эмиссии когерентных фотонов. При этом в среде поддерживается инверсная населенность уровней. Процесс создания поддержки инверсной населенности называется накачкой.
Начало лавинообразному процессу в активной среде может положить случайный спонтанный процесс испускания атомом среды кванта света в направлении оси резонатора. Через короткое время возникает стационарный режим генерации излучения, направленного вдоль этой оси. Такое (лазерное) излучение выводится наружу через одно из зеркал, обладающих частичной прозрачностью (см. рис. 3.8).
Активная среда
Излучение
Полупрозрачное |
Непрозрачное |
зеркало |
(глухое) зеркало |
ρ = 50 % Оптический резонатор ρ = 100 %
Рис. 3.8
79
