
- •Оглавление
- •Предисловие
- •Механика
- •КИНЕМАТИКА
- •МЕХАНИЧЕСКИЕ КОЛЕБАНИЯ
- •ОСНОВНЫЕ ПОНЯТИЯ МОЛЕКУЛЯРНОЙ ФИЗИКИ
- •ЭЛЕМЕНТЫ СТАТИСТИЧЕСКОЙ ФИЗИКИ
- •ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •ЯВЛЕНИЯ ПЕРЕНОСА В ГАЗАХ
- •РЕАЛЬНЫЕ ГАЗЫ
- •Электричество и магнетизм
- •ЭЛЕКТРОСТАТИЧЕСКОЕ ПОЛЕ В ВАКУУМЕ
- •ЭЛЕКТРИЧЕСКОЕ ПОЛЕ В ДИЭЛЕКТРИКАХ
- •ПОСТОЯННЫЙ ЭЛЕКТРИЧЕСКИЙ ТОК
- •МАГНИТНОЕ ПОЛЕ ПОСТОЯННОГО ТОКА
- •МАГНИТНОЕ ПОЛЕ В ВЕЩЕСТВЕ. МАГНЕТИКИ
- •ЭЛЕКТРИЧЕСКИЕ КОЛЕБАНИЯ
- •ЭЛЕКТРОМАГНИТНЫЕ ВОЛНЫ
- •Оптика. Основы квантовой механики
- •РАСПРОСТРАНЕНИЕ ЭЛЕКТРОМАГНИТНЫХ ВОЛН
- •КВАНТОВАЯ ОПТИКА
- •ОСНОВЫ КВАНТОВОЙ МЕХАНИКИ

Г л а в а 10
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
В основе термодинамического метода лежит несколько фундаментальных законов (начал), которые установлены на основании обобщения большой совокупности опытных фактов. Термодинамический метод основан на анализе превращения энергии в системе. При этом в термодинамике не рассматривается внутреннее строение систем и характер движения частиц в этих системах. Выводы термодинамики имеют весьма общий характер. Законы термодинамики можно применить к электрическим и магнитным явлениям, процессам теплового излучения, радиоактивного распада и т.п. Нет такой области физики, химии и биологии, в которой нельзя было бы пользоваться термодинамическим методом. Однако при этом термодинамика не вникает в процессы, происходящие внутри вещества, не рассматривает механизмы этих процессов.
10.1. Внутренняя энергия системы молекул.
Работа в термодинамике. Количество теплоты
Полная энергия W термодинамической системы включает в себя
кинетическую энергию W сист механического движения системы как
к
целого, потенциальную энергию W внеш системы во внешнем потен-
п
циальном поле и внутреннюю энергию U — энергию всех видов движения и взаимодействия частей системы, зависящую только от внутреннего строения системы. Таким образом,
W = W сист + W внеш + U.
кп
Вдальнейшем будем рассматривать термодинамические системы, которые макроскопически неподвижны и не находятся во внешних полях. Для таких систем полная и внутренняя энергия совпадают.
Втермодинамике под внутренней энергией понимают лишь кинетическую энергию теплового движения молекул, потенциальную энергию взаимодействия атомов в молекуле, а также потенциальную энергию взаимодействия молекул между собой.
Внутренняя энергия является однозначной функцией состояния термодинамической системы. Это означает, что внутренняя энергия
125
в каком-либо произвольно выбранном состоянии не зависит от того, каким образом система пришла в это состояние, т.е. изменение внут-
ренней энергии U при переходе системы из состояния 1 в состоя-
12
ние 2 не зависит от вида процесса перехода. В частности, если в результате какого-либо процесса система возвращается в исходное состояние, то полное изменение внутренней энергии равно нулю.
Обмен энергией между закрытой термодинамической системой и внешними телами может осуществляться двумя качественно различными способами: совершением работы и теплообменом. С учетом этого, в термодинамике понятие механической работы приобретает несколько иной смысл, чем в механике. Работой, совершаемой над системой, называется энергия, передаваемая термодинамической системе при силовом взаимодействии с ней. Количеством теплоты (теплотой) называется энергия, передаваемая термодинамической системе внешними телами путем теплообмена.
Работу над системой производят внешние силы. В отсутствие внешних силовых полей обмен энергией между неподвижной системой и внешней средой может осуществляться путем совершения работы лишь в процессе изменения объема и формы системы. Необходимо учитывать, что в соответствии с третьим законом Ньютона работа, совершаемая внешними силами над системой, численно равна и противоположна по знаку работе, совершаемой самой системой над внешней средой, т.е. против внешних сил.
Теплообмен происходит между телами или частями одного и того же тела, нагретыми до разной температуры. Способы осуществления теплообмена — конвекция, теплопроводность и излучение.
В отличие от внутренней энергии системы, которая является однозначной функцией состояния этой системы, понятия теплоты и работы имеют смысл только в связи с процессом изменения состояния системы. Они являются энергетическими характеристиками процесса. Для перевода системы из одного и того же начального состояния 1 в одно и то же конечное состояние 2 необходимо совершить над системой разную работу и передать системе разную теплоту. Можно сказать, что в произвольном состоянии термодинамическая система обладает определенным запасом внутренней энергии, но нельзя говорить ни о «запасе работы», ни о «запасе теплоты» в системе. Итак, работа и теплота не являются функциями состояния системы. При расчете элементарной (бесконечно малой) работы, совершенной над системой, и элементарного (бесконечно малого) количества теплоты, переданного системе, будем обозначать их соответственно δA и δQ. Бесконечно малое же изменение внутренней энергии системы, вызванное такими процессами, будем обозначать dU, поскольку бесконечно малое изменение функции состояния может быть опреде-
126
лено как ее дифференциал. Следовательно, в любом замкнутом (круговом) процессе, в результате которого система возвращается в
исходное состояние,  dU = 0.
dU = 0.
Совершение работы над системой может изменить любой вид энергии системы. Если же энергия передается системе в форме теплоты, то она идет на увеличение только внутренней энергии системы. Часто оба способа передачи энергии системе осуществляются одновременно. Например, при нагревании газа в сосуде с подвижным поршнем газу сообщается теплота и происходит увеличение его объема. При этом совершается работа против внешнего давления.
10.2. Первое начало термодинамики
Существование двух способов передачи энергии системе позволяет проанализировать с энергетической точки зрения равновесный процесс перехода системы из одного состояния 1 в другое состояние 2. В соответствии с законом сохранения энергии изменение внутренней
энергии системы U |
в таком процессе равно сумме работы A ′ , |
12 |
12 |
совершаемой над системой внешними силами, и теплоты Q , сооб-
12
щенной системе:
U |
= A ′ |
+ Q . |
(10.1) |
12 |
12 |
12 |
|
Обозначим работу, совершенную системой против внешних сил,
как A . Тогда, поскольку A |
= – A ′ |
, то |
|
|
12 |
12 |
12 |
|
|
|
Q |
= U |
+ A . |
(10.2) |
|
12 |
12 |
12 |
|
Выражения (10.1) и (10.2) являются математической записью закона сохранения энергии в термодинамике. Он называется первым началом термодинамики: изменение внутренней энергии системы равно сумме работы, совершенной внешними силами над системой, и количества теплоты, сообщенного системе. Иная формулировка: количество теплоты, сообщенное системе, расходуется на изменение внутренней энергии этой системы и на совершение системой работы над внешними телами.
При сообщении системе бесконечно малого количества теплоты первое начало термодинамики записывается следующим образом:
δQ =dU + δA. |
(10.3) |
Все физические величины, входящие в (10.3), могут быть как положительными, так и отрицательными. Если к системе подводится теплота, то δQ > 0, если теплота отводится, то δQ < 0. Общее коли-
127
чество теплоты, сообщаемое системе в процессе 1-2, равно алгебраической сумме количеств теплоты, сообщаемых системе на всех
2
участках процесса: Q = ∫ δQ . Если система совершает работу над
12
1
внешними телами, то считается, что δA > 0, если же над системой внешние силы совершают работу, то δA < 0. Работа, совершаемая системой в процессе 1-2, равна алгебраической сумме работ, совер-
2
шаемых системой на всех участках процесса: A = ∫δA .
12
1
10.3. Применение первого начала термодинамики
для идеального газа. Политропные процессы
Внутренняя энергия идеального газа. Рассмотрение первого начала термодинамики для идеального газа начнем с получения формулы для расчета внутренней энергии системы молекул, образующих идеальный газ. В соответствии с определением идеального газа его внутренняя энергия будет представлять собой лишь кинетическую энергию движения молекул, поскольку потенциальная энергия взаимодействия молекул в идеальном газе отсутствует. Как было показано в § 9.5, кинетическая энергия одной молекулы газа определяется
i
соотношением ε = ---- kT , где i — число степеней свободы молекулы.
2
Тогда кинетическая энергия молекул, содержащихся в моле идеаль-
|
i |
|
|
---- |
|
ного газа, может быть найдена как |
εm = NA 2 |
kT . Если же рассмот- |
реть ν молей идеального газа, то кинетическая энергия его молекул составит:
i |
|
---- |
|
Wк = νNA 2 |
kT = |
m i
---- ---- N kT .
μ 2 A
Таким образом, полученное выражение определяет внутреннюю энергию произвольного количества идеального газа. С учетом (8.10) это соотношение можно переписать таким образом:
|
i |
m |
|
|
U = |
---- ---- |
RT . |
(10.4) |
|
2 |
μ |
|||
Итак, внутренняя энергия заданного числа молей идеального газа — однозначная функция его температуры. Она зависит только от состояния идеального газа и не зависит от того, каким образом газ
128

пришел в данное состояние. Изменение внутренней энергии данной массы идеального газа в произвольном процессе
|
i |
m |
|
|
U = |
---- ---- |
R T . |
(10.5) |
|
2 |
μ |
|||
С учетом уравнения Клапейрона—Менделеева (8.9) выражение
|
i |
|
(10.4) можно записать следующим образом: U = |
---- |
pV . Соответ- |
2 |
ственно, изменение внутренней энергии (10.5) может быть найдено
i |
i |
|
|
|
|
как U = ---- |
(pV) = ---- (p V |
|
– p V ) . |
||
2 |
2 |
2 |
2 |
1 |
1 |
Работа идеального газа. При расширении или сжатии газа, заключенного в сосуд с подвижным невесомым поршнем площадью S, можно определить работу, совершаемую внешними силами по изменению объема газа. Если при действии внешних сил на поршень он совершает перемещение dx, то элементарная работа внешних сил будет равна δ A ′ = F dx, где F — проекция суммарного вектора внешних сил на перемещение поршня. Если рассматривать равновесный процесс изменения объема газа, то в каждый момент силы давления газа уравновешивают внешние силы, а давление газа равно внешнему давлению. Тогда газ совершает элементарную работу
δ A = p S d x = p d V,
где d V — изменение объема газа. Если изобразить процесс изменения объема газа на диаграмме (p,V ), то элементарная работа газа численно определяется площадью под бесконечно малым участком этого графика (рис. 10.1). В целом же работа идеального газа в произвольном процессе будет численно равна площади под графиком этого процесса на диаграмме (p,V ):
2 |
|
A12 = ∫ p dV . |
(10.6) |
1 |
|
Работа будет положительной (и площадь под графиком необходимо взять со знаком «+»), если газ увеличивает свой объем. Работа
p |
|
p |
|
1 |
|
|
1 |
|
|
|
а |
2 |
|
|
б |
|
|
|
|
|
|
|
2 |
0 |
V |
0 |
V |
Рис. 10. 1 |
|
|
Рис. 10. 2 |
129
газа против внешних сил будет отрицательна (и площадь под графи-
ком |
необходимо взять со знаком « – »), если газ |
уменьшает свой |
|
объем. Так, из рис. 10.2 видно, что A1a2 |
> 0, а A2б1 |
< 0. Кроме того, |
|
A1a2 |
> | A2б1|. Таким образом, работа |
идеального |
газа зависит не |
только от начального и конечного состояния газа, но и существенно зависит от вида процесса перевода газа из одного состояния в другое.
Количество теплоты. В соответствии с первым началом термодинамики количество теплоты, подведенное к газу, определяется суммой изменения внутренней энергии газа и совершенной им работы. Поскольку работа газа зависит от вида процесса, совершаемого газом, то и количество теплоты тоже зависит от способа изменения состояния газа. Для определения количества теплоты, подведенного к идеальному газу в произвольном процессе (или отведенного от него), можно воспользоваться уравнением (10.2). Однако часто бывает удобно рассчитать необходимую величину непосредственно, не прибегая к расчету работы и изменения внутренней энергии. С этой целью введем понятие теплоемкости. Теплоемкость тела
(системы) численно равна количеству теплоты, которое необходимо сообщить телу (системе), чтобы изменить его температуру на 1 К в данном процессе: c = δQ / dT.
Чтобы сравнивать между собой поведение различного числа молекул одного и того же вещества, удобно ввести понятие удельной теплоемкости вещества. Она численно равна количеству теплоты, которое необходимо сообщить единице массы тела (системы), чтобы изменить ее температуру на 1 К:
1 δQ c = --- ------- .
уд m dT
Удельная теплоемкость вещества также зависит от вида процесса изменения состояния системы. Для газов очень удобно применять понятие молярной теплоемкости, которая определяется количеством теплоты, необходимым для изменения температуры 1 моля газа на 1 К:
|
|
1 |
δQ |
|
c |
m |
= ---- ------- . |
(10.7) |
|
|
ν |
dT |
|
|
|
|
|
||
Рассчитаем молярные теплоемкости идеального газа в изопроцессах. Для этого запишем уравнение первого начала термодинамики
i
для 1 моля: c dT = ---- RdT + p dV .
m 2
130
В изохорном процессе объем газа не изменяется, поэтому p dV = 0 и δQ = dU. Получаем выражение для молярной теплоемкости идеального газа в изохорном процессе, которую обозначим cV :
i
c = ---- R .
V 2
Тогда внутренняя энергия идеального газа может определена по формуле
m
U = ---- cVT .
μ
(10.8)
быть также
(10.9)
В изобарном процессе изменения объема газ совершает работу и тогда выражение для молярной теплоемкости идеального газа в изобарном процессе, которую обозначим cp , приобретает вид:
c = ----i R + p d------V . p 2 dT
Воспользуемся теперь уравнением Менделеева—Клапейрона для 1 моля газа (8.8), выразив элементарную работу газа в изобарном процессе как p dV = R dT. Тогда
cp = |
i |
R + |
R = |
i + 2 |
R . |
(10.10) |
---- |
----------- |
|||||
|
2 |
|
|
2 |
|
|
Нетрудно видеть, что соблюдается соотношение |
|
|||||
|
cp = cV + R, |
|
(10.11) |
|||
которое было впервые получено Р. Майером в 1842 г. и поэтому называется уравнением Майера.
В изотермическом процессе газ не изменяет свою температуру, поэтому dT = 0. Однако газ расширяется, следовательно, он совершает работу: δA ≠ 0. Тогда молярная теплоемкость идеального газа в изотермическом процессе
|
i |
|
dV |
|
× |
|
cT = |
---- |
R + p |
------ |
= ± |
. |
|
2 |
dT |
|
Во всех рассмотренных изопроцессах молярные теплоемкости идеального газа постоянны и зависят только от внутреннего строения его молекул. Процесс, в котором теплоемкость вещества не изменяется, называется политропным. Получим уравнение такого процесса для идеального газа. Используем выражение первого начала термодинамики:
i
c ν dT = ---- νRdT + p dV ,
m 2
гдеν = m ⁄ μ .
131
Из уравнения (8.9) следует, что p dV + V dp = νR dT . Тогда
|
p dV + V dp |
|
p dV + V dp |
|
|
|
cm |
------------------------------- |
= cV |
------------------------------- |
+ |
p dV , |
|
R |
R |
|||||
|
|
|
|
или
p dV(cm – cV – R) = V dp(cV – cm) . Воспользуемся (10.11) и последнее выражение перепишем в виде
p dV(cm – cp) = V dp(cV – cm) .
Полученное дифференциальное уравнение можно решить методом разделения переменных:
dV |
cm – cp |
|
dp |
------ |
------------------- |
|
----- |
V |
cV – cm |
= |
p . |
Обозначим
|
cm – cp |
|
n = |
------------------- |
|
cm – cV , |
(10.12) |
|
тогда |
|
|
n ln V = – ln p + const , |
|
|
или |
|
|
pV n = const . |
(10.13) |
|
Полученное соотношение является уравнением политропного процесса, в котором теплоемкость газа остается постоянной величиной. Показатель n, определяемый по (10.12), называется показателем политропы для данного газа. Если из (10.12) выразить молярную теплоемкость газа cm в политропном процессе, то найдем:
|
|
|
|
n – (cp ⁄ cV) |
|
c |
m |
= c |
V |
------------------------------- = c |
V |
|
|
n – 1 |
|||
|
|
|
|
|
|
где |
|
|
|
|
|
|
|
|
|
γ = cp ⁄ cV . |
|
n – γ |
|
|
------------ |
, |
(10.14) |
n – 1 |
|
|
(10.15)
Формальная зависимость теплоемкости газа в политропном процессе от показателя политропы изображен на рис. 10.3. Нетрудно
видеть, что при n = 0 из уравнения (10.13) следует pV n = pV 0 = p = = const, т.е. уравнение изобарного процесса. В соответствии с (10.14),
cm = cp. При n = 1 из уравнения (10.13) получаем pV n = pV 1= pV = const,
т.е. уравнение изотермического процесса. В этом случае, в соответствии с (10.14), cm → ±×. При n = ±× из уравнения (10.13), извлекая корень
п-й степени, можно получить n p V = V = const , т.е. уравнение изо-
p V = V = const , т.е. уравнение изо-
132

cm
cp
cV
|
|
|
|
0 |
1 |
|
n |
Рис. 10. 3
хорного процесса. Согласно (10.14), cm = cV . Следовательно, все изопроцессы идеального газа — частные случаи политропного процесса.
Кроме известных изопроцессов можно ввести понятие адиабати-
ческого процесса. Адиабатическим (или адиабатным) процессом
называют процесс, который проходит без теплообмена с окружающей средой (δQ = 0). Тогда в этом процессе cm = 0, и из (10.14) можно
получить, что это возможно при n = γ. Уравнение адиабатного про-
цесса имеет вид: pV γ = const. Это уравнение впервые было получено французским математиком и механиком С. Пуассоном и поэтому называется уравнением Пуассона. Показатель степени в этом уравнении называется показателем Пуассона для идеального газа. Нетрудно увидеть, что, согласно (10.8) и (10.10), из (10.15) следует
γ = cp ⁄ cV = (i + 2) ⁄ i . |
(10.16) |
10.4.Анализ изопроцессов идеального газа
спомощью первого начала термодинамики
Рассмотрим описание различных изопроцессов идеального газа с помощью первого начала термодинамики.
Изохорный процесс. Поскольку в этом процессе V = const, то газ не совершает никакой работы над внешними телами: AV = 0. В соот-
ветствии с первым началом термодинамики QV = U . Используя
уравнение Клапейрона — Менделеева, можно выразить изменение внутренней энергии идеального газа следующим образом:
|
i m |
|
i |
|
U = |
---- --- |
R T = |
---- |
V p. |
2 μ |
2 |
Подводимое к газу количество теплоты можно рассчитать, использовав (10.8) так:
|
m |
|
|
|
QV = |
--- |
cV |
T . |
|
μ |
||||
|
|
|
133
Изобарный процесс. В данном процессе происходит изменение объема газа, поэтому он совершает работу над внешними силами.
|
m |
|
Поскольку p = const то, согласно (10.6), Ap = p V = |
--- |
R T . Из этого |
μ |
выражения следует физический смысл универсальной газовой постоянной: она численно равна работе изобарного расширения 1 моля идеального газа при повышении его температуры на 1 К. Уравнение первого начала термодинамики для изобарного процесса запишем следующим образом: δQp = dU + δAp , или Qp = U + Ap . Исполь-
зуя уравнение Клапейрона — Менделеева, выражаем изменение внутренней энергии идеального газа следующим образом:
|
i m |
|
i |
|
U = |
---- --- |
R T = |
---- |
p V . |
2 μ |
2 |
Подводимое к газу количество теплоты определяется с помощью (10.10) так:
|
m |
|
|
Qp = |
--- |
cp |
T . |
μ |
Изотермический процесс. Поскольку в этом процессе T = const, то внутренняя энергия идеального газа не изменяется: U = 0. Уравнение первого начала термодинамики для такого процесса запишем в виде δQT = δAT , или QT = AT . Следовательно, при подведении к
газу теплоты (QT > 0), он расширяется, совершая положительную
работу против внешних сил (A > 0). Получим выражение для расчета работы газа в изотермическом процессе, проинтегрировав (10.6):
V |
V |
|
|
|
|
V |
|
p |
p |
|
2 |
2 |
|
|
|
|
|
||||
|
|
m RT |
|
m |
2 |
m |
1 |
1 |
||
AT = ∫ p dV = |
∫ |
--- ------ |
dV = |
--- |
RT ln ----- = |
--- |
RT ln ----- |
= p1V1 ln ----- . |
||
μ |
V |
μ |
μ |
|||||||
V |
V |
|
V |
p |
p |
|||||
|
|
|
|
1 |
|
2 |
2 |
|||
11
Поскольку в данном процессе теплоемкость бесконечна, то для расчета подведенного к газу количества теплоты можно использовать лишь выражение первого начала термодинамики. Основной вывод при анализе превращения энергии в изотермическом процессе: получаемая от внешней среды теплота идет не на увеличение температуры газа, а возвращается обратно в среду в виде механической работы.
Адиабатный процесс. В таком процессе газ не получает теплоты
из внешней среды: δQ |
= 0 , поэтому 0 = dU + δA . Поэтому при |
ад |
ад |
расширении газа, когда он совершает положительную работу против внешних сил (A > 0), изменение внутренней энергии газа отрицательно ( U < 0). Следовательно, согласно (10.5), температура газа
134
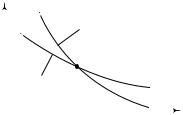
p |
|
Адиабата |
|
|
|||
|
|
||
|
|
Изотерма |
|
0 |
|
|
|
|
V |
||
|
|
Рис. 10. 4 |
|
уменьшается. Поэтому на диаграмме ( p,V ) кривая адиабатического расширения газа (адиабата) будет располагаться ниже кривой изотермического расширения (изотермы), проведенной из той же начальной точки (рис. 10.4). Таким образом, адиабата на диаграмме ( p,V ) про-
ходит круче, чем изотерма. В соответствии с (10.7) c = 0, а поэтому
ад
расчет совершенной газом работы можно провести в соответствии с
первым началом термодинамики: A = – U. Однако можно полу-
ад
чить выражение для расчета работы в адиабатном процессе и с помощью соотношения (10.6). Для этого воспользуемся уравнением Пуас-
сона pV γ = p V γ |
= const . Тогда |
|
|
|
|
|
|
|
|
||
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
V2 |
V2 |
p Vγ |
|
p Vγ |
|
1 – γ |
1 – γ |
|
|
|
|
|
|
1 1 |
|
1 |
1 |
|
|
|
||
Aад = ∫ p dV = ∫ |
------------ |
dV = |
------------ |
|
V2 |
– V1 |
|
. |
|||
Vγ |
1 – |
γ |
|
|
|||||||
|
V |
V |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
|
1 |
1 |
|
|
|
|
|
|
|
|
|
Поскольку γ > 1, то последнее выражение удобно переписать в виде
|
|
|
p Vγ |
|
|
1 – γ |
|
1 – γ |
|
|
p V |
|
V γ – 1 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
1 1 |
|
|
|
|
|
|
1 1 |
1 |
|
|
|||
A |
|
= |
------------ |
|
V |
|
– V |
|
|
= |
------------ |
----- |
|
. |
|||
ад |
γ |
– 1 |
|
1 |
2 |
|
γ |
– 1 |
|
1 – |
|
||||||
|
|
|
|
|
|
|
|
V2 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Отметим, что в соответствии с (10.16) показатель адиабаты может принимать следующие значения:
γ= 5 ⁄ 3 ≈ 1,67 для одноатомного газа (i = 3);
γ= 7 ⁄ 5 = 1,4 для двухатомного газа (i = 5);
γ= 4 ⁄ 3 ≈ 1,33 для трехатомного газа (i = 6).
Реальный адиабатный процесс должен происходить, с одной стороны, достаточно быстро, чтобы в системе не успел произойти теплообмен с окружающей средой, но, с другой стороны, достаточно медленно, чтобы процесс оставался равновесным.
135
10.5.Ограниченность молекулярно-кинетической теории теплоемкости идеального газа
Молекулярно-кинетическая теория теплоемкости идеального газа позволила получить выражение, например, для молярной теплоемкости газа в изохорном процессе (10.8). Однако экспериментальное подтверждение этой формулы наталкивается на ряд трудностей. Несмотря на то что целый ряд газов при определенных условиях ведут себя как идеальный газ (т.е. подчиняются уравнению состояния идеального газа), хорошее согласие во всем интервале температур у формулы (10.8) с экспериментом получается только для одноатомных газов. Для других газов эта формула экспериментально подтверждается только в ограниченном интервале температур. Например, значения молярной теплоемкости азота при постоянном объеме при различных температурах приведены ниже:
Т, К |
80 |
150 |
250 |
400 |
600 |
1000 |
1500 |
|
|
|
|
|
|
|
|
c , Дж / (мольæК) |
20,31 |
21,03 |
20,87 |
20,95 |
21,79 |
24,39 |
26,52 |
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Теоретическое же значение молярной теплоемкости азота при постоянном объеме, согласно (10.8), равно 20,8 Дж / (мольæК).
Закон Больцмана о равномерном распределении энергии по степеням свободы молекул справедлив только в диапазоне 273 < T < 723 К. Происходит это из-за того, что молекулярно-кинетическая теория не учитывает квантовый характер движения молекул и атомов в молекулах. При низких температурах у молекулы возбуждаются только степени свободы поступательного движения. На вращательные степени свободы приходится слишком малая энергия, ими пренебрегают. В этих условиях газ ведет себя как одноатомный. С ростом температуры начинают возбуждаться вращательные степени свободы, а затем — колебательные. Молекула перестает быть жесткой, расстояния между атомами в молекуле начинают меняться. Поскольку механическим колебаниям гармонического осциллятора присуща кинетическая и потенциальная энергия, то на колебательную степень свободы прихо-
1
дится энергия ε = 2æ---- kT . Это и приводит к заниженным значе-
2
ниям теплоемкости идеального газа, получаемым согласно классической теории теплоемкости, по сравнению с результатами эксперимента.
136
10.6. Невозможность вечного двигателя первого рода
Рассмотрим произвольный замкнутый процесс, совершаемый идеальным газом. Циклом называется процесс изменения состояния системы, в результате которого она возвращается в исходное состояние. На рис. 10.5 изображен такой цикл — процесс 1-а-2-б-1. Для отдельных этапов цикла можно записать выражение первого начала термодинамики следующим образом: Q1a2 = A1a2 + U1a2 , Q2б1 =
= A2б1 + U2б1 . Если просуммировать почленно эти уравнения, то получим Q = A . Поскольку внутренняя энергия является функцией
цц
состояния, то ее суммарное изменение за цикл равно 0.
p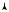
1
а
б
 2
2
0 |
V |
Рис. 10. 5
Из такого рассмотрения следует вывод: для получения работы газа в замкнутом цикле необходимо подведение теплоты к газу от внешней среды. При этом площадь цикла (заштрихованная на рис. 10.5) численно равна работе газа за цикл. Если цикл на диаграмме ( p,V ) совершается по часовой стрелке, то работа газа за цикл положительна. Если цикл на диаграмме ( p,V ) совершается против часовой стрелки, то работа газа за цикл отрицательна и равна площади цикла, взятой со знаком « – ».
Обобщая все сказанное, можно сформулировать первое начало термодинамики применительно к циклам следующим образом: невозможно создать такое циклически действующее устройство, которое производило бы полезную (положительную) работу без подвода энергии извне. Такое устройство исторически было названо вечным двигателем первого рода. Следовательно, первое начало термодинамики запрещает создание вечного двигателя первого рода.
137

Г л а в а 11
ТЕПЛОВЫЕ МАШИНЫ.
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
В этой главе вновь обратимся к термодинамическому методу изучения физических явлений. Дело в том, что для термодинамических процессов одного первого начала термодинамики недостаточно. Выражая всеобщий закон сохранения и превращения энергии, первое начало не позволяет определить направление протекания процессов. Например, процесс самопроизвольной передачи теплоты от холодного тела к горячему не противоречит первому началу термодинамики, если уменьшение внутренней энергии первого тела равно энергии, полученной вторым телом. Однако опыты показывают, что такой процесс не происходит. Обобщение огромного экспериментального материала привело к необходимости расширения термодинамики. Было сформулировано второе начало термодинамики, позволившее превратить термодинамический метод исследования физических явлений в один из самых универсальных методов, применяемых в физике. Однако, для того чтобы можно было перейти к изучению второго закона термодинамики, необходимо рассмотреть предварительно целый ряд вопросов.
11.1. Обратимые и необратимые процессы и циклы
Введем понятие обратимого процесса. Термодинамический процесс, совершаемый системой, называется обратимым, если он может быть проведен в прямом и обратном направлениях через те же состояния (но в обратной последовательности) так, что после осуществления прямого и обратного процессов в окружающей среде не возникает никаких остаточных изменений. Процесс, который не удовлетворяет вышеуказанному условию, называется необратимым.
Вот некоторые примеры обратимых процессов: колебания математического маятника без трения;
равновесный адиабатный процесс (для этого он должен быть бесконечно медленным);
равновесный изотермический процесс (тоже осуществляемый бесконечно медленно).
При гармонических колебаниях маятника в отсутствие сил трения он полностью сохраняет свою энергию, следовательно, не передает
138
ее окружающим телам. После завершения очередного полного колебания, т.е. по истечению одного полного периода колебаний, маятник в точности возвращается в исходное состояние с теми же значениями координаты, скорости, ускорения, энергии и т.п. Так выполняется условие обратимости процесса.
Любой термодинамический процесс без теплообмена с окружающей средой (адиабатный) также будет обратимым, поскольку в этом случае система обменивается с другими телами только работой, т.е. механическим воздействием.
Если осуществить процесс с теплообменом, удовлетворив требование обратимости процесса, то можно установить, что таким процессом будет только изотермический. Только в таком случае в прямом и обратном процессах будут осуществляться последовательности тех же состояний с одинаковой температурой. Во всех же иных процессах с теплообменом между системой и окружающей средой в прямом и обратном процессах температура состояний будет разная, а поэтому теплота будет постоянно самопроизвольно переходить от тела с большей температурой к телу с меньшей температурой.
Вот некоторые примеры необратимых процессов: колебания маятника с трением;
любой неравновесный процесс (осуществляемый достаточно быстро), даже адиабатный.
Колебания маятника с трением, во-первых, не являются строго гармоническими, т.е. положения маятника после каждого полного колебания не совпадают. Таким образом, прямой и обратный процессы не проходят через те же состояния. Кроме того, при трении часть энергии маятника передается во внешнюю среду, непрерывно увеличивая ее внутреннюю энергию. Причем это происходит как при прямом движении маятника, так и при обратном.
При быстром осуществлении любого процесса параметры системы в разных ее точках оказываются разными, что не позволяет провести процесс в прямом и обратном направлениях через те же состояния. Рассмотрим это на примере расширения газа под поршнем в сосуде. Если быстро перемещать поршень, то вблизи него в сосуде создается область разрежения (пониженного давления), поскольку концентрация молекул вблизи поршня будет меньше, чем вдали от него. Состояние газа в сосуде будет неравновесным: давление в разных частях сосуда разное. При быстром перемещении поршня молекулы «не успевают» своим тепловым движением выровнять это падение концентрации, в результате при неравновесном расширении процесс пройдет через точки с меньшим давлением, чем при равновесном сжатии. На рис. 11.1 на диаграмме ( p,V ) неравновесный процесс расширения газа 2-1 условно показан штриховой линией, так
139

как изобразить неравновесное состояние однозначной точкой на графике невозможно.
При осуществлении неравновесного сжатия газа под поршнем в сосуде вблизи поршня возникнет область повышенного давления, в результате процесс неравновесного сжатия на диаграмме ( p,V ) будет изображаться условной линией, находящейся выше равновесного процесса.
Обратимый процесс является обязательно равновесным, поскольку каждое равновесное состояние системы с заданными параметрами состояния может быть только одно, а неравновесных — бесконечно много. Поэтому в прямом и обратном процессах равновесные состояния воспроизводятся однозначно, а неравновесные — неоднозначно. Следовательно, обратный процесс может не пройти через те же состояния, что и прямой, если это — неравновесный процесс.
Обратное высказывание неверно: равновесный процесс не обязательно должен быть обратимым. Например, процесс самопроизвольной теплопередачи при конечной разности температур между телами необратим. Если он будет идти медленно, то будет равновесным, но он не может проходить в противоположном направлении: теплота самопроизвольно передается только от тела с более высокой температурой к телу с более низкой температурой.
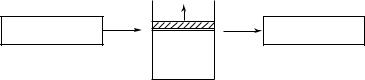
Рассматривая в дальнейшем циклы, т.е. замкнутые процессы, происходящие с идеальным газом, будем считать цикл прямым, если на диаграмме ( p,V ) он осуществляется в направлении по часовой стрелке, и обратным, если против часовой стрелки. Тогда работа газа в прямом цикле будет положительна, а в обратном — отрицательна.
Проведем прямой цикл двумя способами: обратимо, т.е. равновесно (бесконечно медленно), и необратимо, т.е. быстро, а поэтому неравновесно. Учитывая выводы, сделанные при рассмотрении рис. 11.1, изобразим эти циклы на диаграмме ( p, V ) (рис. 11.2). При этом точки 1 и 2, соответствующие минимальному и максимальному объему газа в циклах, при обратимом и необратимом способах осуществления цикла совпадают. Именно между этими точками и про-
p |
|
2 |
|
p |
|
|
Обратимый |
|
|
|
|
||||||
|
|
|
|
|
|
|||
|
|
Равновесный |
|
|
1 |
2 |
|
|
|
|
|
|
|
|
|
||
|
|
1 |
|
|
|
|
|
|
|
|
Неравновесный |
|
|
|
Необратимый |
||
0 |
|
|
|
0 |
|
|
|
|
|
V |
|
|
V |
||||
|
|
Рис. 11. 1 |
|
|
|
Рис. 11. 2 |
||
140
исходят необратимое сжатие и необратимое расширение газа. Из сравнения площадей этих циклов видно, что при обратимом способе осуществления цикла работа цикла больше, чем при необратимом
способе: А > A |
. Такой результат, полученный для частного |
обр |
необр |
случая сравнения быстрого и медленного способов осуществления цикла, можно представить в виде:
А > A |
. |
(11.1) |
обр |
необр |
|
Из рассмотренных примеров необратимых процессов можно сделать общие выводы. Все реальные процессы протекают с конечной скоростью и сопровождаются трением и теплообменом при конечной разности температур тел. Следовательно, все реальные процессы, строго говоря, необратимы.
11.2. Тепловая машина и ее термический КПД
Термодинамика рассматривает превращения энергии в системах в процессах их взаимодействия с окружающими телами. Один из видов таких превращений — превращение теплоты, переданной системе, в работу. Для осуществления такого превращения созданы специальные устройства — тепловые машины. Известно, что первую тепловую машину разработал и построил русский механик И. Ползунов в 1763 г., но первый патент на такое устройство был выдан Дж. Уатту в 1784 г. С тех пор тепловые машины прочно вошли в сферу жизнедеятельности человека. К ним относятся паровые машины, двигатели внутреннего сгорания, паровые турбины и реактивные двигатели. Любое стрелковое и артиллерийское оружие — тоже тепловая машина.
По типу действия все тепловые машины можно разделить на машины разового действия и циклические. При этом принцип их устройства и функционирования одинаков. На рис. 11.3 изображено принципиальное устройство произвольной тепловой машины. Цель действия тепловой машины — получение работы А, которую над внешними телами будет совершать рабочее тело. Это может быть газ, находящийся в сосуде с подвижным поршнем, и т.п. Для совершения
|
Работа А |
Q1 > 0 |
Q2 < 0 |
Нагреватель (Т1) |
Холодильник (Т2) |
|
Рабочее |
|
тело |
|
Рис. 11. 3 |
141
рабочим телом работы ему передается некоторое количество теплоты
Q от устройства, называемого нагревателем. Для постоянного (цик-
1
личного) совершения работы рабочим телом необходимо привести рабочее тело в исходное состояние, после чего оно вновь сможет
получить количество теплоты Q от нагревателя. Возврат рабочего
1
тела в исходное состояние (сжатие газа после его расширения) возможен при отведении от рабочего тела некоторого количества теп-
лоты Q устройству, называемому холодильником. Очевидно, что
2
температуры нагревателя T и холодильника T должны быть раз-
1 |
2 |
ными: T > T . Мерой эффективности преобразования теплоты, под-
12
веденной к рабочему телу, в работу тепловой машины над внешними телами является коэффициент полезного действия (КПД) тепловой машины, который равен отношению работы, совершенной рабочим телом за один цикл, к количеству теплоты, полученному рабочим телом от нагревателя в этом цикле:
η = A / Q . |
(11.2) |
ц 1 |
|
Поскольку Q > 0, а Q < 0, то, применяя первое начало термоди-
12
намики к циклу рабочего тела (см. § 10.2), можно записать: A |
= Q + |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
ц |
1 |
+ Q = Q – | Q |. Тогда выражение (11.2) будет справедливо и в таком |
||||||||||||
2 |
1 |
2 |
|
|
|
|
|
|
|
|
|
|
виде: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q |
|
|
|
|
|
|
|
A |
|
Q |
– |
Q |
|
|
|
|
|
|
|
η = |
ц |
|
1 |
|
2 |
|
2 |
|
. |
|
|
|
------ |
= |
------------------------ |
|
|
---------= 1 – |
|
(11.3) |
|||
|
|
|
Q |
|
|
Q |
|
Q |
|
|||
|
|
|
1 |
|
|
1 |
|
1 |
|
|
|
|
Из (11.3) следует, что КПД любой тепловой машины всегда меньше 100 %, т.е. нельзя в циклическом процессе полностью превратить в работу всю теплоту, полученную рабочим телом от нагревателя. Однако понятно, что если процессы теплообмена рабочего тела с нагревателем и холодильником сделать обратимыми, то КПД такой тепловой машины всегда будет выше, чем если бы эти процессы были необратимыми (11.1).
11.3.Цикл Карно
В1824 г. французский инженер Н.Л.С. Карно (1796 —1832) в своей работе «Рассуждения о движущей силе огня и о машинах, способных развивать эту силу» предложил рассмотреть цикл тепловой машины, составленный только из обратимых процессов. У такой машины КПД должен быть больше, чем КПД любой другой машины, цикл которой состоит из необратимых процессов.
Если для подвода теплоты к рабочему телу необходимо совершить теплообмен с нагревателем, а теплообмен обратим только при
142

p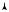
1
2
T1
4
T2
3
0 |
V |
Рис. 11. 4
равенстве температур рабочего тела и нагревателя, то осуществим тепловой контакт рабочего тела с нагревателем в изотермическом процессе. Это первый процесс цикла (на рис. 11.4 кривая 1-2 — изо-
терма), проходящий при температуре нагревателя T . Чтобы потом
1
обратимо осуществить передачу теплоты холодильнику, т.е. изотер-
мический процесс 3-4 при температуре холодильника T , необходимо
2
перевести рабочее тело с одной изотермы на другую. Единственным обратимым процессом при этом может быть равновесный адиабатный процесс. На диаграмме ( p,V ) он изображен кривой 2-3. Аналогичный процесс адиабатного сжатия 4-1 понадобится для возвращения рабочего тела в исходное состояние. Получаемый цикл из четырех процессов носит название цикла Карно. Он является единственно возможным обратимым циклом рабочего тела при одном нагревателе и одном холодильнике в тепловой машине. Поэтому, в соответствии с выводами § 11.1, КПД цикла Карно будет максимальным среди КПД всех возможных циклов, которые рабочее тело может осуществить между нагревателем и холодильником с заданными температурами T и T . В этом состоит содержание теоремы
12
Карно.
Рассчитаем КПД цикла Карно η . Согласно (11.2),
к
AQ + Q
|
ц |
|
1 |
2 |
|
η = |
------ |
= |
---------------------- . |
(11.4) |
|
к |
Q |
|
|
Q |
|
|
1 |
|
|
1 |
|
Поскольку теплота от нагревателя передается в изотермическом процессе 1-2, то
|
|
m |
|
V |
|
|
|
|
2 |
|
|
Q = A |
|
= --- RT |
|
ln ----- . |
(11.5) |
1 |
12 |
μ |
1 |
V |
|
|
|
|
|
1 |
|
143
Аналогично, теплоту, передаваемую холодильнику в изотермическом процессе 3-4, определим по формуле
Q = A
234
m |
|
V |
|
|
4 |
|
|
= --- RT |
2 |
ln ----- . |
(11.6) |
μ |
V |
|
|
|
|
3 |
|
Подставляя (11.5) и (11.6) в (11.4), получаем:
η =
к
|
V |
|
|
V |
|
|
V |
|
|
V |
|
|
2 |
|
|
4 |
|
|
2 |
|
|
3 |
|
T ln ----- |
+ |
T ln ----- |
|
T ln ----- |
– |
T ln ----- |
|
||||
1 |
V |
|
2 |
V |
|
1 |
V |
|
2 |
V |
|
|
1 |
|
|
3 |
|
|
1 |
|
|
4 |
|
-------------------------- |
|
------------------------ |
|
|
= |
-------------------------------------------------- . |
(11.7) |
||||
|
|
|
V |
|
|
|
|
|
V |
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
T |
ln |
V----- |
|
|
|
T |
ln |
V----- |
|
|
|
1 |
|
|
|
|
1 |
|
|
|
||
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
Воспользуемся уравнением Пуассона для связи параметров рабо- |
|||||||||||||||||
чего |
|
тела. |
Точки 2 и |
3 |
лежат |
на |
одной адиабате, |
поэтому |
|||||||||||
|
|
|
γ |
|
|
γ |
|
|
|
|
|
|
|
|
|
|
|
|
p V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 2 |
||
p V |
|
= p V |
|
. Кроме того, согласно уравнению состояния, |
------------ = |
||||||||||||||
|
2 |
|
2 |
|
3 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
γ |
|
|
p V |
3 |
|
|
|
|
|
|
|
|
|
|
|
p |
V |
|
|
||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
3 |
|
|
= |
------------ |
. Из первого соотношения следует, что |
----- |
----- |
|
||||||||||||||
|
|
|
|
|
= |
, а из вто- |
|||||||||||||
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
p3 |
V |
2 |
|
|
|
|
|
|
|
|
|
|
|
p |
|
V |
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
3 |
1 |
|
|
|
|
|
|
|
рого соотношения получим |
----- |
= |
----- |
----- |
. Приравниваем правые части |
||||||||||||||
p |
V |
T |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
3 |
|
2 |
2 |
|
|
|
|
|
|
|
полученных выражений: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
γ |
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
T |
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
1 |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
----- |
----- |
= |
----- |
, |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
V2 |
T2 |
|
V2 |
|
|
|
|
|
|||
откуда следует, что |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
T V γ – 1 = T V γ – 1 . |
|
|
|
(11.8) |
||||||||
|
|
|
|
|
|
|
|
1 |
2 |
|
|
2 |
|
3 |
|
|
|
|
|
Аналогично для адиабаты 4-1 можно получить, что |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
T V γ – 1 = T V γ – 1 . |
|
|
|
(11.9) |
||||||||
|
|
|
|
|
|
|
|
1 |
1 |
|
|
2 |
|
4 |
|
|
|
|
|
Поделим (11.8) на (11.9), тогда |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
V |
⁄ V |
= V |
⁄ V . |
|
|
|
(11.10) |
||||
|
|
|
|
|
|
|
|
2 |
1 |
|
3 |
|
|
4 |
|
|
|
|
|
Подставив (11.10) в (11.7), найдем |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
T |
– T |
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
η |
= ------------------ |
= 1 – ----- . |
|
|
|
(11.11) |
||||||
|
|
|
|
|
|
|
к |
|
|
T |
|
|
|
|
T |
|
|
|
|
11
144
В соответствии с теоремой Карно, эта формула определяет теоретический предел КПД всех возможных тепловых машин с нагревате-
лем, имеющим температуру T , и холодильником, имеющим темпера-
1
туру T . Соответственно тепловая машина, работающая по циклу
2
Карно, называется идеальной тепловой машиной.
11.4. Второе начало термодинамики. Энтропия
Первый закон термодинамики не позволяет установить направление протекания процессов. Он также не исключает возможности такого процесса, единственным результатом которого было бы превращение теплоты, полученной от некоторого тела, в эквивалентную ей работу. Первое начало термодинамики допускает также построение циклически действующей тепловой машины, совершающей работу за счет охлаждения одного источника теплоты. Такой двигатель называется вечным двигателем второго рода. Например, понижение температуры мирового океана на 0,01 °С и превращение полученной теплоты в работу обеспечивает человечество энергией на 1700 лет при нынешних темпах энергопотребления!
Обобщение большого число экспериментальных фактов привело к выводу о невозможности построения вечного двигателя второго рода и получило название второго закона (второго начала) термодинамики. Существует несколько эквивалентных одна другой формулировок второго начала термодинамики. Сначала приведем две из них, принадлежащих немецкому физику Р. Клаузиусу (1850 г.) и английскому физику У. Томсону (он же лорд Кельвин, 1851 г.):
•невозможен процесс, единственным результатом которого является передача теплоты от холодного тела к горячему;
•невозможен процесс, единственным результатом которого является совершение работы за счет охлаждения одного тела.
Сравним два способа расчета КПД цикла Карно, т.е. приравняем соотношения (11.4) и (11.11):
1 – T / T = 1 + Q / Q .
2 1 2 1
Тогда получим, что Q / Q = – T / T , или Q / T |
|
= – Q / T . |
|||||
2 |
1 |
2 |
1 |
2 |
2 |
1 |
1 |
Назовем отношение количества теплоты, полученного системой в каком-либо процессе, к температуре этого процесса приведенной теплотой. Для цикла Карно Q / T — приведенная теплота, полу-
11
ченная рабочим телом в процессе нагревания при температуре T ,
1
а Q / T — приведенная теплота, полученная рабочим телом в про-
22
цессе теплообмена при температуре T |
(поскольку Q < 0, то это |
2 |
2 |
145

количество теплоты на самом деле передается от рабочего тела). Если переписать последнее соотношение в виде
Q / T + Q / T |
= 0, |
(11.12) |
||
1 |
1 |
2 |
2 |
|
то его можно сформулировать следующим образом: в равновесном обратимом цикле Карно суммарная приведенная теплота всех процессов равна 0.
Рассмотрим произвольный обратимый цикл А-В-А (рис. 11.5). Разобьем этот цикл изотермами и адиабатами так, чтобы исходный цикл превратился в последовательность элементарных циклов Карно 1-2-3-4. Естественно, что чем ближе адиабаты 2-3 и 4-1 будут находиться одна к другой, тем точнее получится приближение последовательности циклов Карно к исходному циклу. Тогда можно сказать, что для осуществления исходного цикла потребуется множество нагревателей и холодильников. Для каждого из элементарных циклов Карно будет справедливо соотношение (11.12) в виде
δQ1i / T1i + δQ2i / T2 i = 0.
Если же просуммировать все эти выражения по исходному циклу, то получим
 δQ / T = 0.
δQ / T = 0.
Математически это означает, что выражение δQ / T есть полный дифференциал некоторой функции S:
dS = δQ / T. |
(11.13) |
Такую функцию ввел и дал ей название энтропия (по-гречески «превращение») Р. Клаузиус в 1865 г.: это такая функция состояния термодинамической системы, дифференциал которой связан с элементарным тепловым эффектом в обратимом процессе соотношением (11.13).
p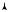
1 |
B |
|
|
|
2 |
A
43
0 |
V |
Рис. 11. 5
146
Выведем расчетную формулу для измерения энтропии в обратимом процессе идеального газа. Подставим выражение (11.13) в (10.3) и учтем (10.6):
T dS = dU + δA = dU + p dV .
Тогда, в соответствии с (8.9) и (10.5), получим:
|
dU |
p |
i |
m |
dT |
m |
dV |
|
dS = |
------- |
+ ---- dV = ---- |
---- R ------ |
+ --- |
R ------ |
, |
||
|
T |
T |
2 |
μ |
T |
μ |
V |
|
или после интегрирования для некоторого процесса 1-2
|
i |
m |
|
T |
|
m |
|
V |
|
|
|
2 |
|
|
2 |
|
|||
S = |
---- |
---- |
R ln |
----- |
+ |
--- |
R ln |
----- |
|
2 |
μ |
T |
μ |
V . |
(11.14) |
||||
|
|
|
|
1 |
|
|
|
1 |
|
Ясно, что если процесс круговой (цикл), то состояния 1 и 2 совпадают, т.е. T = T и V = V , а тогда
1 |
2 |
1 |
2 |
S = 0. |
(11.15) |
ц |
|
11.5.Основные свойства энтропии
1.Обратимый процесс. Рассмотрим цикл Карно как пример обратимого процесса, в котором участвуют три тела: нагреватель, рабочее тело и холодильник. Поскольку рабочее тело совершает замкнутый цикл, то для него справедливо (11.15), т.е. энтропия рабо-
чего тела не изменяется. Следовательно, если Q / T — это измене-
1 1
ние энтропии в процессе теплообмена с нагревателем, то, согласно закону сохранения энергии, изменение энтропии нагревателя в этом процессе определится как – Q / T . Аналогичный вывод можно сде-
11
лать и для второго слагаемого в (11.12). Тогда выражение (11.12) можно рассматривать и таким образом:
S |
+ S = 0. |
нагр |
хол |
Обобщая все выводы для рабочего тела, нагревателя и холодильника, получаем
S |
= 0. |
(11.16) |
|
сист |
|
Таким образом, алгебраическая сумма изменений энтропии всех тел, участвующих в обратимом процессе, равна 0.
2. Необратимый процесс. Рассмотрим в качестве примера необратимого процесса передачу теплоты от одного (более горячего) тела,
температура которого T , к другому (более холодному) телу, темпера-
1
тура которого T . Второе начало термодинамики утверждает, что про-
2
147
цесс возможен только в одном направлении: одно тело отдает коли-
чество теплоты Q , а другое получает количество теплоты Q .
1 2
Направление процесса передачи теплоты учитывается в знаке этих величин: Q < 0, а Q > 0. Согласно закону сохранения энергии
12
выполняется равенство Q = – Q . Рассмотрим промежуточный этап
12
передачи столь малого количества теплоты, что температуры тел не изменяются. Изменения энтропии каждого из тел рассчитаем следу-
ющим образом: S |
= Q / T , |
S |
= Q / T . Тогда общее изменение |
|||||
1 |
|
1 |
1 |
2 |
2 |
2 |
|
|
энтропии системы из двух тел можно найти по формуле |
||||||||
S |
|
= S + S = Q / T + Q / T . |
||||||
сист |
|
1 |
2 |
1 |
1 |
2 |
2 |
|
Учитывая, что T > T , Q < 0, а Q > 0, получаем: |
|
|||||||
1 |
2 |
1 |
|
2 |
|
|
|
|
|
|
|
S |
сист |
> 0. |
|
|
(11.17) |
|
|
|
|
|
|
|
|
|
Таким образом, алгебраическая сумма изменений энтропии всех тел, участвующих в необратимом процессе, больше 0.
Объединяя выводы (11.16) и (11.17), получаем, что для всех тел изолированной системы, участвующих в произвольном процессе, суммарное изменение энтропии неотрицательно:
S |
≥ 0. |
(11.18) |
|
сист |
|
Этот вывод можно сформулировать несколько иначе: процессы в природе всегда идут в таком направлении, чтобы для всех тел, участвующих в процессе, алгебраическая сумма изменений энтропии была неотрицательна. Это правило, указывающее направление протекания любых процессов, также является формулировкой второго
начала термодинамики.
Реальные процессы, происходящие в природе, всегда необратимы. Значит, энтропия системы в этих процессах должна возрастать. Рост энтропии продолжается до тех пор, пока в системе не наступит состояние равновесия, после чего все процессы в системе прекращаются. Другой вид приведенной формулировки может звучать и таким образом: не может самопроизвольно происходить процесс с уменьшением энтропии системы.
Распространение второго начала термодинамики, установленного для замкнутых систем, на всю Вселенную неправомерно. Такая экстраполяция может привести к выводу о неизбежности выравнивания температуры всех тел, к идее «тепловой смерти Вселенной» (ее выдвинул Р. Клаузиус). Согласно гипотезе Л. Больцмана, Вселенная все время пребывает в равновесном изотермическом состоянии,
148
но в ее различных частях происходят отклонения от этого состояния. Оказалось, что вследствие тяготения однородное изотермическое распределение вещества во Вселенной не соответствует максимуму энтропии, потому что не является наиболее вероятным. Поскольку Вселенная нестационарна, она расширяется и первоначально однородное вещество распадается под действием сил тяготения на галактики, звезды, планеты и т.д. Именно эти процессы и происходят с ростом энтропии, что полностью соответствует второму началу термодинамики. Эти процессы и позволят избежать «тепловой смерти Вселенной».
11.6. Статистический смысл
второго начала термодинамики
До сих пор мы использовали термодинамический метод исследования и не интересовались внутренним строением изучаемых систем. Однако существует связь второго начала термодинамики с моле- кулярно-кинетической теорией строения вещества. Рассмотрим это на примере состояния системы молекул газа.
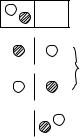
Каждому состоянию газа соответствует некоторое распределение его молекул по объему и определенное распределение молекул по скоростям. Предположим, что в сосуде находятся только две молекулы газа (рис. 11.6). «Цвет» молекул пусть будет соответствовать их скорости. Различные состояния газа различаются только распределением молекул по половинкам сосуда. Можно получить четыре различных распределения молекул. Вероятность каждого из них равна 0,25. Однако эта вероятность будет отличаться от вероятности термодинамического состояния системы. Дело в том, что в однородном газе все молекулы тождественны одна другой, т.е. они неразличимы. Поэтому два из четырех распределений будут тождественны одно
|
|
другому и определят одно из трех возможных |
|
|
|
состояний. Следовательно, вероятность состояния |
|
|
I |
II равна 0,5. |
|
|
|
В целом же вероятность какого-либо состояния |
|
|
|
системы W больше вероятности w отдельного рас- |
|
|
|
||
|
II |
пределения в P раз: |
|
|
|
||
|
|
|
|
|
|
W = wP, |
(11.19) |
|
|
где Р — термодинамическая вероятность |
|
|
|
||
|
III |
состояния системы. Она равна числу всевоз- |
|
|
|
можных микрораспределений частиц по коорди- |
|
|
|
||
Рис. 11. 6 |
натам и скоростям, соответствующих |
данному |
|
149
термодинамическому состоянию (макросостоянию). Необходимо учесть, что W ≤ 1, w ≤ 1, но P ≥ 1. В нашем примере PI = 1, PII = 2,
PIII = 1.
Л. Больцман доказал, что между энтропией системы и термодинамической вероятностью ее состояния существует связь:
S = k ln P, |
(11.20) |
где k — постоянная Больцмана. Эта формула позволяет дать статистическое толкование второго закона термодинамики, утверждающего, что энтропия изолированной системы не убывает: термодинамическая вероятность состояния изолированной системы во всех происходящих в ней процессах не может убывать.
Таким образом, второй закон термодинамики является статистическим законом. Он выражает необходимые закономерности хаотического движения большого числа частиц, входящих в состав изолированной системы.
150
