
- •Оглавление
- •Предисловие
- •Механика
- •КИНЕМАТИКА
- •МЕХАНИЧЕСКИЕ КОЛЕБАНИЯ
- •ОСНОВНЫЕ ПОНЯТИЯ МОЛЕКУЛЯРНОЙ ФИЗИКИ
- •ЭЛЕМЕНТЫ СТАТИСТИЧЕСКОЙ ФИЗИКИ
- •ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •ЯВЛЕНИЯ ПЕРЕНОСА В ГАЗАХ
- •РЕАЛЬНЫЕ ГАЗЫ
- •Электричество и магнетизм
- •ЭЛЕКТРОСТАТИЧЕСКОЕ ПОЛЕ В ВАКУУМЕ
- •ЭЛЕКТРИЧЕСКОЕ ПОЛЕ В ДИЭЛЕКТРИКАХ
- •ПОСТОЯННЫЙ ЭЛЕКТРИЧЕСКИЙ ТОК
- •МАГНИТНОЕ ПОЛЕ ПОСТОЯННОГО ТОКА
- •МАГНИТНОЕ ПОЛЕ В ВЕЩЕСТВЕ. МАГНЕТИКИ
- •ЭЛЕКТРИЧЕСКИЕ КОЛЕБАНИЯ
- •ЭЛЕКТРОМАГНИТНЫЕ ВОЛНЫ
- •Оптика. Основы квантовой механики
- •РАСПРОСТРАНЕНИЕ ЭЛЕКТРОМАГНИТНЫХ ВОЛН
- •КВАНТОВАЯ ОПТИКА
- •ОСНОВЫ КВАНТОВОЙ МЕХАНИКИ

Р а з д е л II
МОЛЕКУЛЯРНАЯ ФИЗИКА
И ТЕРМОДИНАМИКА
Блестящие успехи механики Ньютона в описании движения материальных тел привели к формированию так называемой механической картины мира, сводящей все явления к результатам механических движений различных тел макро- и микроразмеров. В частности, возникла механическая теория тепловых явлений — молекулярная физика.
Молекулярная физика — раздел физической науки, в котором рассматривается зависимость агрегатных состояний и свойств тел от их строения, взаимодействия между частицами, из которых состоят тела, а также характера движения частиц.
Рассмотрим системы, состоящие из большого числа частиц (молекул). Их состояние описывается различными параметрами, поведение которых изучается термодинамическим и молекулярно-статисти- ческим методами, которые взаимно дополняют друг друга. В основе первого лежит применение эмпирических (опытных) законов: общефизического закона сохранения энергии (он в термодинамике называется первым началом термодинамики) и закона, определяющего направление протекания процессов взаимодействия в природе (второе начало термодинамики). Раздел физики, в котором свойства макроскопических систем изучаются с помощью термодинамического метода, называется термодинамикой. В основе молекулярно-статис- тического метода лежит представление о свойствах молекул. Математическая основа этого метода — теория вероятности.
Г л а в а 8
ОСНОВНЫЕ ПОНЯТИЯ МОЛЕКУЛЯРНОЙ ФИЗИКИ
Любая выделенная макроскопическая система, которая рассматривается методами термодинамики, называется термодинамической системой. Все тела, не включенные в состав исследуемой системы, называются внешними телами или внешней средой. Молекулярная физика изучает термодинамические системы, состоящие из огромного числа молекул. Теория строения вещества, базирующаяся на молекулярных представлениях, называется молекулярно-кинетиче- ской. Ее основы заложил в середине XVIII в. М.В. Ломоносов.
99
8.1. Масса и размеры молекул
Для характеристики масс атомов и молекул применяются величины, называемые относительной атомной массой элемента и относительной молекулярной массой вещества. Относительной атомной массой элемента Аr называется отношение массы атома этого
элемента к 1/12 массы изотопа углерода 12C . Относительной моле-
6
кулярной массой вещества Мr называется отношение массы моле-
кулы этого вещества к 1/12 массы изотопа углерода 12C . Как следует
6
из их определения, относительные атомная и молекулярная массы являются безразмерными величинами. Единица массы, равная 1/12
массы изотопа углерода 12C , называется атомной единицей массы
6
(а.е.м.). Если ее обозначить как m , то масса атома может быть
ед
вычислена как Аrm , а масса молекулы как Мrm .
ед ед
Количество вещества, в котором содержится число частиц (атомов, молекул, ионов и т.д.), равное числу атомов в 0,012 кг углерода
12C , называется молем. Из определения единицы количества вещества следует, что в 1 моле любого вещества содержится одно и то же число молекул. Опытным путем было установлено, что это число,
называемое числом Авогадро NA, составляет NA = 6,022æ1023 моль– 1.
Если обозначить массу одной молекулы как m , то масса произволь-
0
ного количества вещества, содержащего ν молей, равна m = m NA ν =
0
= μν. Величина μ = m NA называется молярной массой вещества.
0
Она равна массе всех молекул 1 моля вещества, или отношению массы вещества к содержащемуся в нем количеству вещества.
Для углерода 12C молярная масса μ = 0,012 кг/моль, а масса атома
равна 12m |
. Следовательно, |
|
|
||
ед |
|
|
|
|
|
|
|
|
0,012 = NA12mед , |
|
|
откуда m |
|
= 1,66æ10– 27 кг. Поэтому масса любого атома равна |
|||
ед |
|
|
|
|
|
1,66æ10– 27А |
r |
кг, а масса любой молекулы составляет 1,66æ10–27M |
r |
кг. |
|
Поскольку NA m = 0,001 кг/моль, то масса моля, выраженная в
ед
граммах, численно равна относительной молекулярной массе.
Если мы захотим оценить размер молекул, то приближенную оценку объема одной молекулы можно получить, разделив объем моля вещества на число молекул в моле (число Авогадро). Например, моль
100

воды (т.е. 18 г) занимает объем 18 см3. Следовательно, объем каждой
молекулы равен 3æ10–29 м3. Откуда следует, что линейные размеры
молекулы воды приблизительно равны 3 3æ10– 29 ≈ 3æ10– 10 м. Таким образом, число атомов (или молекул) в любом теле
3æ10– 29 ≈ 3æ10– 10 м. Таким образом, число атомов (или молекул) в любом теле
огромно. Если считать, что движение каждого атома (или молекулы) подчиняется законам классической механики, то практически невозможно даже написать систему дифференциальных уравнений движения такого большого числа молекул. Поэтому поведение отдельной молекулы тела, например ее траектория и скорость, не могут быть изучены методами классической механики. Параметры движения молекулы изменяются во времени случайным образом. Огромная роль молекулярно-кинетической теории в развитии физики состоит в том, что она позволила единым образом подойти к изучению физических явлений, так или иначе связанных с характером движения молекул в телах.
Многие свойства тел в различных агрегатных состояниях объясняются различиями в характере движения атомов (или молекул) в телах. В совокупном поведении большого числа частиц, координаты и импульсы которых случайны в любой момент времени, проявляются особые статистические закономерности. Например, в газе можно определить средние значения скоростей движения молекул и их энергий, однозначно связанных с температурой газа. Свойства макроскопической системы частиц обусловлены не только индивидуальными свойствами самих частиц, но и особенностями их совокупных движений и средними значениями характеристик частиц.
Раздел теоретической физики, в котором с помощью статистического метода изучаются физические свойства макроскопических систем, называется статистической физикой. Связь между динамическими закономерностями, описывающими движение отдельных частиц системы, и статистическими закономерностями заключается в том, что законы движения отдельных частиц после усреднения по всей системе определяют свойства системы частиц, описываемые статистическим методом.
8.2. Параметры термодинамических систем.
Состояние системы. Процесс
Термодинамическими параметрами (параметрами состояния)
называются физические величины, служащие для характеристики состояния термодинамической системы. Примерами термодинамических параметров являются давление, объем, концентрация, температура и др.
101
Простейшим параметром является объем системы V. Он пропорционален количеству вещества в данной системе, поэтому относится к экстенсивным параметрам. Простейшими интенсивными параметрами (они не зависят от количества вещества в системе) являются давление и температура. Давлением называется физическая величина
|
dFn |
|
|
p = |
-------- |
, |
(8.1) |
dS |
где dFn — модуль силы, действующей на малый участок поверхности тела площадью dS перпендикулярно этой поверхности.
Если давление и объем имеют ясный и простой физический смысл, то гораздо более сложным и менее наглядным является понятие температуры. Ему подробно посвящен § 8.4. Однако заметим прежде всего, что понятие температуры имеет смысл только для равновесных состояний системы. Равновесным состоянием называется состояние термодинамической системы, в котором при постоянных внешних условиях остаются постоянными во времени все параметры системы и в системе отсутствуют потоки (например, потоки энергии или вещества). Другими словами, равновесное состояние — это состояние, в которое при неизменных внешних условиях приходит в конце концов термодинамическая система и дальше остается в этом состоянии сколь угодно долго.
Термодинамическим процессом называется любое изменение состояния термодинамической системы, при котором меняются ее термодинамические параметры. В равновесном термодинамическом процессе система проходит непрерывный ряд бесконечно близких термодинамически равновесных состояний. Реальные процессы изменения состояния системы происходят с конечной скоростью и поэтому не могут быть равновесными. Однако такие процессы будут тем ближе к равновесным, чем медленнее они совершаются. Поэтому равновесные процессы называются квазистатическими.
8.3. Основное уравнение
молекулярно-кинетической теории
Рассмотрим движение молекул газа в сосуде и определим давление системы молекул на стенки сосуда. С этой целью выделим элемент поверхности стенки сосуда площадью S, а систему координат для описания движения молекул выберем таким образом, чтобы одна из осей координат (например, ось ОХ ) была перпендикулярна выделенному элементу стенки (рис. 8.1).
Хаотичные соударения молекул со стенками сосуда создают давление газа. При абсолютно упругом соударении со стенкой сосуда
102
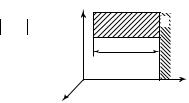
молекула, имеющая проекцию скорости vx, |
Y |
|
||||||
|
|
|
|
|
º |
|
S |
|
|
|
|
|
|
|
|
||
изменяет свой импульс на величину |
p |
= |
|
|
||||
= 2m0vx, где m0 — масса молекулы. Давление |
|
v t |
||||||
газа определится числом ударов молекул на |
|
|
||||||
выделенный элемент стенки площадью S в |
O |
X |
||||||
|
|
|
|
|
|
|
||
единицу времени. Это число |
N равно числу |
Z |
|
|||||
|
|
|
|
|
|
|
|
|
молекул, находящихся в объеме |
V = vxS |
t |
|
|
||||
|
|
|
|
|
|
|
|
Рис. 8. 1 |
(на рис. 8.1 этот объем заштрихован), где |
t = |
|
|
|||||
= 1 с. Число молекул в любом выделенном |
|
|
||||||
объеме определяется произведением концентрации молекул на этот |
||||||||
объем: |
N = n V = nvxS |
t. |
|
|
|
|
|
|
Если предположить равновероятное движение молекул по всем |
||||||||
направлениям в сосуде, то число молекул, движущихся вдоль каждой |
||||||||
из трех осей системы координат, будет одинаковым и составит 1/3 от |
||||||||
общего числа молекул. Вдоль положительного направления оси ОХ |
||||||||
(т.е. по направлению к стенке) будет двигаться половина от этого |
||||||||
числа молекул, т.е. 1/6 общего числа молекул в сосуде. Таким обра- |
||||||||
зом, окончательно получаем, что число молекул, достигающих эле- |
||||||||
мента стенки сосуда площадью S за единицу времени перпендику- |
||||||||
лярно поверхности стенки, составляет |
|
|
|
|
||||
|
|
|
1 |
|
1 |
|
|
|
|
|
|
N = |
---- |
n V = |
---- |
nvxS |
t . |
(8.2) |
|
|
|
6 |
6 |
||||||
Поскольку |
при каждом |
ударе |
стенка |
получает от |
молекулы |
||||
|
|
|
|
|
|
|
|
|
|
|
º |
|
|
|
|
|
|
|
|
импульс |
p |
= 2m0vx, то суммарный импульс, передаваемый стенке |
|||||||
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
º |
|
|
|
за единицу времени, определяем как |
p |
|
N. Давление газа чис- |
||||||
ленно равно суммарному импульсу, передаваемому единице площади стенки за единицу времени. Тогда с учетом (8.2) получим:
|
p |
|
N 2m0vx |
1 |
|
º |
|
|
|
p = |
|
|
= ---------------- |
---- |
|
|
|||
|
S |
S |
6 |
|
|
1 |
2 |
nvxS t = |
---- |
m0vx n . |
3 |
Полученное выражение удобно представить в виде
2 |
|
|
|
p = ---- nW |
, |
(8.3) |
|
3 |
к |
|
|
|
|
|
|
где W = m v 2 / 2— кинетическая энергия одной молекулы газа.
к0
Если скорости движения молекул газа в сосуде разные, т.е. скоростью v i обладает доля молекул от общего числа, равная ni / n, то
кинетические энергии молекул в сосуде можно усреднить, получив
103
|
|
m |
∑n |
v 2 |
|
|
0 |
i |
i |
среднюю кинетическую энергию W = |
------ |
---------------- . Тогда выраже- |
||
|
к |
2 |
n |
|
|
|
|
|
|
ние (8.3) в общем случае можно записать следующим образом: |
||||
2 |
|
|
|
|
p = ---- n W . |
|
|
(8.4) |
|
3 |
к |
|
|
|
Полученное уравнение носит название основного уравнения молекулярно-кинетической теории для давления: давление газа пропорционально произведению средней кинетической энергии движения молекул газа на концентрацию молекул в сосуде.
8.4.Температура
Копределению понятия температуры можно прийти на основании следующих соображений. Если соприкасающиеся тела находятся в состоянии теплового равновесия, то они не обмениваются энергией путем теплопередачи. В этом случае говорится, что оба тела обладают одинаковой температурой. Если же при осуществлении теплового контакта между телами одно из них передает энергию другому посредством теплопередачи, то в таком случае первое тело имеет
большую′ температуру, чем другое. Целый ряд свойств тел — объем, электрическое сопротивление и т.п. — зависит от температуры. Любое из этих свойств может быть использовано для количественного определения температуры.
Пусть в качестве такого свойства выбран объем тела. Приведем тело, выбранное для измерения температуры (термометрическое тело),
в тепловое равновесие с тающим льдом, измерим объем тела V и при-
0
пишем телу в этом случае температуру 0 . Затем приведем это же тело в тепловое равновесие с кипящей при атмосферном давлении
водой, измерим объем тела V и припишем телу в этом состоянии
100
температуру 100 . Если принять, что объем тела изменяется с температурой по линейному закону, то состоянию, в котором тело будет иметь объем V, следует приписать температуру
V – V
0
t = ------------------------æ100° .
V – V
100 0
Такую температурную шкалу установил в 1742 г. шведский физик А. Цельсий (1701—1744). Проградуированный по этой шкале термометр можно использовать для измерения температуры произвольного тела, если приводить термометр в состояние теплового равновесия с телом, температуру которого необходимо измерить.
104
Однако при сравнении термометров, использующих разные термометрические тела, обнаруживается, что показания этих термометров, совпадая по способу градуировки при 0 и 100°, не совпадают при других температурах. На основе второго начала термодинамики может быть установлена температурная шкала, не зависящая от свойств термометрического тела. Эта шкала называется термодинамической шкалой температур. Температура Т, отсчитанная по этой шкале, связана с температурой t по шкале Цельсия соотношением
T = t + 273,15 . |
(8.5) |
Единицу термодинамической (абсолютной) температуры называют Кельвин (обозначается К). Температуру по шкале Цельсия измеряют в градусах Цельсия ( С). Температура, равная 0 К, называется абсолютным нулем, ему соответствует t = – 273,15 С. В дальнейшем (см. § 9.5) будет показано, что абсолютная температура пропорциональна средней кинетической энергии поступательного движения молекул вещества. В этом заключается физический смысл абсолютной температуры.
8.5. Идеальный газ. Уравнение состояния
идеального газа. Изопроцессы идеального газа
Можно доказать, что не все параметры термодинамической системы, находящейся в равновесном состоянии, независимы: внутренние параметры такой системы зависят только от ее внешних параметров и температуры. Уравнение, связывающее любой термодинамический параметр системы с параметрами, принятыми в качестве независимых переменных, называется уравнением состояния. Уравнение состояния, связывающее для однородного тела давление р, объем V и температуру Т, называется термическим уравнением состояния:
f (p, V, T ) = 0 . |
(8.6) |
Конкретный вид функции f в термодинамике предполагается известным из опыта. Теоретический вывод уравнения состояния проводится только методами статистической физики. В этом состоит тесная взаимосвязь между статистическим и термодинамическим методами исследования.
Уравнение состояния (8.6) описывает свойства простых систем, у которых в отсутствие внешних полей имеется один внешний параметр — объем. Простейшим объектом, для которого в термодинамике может быть рассмотрено термическое уравнение состояния, является идеальный газ.
Идеальный газ — это такой газ, молекулы которого имеют пренебрежимо малый собственный объем и не взаимодействуют одна
105

с другой на расстоянии. В реальных газах существуют силы межмолекулярного притяжения и отталкивания. Силы отталкивания проявляются при взаимных столкновениях молекул и со стенками сосуда. Далее покажем, что при взаимных столкновениях молекулы газа
ведут себя как абсолютно упругие шары диаметром D , зависящим
эфф
от химической природы газа. Именно этот эффективный диаметр молекулы свидетельствует о наличии сил отталкивания между молекулами. Межмолекулярные силы притяжения преобладают на бoль′ - ших расстояниях, чем силы отталкивания. Поэтому реальные газы тем ближе по своим свойствам к идеальным газам, чем больше средние расстояния между молекулами, т.е. чем меньше концентрация молекул и соответственно плотность газа. При нормальных условиях,
т.е. при давлении p = 101 325 Па и температуре T = 273,15 К, мно-
0 0
гие газы (водород, гелий, неон, азот, кислород, воздух и др.) можно с хорошим приближением считать идеальными. При таких условиях
концентрация молекул газа составляет n |
≈ 10 25 м– 3, а средние рас- |
0 |
|
стояния между молекулами r ≈ 3 1 ⁄ n |
≈ 10 – 8 м. Силами притя- |
0 |
|
жения молекул можно пренебречь. Суммарный собственный объем
всех молекул газа, содержащихся в 1 м3, составляет V |
= nπd 3 / 6 ≈ |
|
собст |
≈ 10– 5 м3. Следовательно, собственным объемом всех молекул тоже можно пренебречь по сравнению с объемом газа.
В курсе средней школы рассматривается термическое уравнение состояния идеального газа, называемое уравнением Клапейрона:
pV / T = const, |
(8.7) |
т.е. для данной массы идеального газа отношение произведения давления и объема к термодинамической температуре есть величина постоянная. Запишем это уравнение для 1 моля газа в виде
pVm = RT , |
(8.8) |
где Vm — объем 1 моля газа (молярный объем).
Согласно закону Авогадро, при одинаковых давлениях и температурах молярные объемы различных газов также одинаковы. Из этого закона и (8.8) следует, что постоянная R одинакова для всех газов. Ее называют универсальной газовой постоянной. Экспериментально установлено, что R = 8,31 Дж/(моль К). Для произвольной массы газа выражение (8.7) можно переписать следующим образом:
m |
|
|
pV = --- |
RT . |
(8.9) |
μ
106
В такой наиболее общей форме записи термическое уравнение состояния идеального газа называется уравнением Клапейрона— Менделеева. Газ, в точности подчиняющийся уравнению состояния Клапейрона — Менделеева, называется идеальным.
Введем постоянную Больцмана k, равную отношению универсальной газовой постоянной к числу Авогадро:
k = R /N |
A |
= 1,38æ10– 23 |
Дж / К. |
(8.10) |
Тогда из выражения (8.9) легко получить: |
|
|||
|
|
p = nkT, |
|
(8.11) |
где п — концентрация идеального газа.
Примерами простейших термодинамических процессов могут служить следующие процессы:
изотермический процесс, при котором температура системы не меняется (Т = const);
изобарный процесс, при котором давление в системе не меняется (р = const);
изохорный процесс, при котором объем системы не меняется (V = = const).
Эти процессы, происходящие с неизменной массой идеального газа, были изучены и описаны до появления уравнения Клапейрона — Менделеева, и их суть заключена в трех законах идеального газа.
Закон Бойля — Мариотта: если данная масса газа совершает изотермический процесс (Т = const), то произведение давления газа на его объем не изменяется:
pV = const.
Закон Гей-Люссака: если данная масса газа совершает изобарный процесс (p = const), то объем газа изменяется пропорционально его температуре:
V = constæT.
Закон Шарля: если данная масса газа совершает изохорный процесс (V = const), то давление газа изменяется пропорционально его температуре:
p = constæT.
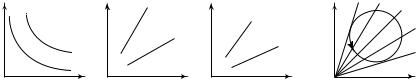
Изохорный, изобарный и изотермический процессы графически изображаются кривыми (соответственно изохорами, изобарами и изотермами) в различных системах координат: ( p,V ); ( p,T ); (V,T ). На рис. 8.2 изображены различные изотермы данной массы газа в координатах (p,V ), различные изобары данной массы газа в координатах (V,T ), различные изохоры данной массы газа в координатах ( p,T ).
107
p |
|
V |
|
|
p |
|
p |
V2 |
|
|
|
p1 |
|
|
|
V |
|
|
|
|
T2 |
|
p |
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
||
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
V |
|
|
|
|
|
|
|
|
|
1 |
||
0 |
V |
0 |
|
T |
0 |
T |
0 |
T |
|
|
а) |
|
б ) |
|
в) |
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 8. 3 |
|
|
|
Рис. 8. 2 |
|
|
|
|
|
||
Отметим то обстоятельство, что график любого изопроцесса разбивает координатную плоскость на две части:
1) во всех состояниях, которые на диаграмме ( p,V ) изображаются
точками, лежащими выше изотермы Т (рис. 8.2, а), температура газа
1
больше, чем Т , т.е. Т > Т ;
1 |
2 |
1 |
2) во всех состояниях, которые на диаграмме (V,T ) изображаются
точками, лежащими ниже изобары р (рис. 8.2, б), давление газа
1
больше, чем р , т.е. р > р
1 |
2 |
1; |
3) во всех состояниях, которые на диаграмме ( p,T ) изображаются
точками, лежащими ниже изохоры V (рис. 8.2, в), объем газа больше,
1
чем V , т.е. V > V .
12 1
Эти факты можно использовать, анализируя произвольные процессы. Допустим, на диаграмме ( p,T ) изображен график некоторого произвольного процесса (рис. 8.3). Проведя на диаграмме семейство изохор и рассмотрев пересечение их с графиком процесса, можно определить, как в этом сложном процессе изменялся занимаемый
газом объем: изохора V соответствует наибольшему объему газа в
1
данном процессе, а изохора V — наименьшему.
2
При рассмотрении смеси N идеальных газов, находящихся в одном сосуде, уравнение состояния (8.9) можно записать в виде:
N
pV = (m1 ⁄ μ1 + m2 ⁄ μ2 + … + mN ⁄ μN)RT = ∑ (mi ⁄ μi)RT .
i = 1
Вместе с тем смесь идеальных газов можно представить таким идеальным газом, для которого будет справедливо соотношение pV =
|
|
N |
= (mсм ⁄ μсм )RT . Учтем, что масса смеси mсм = |
∑ mi , тогда получим |
|
|
|
i = 1 |
|
N |
|
|
∑ mi |
|
|
i = 1 |
(8.12) |
μ = ------------------------- . |
||
см |
N |
|
∑(m ⁄ μ)i
i = 1
108
Выражение (8.12) определяет эффективную молярную массу смеси идеальных газов — молярную массу такого идеального газа, который, имея массу, равную массе смеси газов, в объеме, равном объему смеси, создает давление, равное давлению смеси при температуре, равной температуре смеси.
Модель идеального газа позволяет изучать свойства газов в кинетической теории простейшим образом. Применение всех моделей в физике всегда преследует одну цель — изучить определенную группу физических явлений, абстрагировавшись от ряда реальных условий, усложняющих данные явления. Например, рассматривая модель идеального газа, мы не учитываем, что реальные атомы и молекулы имеют сложную структуру и взаимодействуют между собой.
109
