
- •Лекція 11. Моделювання явищ переносу та теплових явищ в технологічних процесах харчових виробництв
- •11.1. Приведіть класифікацію масообмінних процесів.
- •11.2. Вкажіть особливості застосування масообмінних процесів в харчовій промисловості.
- •11.3. Які характерні особливості застосування закону Фіка в технологічних процесах харчової промисловості?
- •11.4. Які відмінності рівнянь хімічної та біохімічної кінетики?
- •11.6. Сформулюйте закон діючих мас для задач хімічної кінетики.
- •11.7. Охарактеризуйте рівняння Моно – Ієрусалимського і його застосування при моделюванні технологічних процесів харчових виробництв.
- •11.8. Наведіть класифікацію та конструктивні особливості теплообмінників, які застосовуються в харчовій промисловості.
- •11.9. Охарактеризуйте основні змінні, апаратні особливості, характеристики технологічних потоків, які входять в математичні моделі теплообмінників.
- •11.10. Якими типовими математичними моделями можна представити процес теплообміну?
- •11.11. Яким чином визначаються економічні показники використання теплообміного обладнання в промисловості?
- •11.12. Які вимоги висуваються стосовно відношення різниці температур гарячого і холодного теплоносіїв на вході і виході теплообмінників?
- •11.13. Які режимні та конструктивні параметри теплообмінників формують їх динамічні властивості як об’єктів автоматичного керування?
- •11.14. За якими критеріями здійснюється оптимізація функціонування теплообмінників?
- •11.15. Як визначається один із основних показників порівняльної економічної ефективності теплообмінних процесів як наведені витрати?
11.4. Які відмінності рівнянь хімічної та біохімічної кінетики?
Константа
![]() називається константою Міхаеліса, вона
має розмірність концентрації (звичайно
моль/л). На початку реакції S = S0, отже, υ=
υ0. Тоді рівняння для початкової швидкості
реакції:
називається константою Міхаеліса, вона
має розмірність концентрації (звичайно
моль/л). На початку реакції S = S0, отже, υ=
υ0. Тоді рівняння для початкової швидкості
реакції:
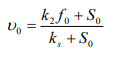
Це рівняння називається рівнянням Міхаеліса— Ментен і є одним із самих фундаментальних рівнянь кінетики ферментативних реакцій. Для опису біохімічних перетворень крім рівняння Міхаеліса— Ментен використовують інші кінетичні співвідношення. Найбільше поширення одержали рівняння Моно і Моно - Ієрусалимського та ін. У моделі Моно:
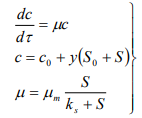
де с0,с — початкова і поточна концентрації біомаси; S0,, S — початкова і поточна концентрації живильних речовин; μm, μ— максимальні і поточні питомі швидкості росту; у — емпіричний коефіцієнт; ks — константа насичення Моно, тобто концентрація субстрату, при якій μ= 0,5μmax Модель Моно—Ієрусалимського відрізняється тим, що питома швидкість росту мікроорганізмів описується рівнянням:
![]()
де kp — константа, що залежить від структури популяції; Р — концентрація інгібіруючого метаболіту. Рівняння Моно - Ієрусалимського трохи модифікував П. И. Ніколаєв:
![]()
де kp — константа росту субстрату, чисельно рівна такій його кількості, у результаті засвоєння якого в одиниці об'єму живильного середовища утвориться концентрація продуктів обміну, що викликає зменшення швидкості росту мікроорганізмів до величини, рівній половині максимальної (μ = 0,5μmах).
Формальні математичні записи відомих фізико-хімічних явищ можуть служити математичними описами процесів, що моделюються, у даній області рішення задачі, обмеженої в найпростіших випадках початковими та граничними умовами.
11.5. Яким чином формується утворення фермент-субстратного комплексу, виходячи із припущення про існування термодинамічної рівноваги між вихідними речовинами (фермент, субстрат) і фермент-субстратним комплексом, згідно з Л.Міхаелісом і М.Ментен?
Взаємодія субстрату (S) з активним центром ферменту (Е) і утворення фермент-субстратного комплексу (ЕS). ... Відділення продуктів реакції від активного центру ферменту і дифузія їх в зовнішнє середовище. Е + S→ЕS* →ЕS**→Е + Р Сам фермент в ході реакції не змінюється і може взаємодіяти з новими молекулами субстрату.
11.6. Сформулюйте закон діючих мас для задач хімічної кінетики.
Відповідно закону дії мас швидкість хімічної реакції пропорційна добутку молярних концентрацій реагуючих речовин у степенях, які дорівнюють значенню стехіометричних коефіцієнтів, що містяться перед речовинами.
Математичний вираз закону діючих мас має вигляд:
![]()
де CA і CB - позначення концентрацій вихідних реагентів А і В, k - константа швидкості, яка не залежить від концентрації реагентів, але залежить від їх природи і температури.
У хімічній термодинаміці: для реакції

![]()
де Ai— символи хімічних речовин, що беруть участь у реакції, Vi — стехіометричні коефіцієнти, концентрації (активності) реагентів ci у стані хімічної рівноваги задовольняють залежність
![]()
де Kc — константа хімічної рівноваги.
Наприклад, при хімічній реакції з вихідними реагентами A та B і продуктами реакції С та D:
aA + bB = cC + dD,
2) У хімічній кінетиці: швидкість елементарної гомогенної реакції, для якої молекулярність збігається з порядком, при сталій температурі є прямопропорційною добуткові концентрацій реактантів у степенях, що дорівнюють стехіометричним коефіцієнтам речовин у рівнянні реакції:
![]()
