
- •Генетически-кодируемые ак: структура и свойства
- •Пептидная связь. Первичная, вторичная, третичная структуры белка. Принципы упаковки белковой молекулы. Типы химических связей.
- •Биологическая роль белков.
- •Пептидная связь. Химический и химико-ферментативный методы синтеза пептидов.
- •Определение первичной последовательности полипептидов.
- •Нуклеозиды и нуклеотиды как компоненты нуклеиновых кислот: структура, физические и химические свойства
- •Олиго- и полинуклеотиды: структура, физические и химические свойства
- •Вторичная структура нуклеиновых кислот: рентгеноструктурные исследования днк, положения Чаргаффа, двойная спираль и ее биологическое значение, комплементарность и взаимная ориентация цепей
- •Рнк: строение, классификация, функции
- •Полимеразная цепная реакция
- •Определение первичной структуры нуклеиновых кислот. Методы химического (по Максаму-Гилберту) и ферментативного (по Сэнгеру) с еквенирования. Автоматизация секвенирования.
- •Химический синтез олигонуклеотидов: основные принципы, синтез на полимерном носителе
- •Олигосахариды: определение, номенклатура, примеры растительных олигосахаридов. Методы изучения строения олигосахаридов.
- •Полисахариды: определение, номенклатура, растительные полисахариды и полисахариды животного происхождения, биологическая роль.
- •Гетерополисахариды и гликопротеины
- •Биологическая роль углеводов
- •Липиды: классификация, роль в живом организме. Простые липиды, воска, жиры и масла: строение и функции.
- •Неомыляемые липиды: строение и функции. Холестерол, стероидные гормоны.
- •Жирные кислоты: насыщенные и ненасыщенные жирные кислоты, незаменимые жирные кислоты, строение и функции.
- •Сложные липиды: классификация, строение, функции.
- •Антибиотики: строение, принципы и направленность действия. Проблема антибиотической устойчивости микроорганизмов.
БИОХИМИЯ БИЛЕТЫ #1-5 (белки)
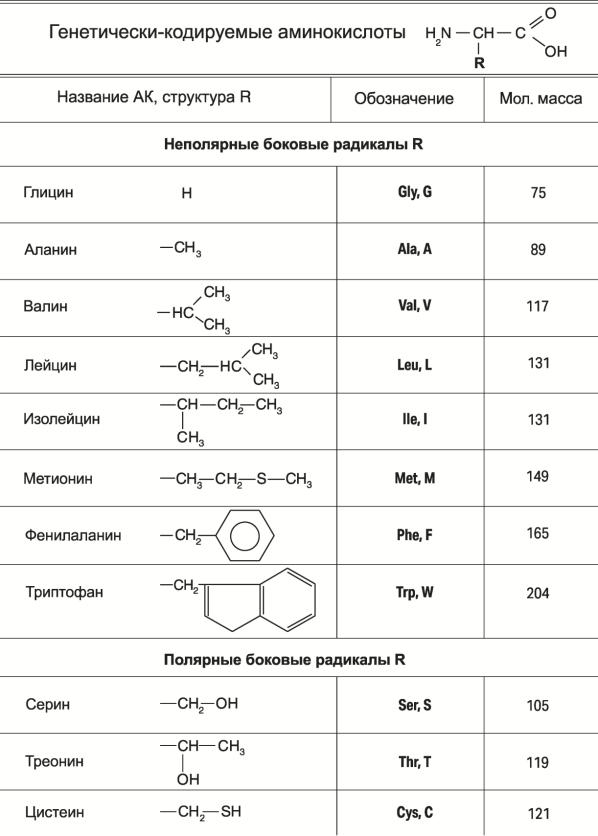
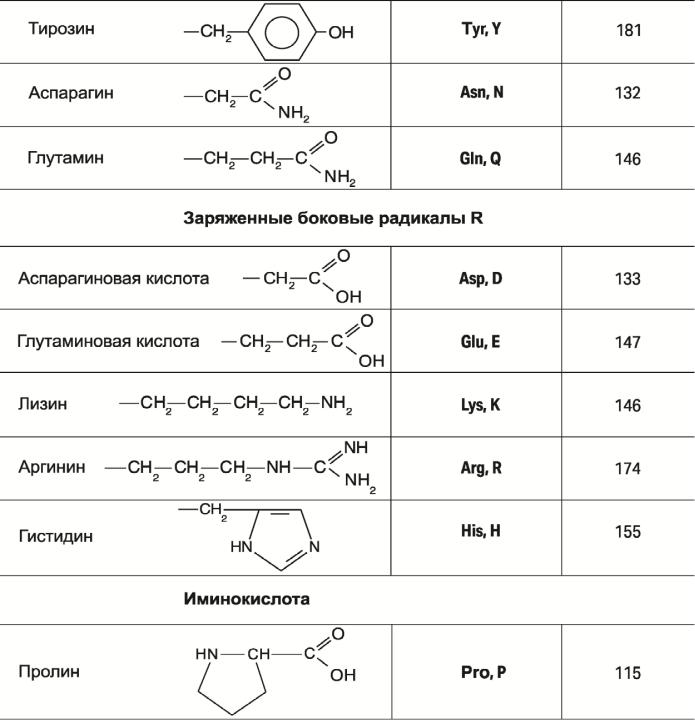
Генетически-кодируемые ак: структура и свойства
АК — мономеры белков. Алифатические и ароматические. Буква — близость атома с аминогруппой к атому с карбоксильной группой.
Главные 20 АК: 9 с гидрофобными R (Gly-G, Ala-A, Val-V, Leu-L, Ile-I, Met-M, Phe-F, Trp-W, Pro-P), 6 с полярными, но не заряженными (Ser-S, Thr-T, Cys-C, Tyr-Y, Asn-N, Gln-Q), 5 с заряженными (Asp-D, Glu-E, Lys-K, Arg-R, His-H).
Структура: H2N — CH — C = O
| |
R OH
Свойства:
— чем меньше боковой радикал, тем свободнее вращение вокруг ковалентной связи альфа-С, тем выше подвижность фрагмента белка;
— старт синтеза всегда с кодона AUG (Met);
— стоп-кодоны: UAA, AUG, UGA;
— гидрофильность/гидрофобность;
— поглощение УФ (280 нм): Phe, Tyr, Trp;
— цистеин — способность окисляться с образованием дисульфидных мостиков S-S;
— амфотерны — сложное поведение в КО-реакциях из-за близости ионизируемых ФГ противоположного характера — основной аминогруппы и кислотной карбоксильной;
— ионное строение молекул: высокая температура плавления (200-300), нелетучесть, растворимость в воде и нерастворимость в неполярных органических растворителях;
— оптически активны: луч плоскополяризованного света, проходя через растворы, поворачивается на угол вправо или влево. Угол Ф пропорционален концентрации раствора с, толщине его слоя (ширине кюветы) d. Коэффициент пропорциональности — удельное вращение a, которое зависит от природы АК, длины волны света, значения pH и температуры: Ф = [a]*c*d;
— способность соединяться в длинные цепи через образование пептидной связи (поликонденсация АК с выделением воды).
Пептидная связь. Первичная, вторичная, третичная структуры белка. Принципы упаковки белковой молекулы. Типы химических связей.
Вид амидной связи, сопряжение свободной пары электронов у атома азота и π-электронов карбонильной группы. Аминогруппа теряет электронно-донорную способность, связь C-N "полуторная" (частично двойной характер), вращение вокруг нее затруднено. Лежит в одной плоскости (планарна). Радикалы могут находиться только под определенными углами.
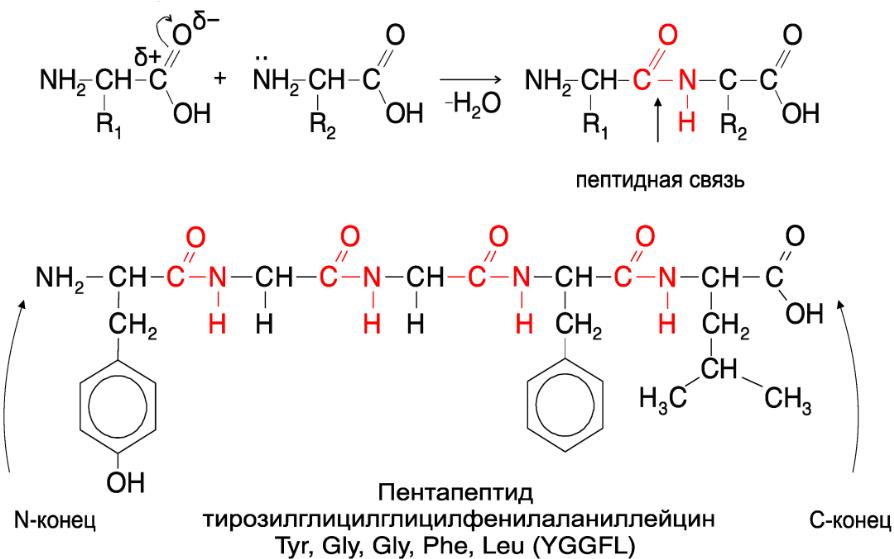
Первичная структура белка — АК состав полипептида и порядок АК. Изображают от N-конца к C-концу.
Вторичная структура белка — пространственная организация небольшого участка полипептидной цепи: α-спираль или β-листы (антипараллельный, параллельный = складчатый). Стабилизируется водородными связями, образуемыми атомами из пептидной связи. Боковые радикалы участия не принимают.
— α-спираль — правозакрученная, 3,6 АК остатка. Некоторые АК дестабилизируют спирали (S, I, T, Y, D, K, R, G) — либо заряженный и поляризованный радикал, либо громоздкий или подвижный;
— β-лист — более стабильны антипараллельные, потому что водородные связи почти перпендикулярны пептидным и короче.
— β-поворот — на участках с пролином (и глицином), потому что у пролина в радикале жесткий пятичленный цикл с зафиксированными углами между атомами углерода. Подвижный глицин пристраивается к пролину и фиксирует его. Поворот на 180 градусов.
Дополнительные структуры (супервторичные): меандры (повторяющиеся бетаслои), бета-альфа-бета мотивы, греческий ключ (4 бета-слоя).
Третичная структура — пространственное расположение элементов вторичной структуры относительно друг друга. Белковая молекула в растворе испытывает на себе воздействия среды (электростатика, броуновское движение, архимедова сила, сила тяжести, трение), и все направлено на то, чтобы энергия молекулы была минимальной. Ключевая роль — взаимодействия функциональных групп боковых радикалов АК; определяет биологическую активность.
Четвертичная структура — образуют несколько независимо сфолдингованных (процесс образования пространственной структуры) полипептидных цепей для эффективного выполнения функции белка. Полипептиды в составе = субъединицы.
Связи: ковалентные, ионные, водородные, гидрофобные, дипольные, Ван-дер Ваальсовые (атомы боковых радикалов).
— ковалентные — самые прочные, 210 кДж/моль (S-S);
— ионные (электростатические) — между разнозаряженными боковыми радикала (лизин+ аргинин+ и аспарагин- глутаминовая-), 45 кДж/моль;
— водородные — поляризованные боковые радикалы с гидроксильными, амидными и тиогруппами, 8-12 кДж/моль;
— гидрофобные взаимодействия, 4-8,5 кДж/моль. В водных растворах неполярные радикалы внутрь молекулы (гидрофобное ядро), на поверхности гидрофильные образуют водородные и ионные связи;
— Ван-дер-Ваальсовы взаимодействия, 0,5 кДж/моль, в них участвуют все-все атомы: между атомами и молекулами, которые являются постоянными диполями. Зависит от расстояния между частицами.
