
- •Параметри стану|достатку|
- •Рівняння стану|достатку| ідеального газа
- •I закон термодинаміки
- •3.1. Теплоємність
- •4. II закон термодинаміки
- •5. Термодинамічні процеси
- •Реальні гази
- •Пари, основні визначення
- •8. Вологе|вогке| повітря
- •9. Витікання газів і пари
- •10. Цикли двз
- •11. Цикли гту
- •12. Цикли парових установок
- •13. Цикли холодильних установок
- •14. Теорія теплообміну
- •15. Теплопровідність
- •15.1 Теплопровідність через плоску стінку
- •Теплопровідність через циліндрову стінку
- •16. Конвективний теплообмін
- •17.Теплопередача
- •17.1 Плоска стінка
- •17.2 Циліндрична стінка
- •18. Теплообмінні|теплообмін| апарати
- •18.1 Класифікація апаратів
- •18.2 Схеми руху теплоносіїв
- •18.3 Основні рівняння розрахунку теплообмінних|теплообмін| апаратів
- •19. Паливо|пальне|
- •20. Котельні агрегати
Параметри стану|достатку|
Фізичні величини, що визначають стан|достаток| речовини, називаються параметрами стану|достатку|. Вони підрозділяються на термічні і калоричні|.
Термічні параметри:
Тиск – сила, що діє по нормалі до одиниці площі. Ра = Рб + Рм; Ра – абсолютний тиск; Рб – барометричний тиск; Рм – манометричний (надлишковий тиск) Рв = Рб - Ра Рв – вакуум (розрідження) Одиниці вимірювання тиску
Т,К = toC + 273 3. Об’єм V, м3 Питомий об’єм - v, м3/кг
|
Калоричні параметри: 1.Внутрішня
енергія –
Питома
внутрішня енергія -
Зміна внутрішньої енергії
2. Ентальпія – I або Н, Дж
Питома ентальпія i або (h), Дж/кг
Зміна ентальпії Δі Δ 3. Ентропія – S, Дж/К Питома ентропія
Для
ідеального газу:
Для
реального газу
S – функція параметрів стану s=f(Р,V,t).
|
Рівняння стану|достатку| ідеального газа
Ідеальним газом називається газ між молекулами якого відсутні сили тяжіння і відштовхування, а молекули і атоми цього газу взаємодіють між собою як матеріальні точки|точки|.
Найбільш просте рівняння стану|достатку| – це рівняння Менделєєва – Клапейрона.
Для , кг| газу; для 1кг| газу:
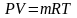 ;
;
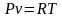
Газова
стала
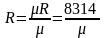 ;
;
;
;
 - молекулярна вага газу
- молекулярна вага газу
I закон термодинаміки
Теплота – форма передачі енергії за допомогою елементарних частинок|частинок|, що хаотично переміщаються. Повна|цілковита| теплота – Q, Дж; питома теплота – q=Q/m, Дж/кг.
Робота – форма передачі енергії, що характеризується переміщенням тіл в просторі|простір-час|. Повна|цілковита| робота – L, питома робота l=L/m Дж/кг .
Робота і теплота визначаються за формулами:
|
|
Формулювання I закону термодинаміки:
Повна енергія ізольованої термодинамічної системи залишається постійною при будь-яких процесах, що відбуваються в системі, або
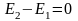 .
.Теплота, що підводиться до тіла або системи в термодинамічному процесі, витрачається на зміну внутрішньої енергії і здійснення роботи для газу масою m: Q=ΔU+L; для 1кг: q=Δu+l; у диференціальній формі: dq=du+dl=du+pdv або dq=di-vdp.
Неможливо побудувати таку теплову машину, в якій роботи вироблялося б більше, ніж кількість теплоти, що підводиться (вічний двигун першого роду неможливий).
3.1. Теплоємність
Теплоємністю називається кількість теплоти, що підводиться (відводиться|відводить|) до одиниці кількості речовини, для зміни температури на один градус С
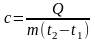 ;
;
де
Q –
кількість теплоти, Дж;
- кількість речовини;
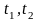 - початкова і кінцева|скінченна|
температури. Залежно від одиниці
кількості речовини розрізняють такі
питомі теплоємності:
- початкова і кінцева|скінченна|
температури. Залежно від одиниці
кількості речовини розрізняють такі
питомі теплоємності:
1. Масова теплоємність – с, Дж/(кг∙К);|із|
2.
Об'ємна теплоємність -
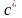 ,
Дж/(кг∙К);
,
Дж/(кг∙К);
3.
Молярна теплоємність -
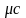 ,
Дж/(кмоль∙К).
,
Дж/(кмоль∙К).
Теплота може:
1. Не залежати від температури, тоді
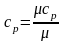 ;
;

2.
Залежати від температури лінійно
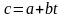 або не лінійно
або не лінійно

де
 - коефіцієнти,
- коефіцієнти,
 - температура
- температура
Якщо
теплоємність визначається в межах
якоїсь однієї температури, то така
теплоємність називається істинною
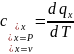 ;
якщо її визначають в інтервалі температур,
то теплоємність називають середньою
;
якщо її визначають в інтервалі температур,
то теплоємність називають середньою
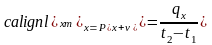 .
.
Якщо
теплота підводиться в процесі з постійним
тиском,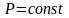 ,
то такі теплоємності називають
ізобарними:
,
то такі теплоємності називають
ізобарними: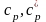 ,
, ;
якщо ж теплота підводиться в процесі з
постійним об'ємом
;
якщо ж теплота підводиться в процесі з
постійним об'ємом
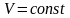 ,
то такі теплоємності називають ізохорними:
,
то такі теплоємності називають ізохорними:
 .
.
При лінійній залежності значення теплоємності визначають експериментально|експериментальний| (дослідом|дослідом|) і заносять в таблиці. Тоді середня теплоємність

х=Р
х=v

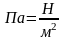

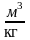 ;
;
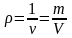
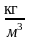
 - густина речовини;
- густина речовини; - маса речовини.
- маса речовини.
 ,
Дж
,
Дж
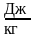
 Δ
Δ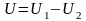

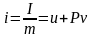

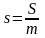
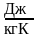 ;
;

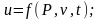

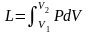 ,
,
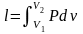 ;
;

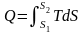 ,
,
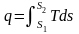 ,
,
