
- •Метаболизм
- •Макроэргические соединения
- •Биологическое окисление
- •Тканевое дыхание
- •Митохондриальное окисление (МтО)
- •Главная (полная) цепь
- •Укороченная (сокращенная) цепь
- •Никотинамидные дегидрогеназы (надг)
- •Комплекс I
- •Комплекс III.
- •Комплекс IV.
- •Желтые окислительные ферменты
- •Цитохромная система
- •1. Полная дыхательная цепь
- •2. Сокращенная (укороченная) дыхательная цепь
- •3. Максимально сокращенная (максимально укороченная) дыхательная цепь.
- •Терморегуляторная функция тканевого дыхания.
- •Окислительное декарбоксилирование пировиноградной кислоты Окислительное декарбоксилирование пировиноградной
- •Окислительное декарбоксилирование пирувата
- •Цитратный цикл
- •Образование цитрата
- •Превращение цитрата в изоцитрат
- •Окислительное декарбоксилирование изоцитрата
- •Превращение сукцинил-КоА в сукцинат
- •Дегидрирование сукцината
- •Образование малата из фумарата
- •Дегидрирование малата
- •Цикл трикарбоновых кислот
- •Автономная саморегуляция цтк
- •Параметаболизм
- •Некоторые параметаболические процессы
Цитохромная система
Цитохромы или гемопротеины присутствуют во всех типах организмов
—обозначаются латинскими буквами в,с1,с,а,а3.
—Основная функция цитохромов – перенос электронов. Комплекс цитохромов в и с1 функционирует как QH2 – дегидрогеназа: он осуществляет перенос электронов с QH2 на цитохром С. Комплекс цитохромов а и а3 действует как цитохриомокисдаза.
—Цитохромоксидаза помимо гема содержит ионы меди, которые участвуют в переносе электронов(этот комплекс цитохромов перенеосит электроны с цитохромы на кислород)
—В клетках эукариотов они локализованы в митохондриальных мембранах и в ЭР. Известно около 30 различных цитохромов. Все цитохромы в качестве простетической группы содержат гем . Их многообразие обусловлено:
различием боковых цепей в структуре тема;
различием в структуре полипептидных цепей;
различием в способе связи полипептидных цепей с гемом.
В зависимости от способности поглощать свет в определённой части спектра все цитохромы делят на группы а, b, с. Внутри каждой группы отдельные виды с уникальными спектральными свойствами обозначают цифровыми индексами (b, b1, b2 и т.д.).
Структурные особенности разных видов цитохромов определяют различие в их окислительно-восстановительных потенциалах. В ЦПЭ участвуют 5 типов цитохромов (а, а3, b, с, с1). За исключением цитохрома с, все цитохромы находятся во внутренней мембране митохондрий в виде сложных белковых комплексов.
QН2-дегидрогеназа (коэнзим Q-цитохром с-ре-уктаза, комплекс III) состоит из 2 типов цитохромов (b1 и b2) и цитохрома с1. QН2-дегидрогеназа переносит электроны от убихинола на цитохром с. Внутри комплекса III электроны передаются от цитохромов b на FeS-центры, на цитохром с1, а затем на цитохром с. Группы тема, подобно FeS-центрам, переносят только по одному электрону. Таким образом, от молекулы QH2 2 электрона переносятся на 2 молекулы цитохрома b. В качестве промежуточного продукта в этих реакциях переноса электронов возможно образование свободного радикала се-михинона. В цитохромах типа b гем не связан ковалентно с белком, а в цитохромах с1 и с он присоединяется к белку при помощи тиоэфирных связей. Эти связи образуются путём присоединения 2 цистеиновых остатков к винильным группам гема.
Цитохром С - периферический водорастворимый мембранный белок с молекулярной массой 12 500 Д, имеющий одну полипептидную цепь из 100 аминокислотных остатков, и молекулу гема, ковалентно связанную с полипептидом.
Цитохромоксидаза (комплекс IV) состоит из 2 цитохромов типа аа3 каждый из которых имеет центр связывания с кислородом. Цитохромы а и а3 имеют характерную железопорфириновую простетическую группу, называемую гемом А и отличающуюся от гема цитохромов с и c1. Он содержит формильную группу вместо одной из метальных групп и углеводородную цепь вместо одной из винильных групп. Другая особенность комплекса а-а3 - наличие в нём ионов меди, связанных с белковой астью в так называемых CuA-центрах. Перенос электронов комплексом а-а3 включает реакции:
Cu+ ↔ Cu2+ + e, Fe2+ ↔ Fe3+ + e.
Комплекс цитохромов а-а3 непосредственно реагирует с молекулярным кислородом
СХЕМА ТКАНЕВОГО ДЫХАНИЯ
Организация дыхательной цепи
По современным представлениям внутренняя мембрана митохондрий содержит 5 мультиферментных комплексов, включающих множество дыхательных ферментов. Последовательность их расположения – дыхательная цепь.
Компоненты комплексов расположены в порядке возрастания их окислительно-восстановительных потенциалов (редокс-потенциалов). Его величина связана с изменением свободной энергии. Её выражают в вольтах.
Принцип работы дыхательной цепи
1.Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают протоны водорода Н+ и электроны (ē) на ферменты дыхательной цепи.
2. ē движутся по ферментам дыхательной цепи и теряют энергию.
3. Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство.
4. В конце дыхательной цепи ē попадают на О2 и восстанавливают его до Н2О.
5. Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу (V комплекс).
6. При этом Н+ теряют энергию, которая используется для синтеза АТФ.
Переносчики в дыхательной цепи
I комплекс – НАДН-дегидрогеназа
В комплекс входят две группы: ФМН и FeS (железо-серные белки).
На ФМН комплекса протоны Н+ и 2ē от субстратов передают НАД-зависимые дегидрогеназы, находящиеся в матриксе, с образованием ФМНН2. ФМНН2 ē и протоны транспортируют на FeS, затем на кофермент Q (убихинон). Одновременно с комплекса протоны Н+ переносятся в межмембранное пространство (ММП).
II комплекс - ФАД- зависимые дегидрогеназы.
Состоит из ФАД и FeS. На ФАД ē и протоны отщепляются от субстратов окисления ФАД. ФАД восстанавливается в ФАДН2. С ФАДН2 они передаются на FeS, с FeS – на убихинон.
Убихинон – или кофермент Q. Это небелковый переносчик. Структура КоQ сходна с витаминами К, Е.
Молекулы Q в организме человека содержат 10 изопреноидных звеньев и обозначаются - Q10.
Убихинон является коллектором всех ē, поступающих в митохондрии от разных субстратов и передает их на III комплекс.
Цитохромы
Обнаружены в 1886г. Мак-Мунном, исследованы в 1925г. Девидом Кейлином.
Цитохромы (Ц)- это сложные белки-гемопротеины, которые в качестве простетической группы содержат гем
Известно около 30 различных Ц.
Цитохромы имеют особенности:
Железо в Ц способно изменять свою степень окисления, поэтому Ц в ЦПЭ транспортируют только ē
В транспорте двух ē принимают участие две молекулы каждого вида цитохромов, так как одна молекула может переносить только один ē.
III комплекс -QН2-дегидрогеназа
III комплекс включает 2 типа Ц: в, с1 и FeS.
ē передаются от Ц в на FeS-центры, затем на Ц с1 и на Ц с. Одновременно с комплекса протоны Н+ переносятся в ММП.
Цитохром С - периферический водорастворимый мембранный белок, имеющий одну полипептидную цепь из 100 аминокислотных остатков и молекулу гема, ковалентно связанную с полипептидом. От Ц с ē переносятся на IV комплекс.
IV комплекс- цитохромоксидаза
В IV комплекс входят два цитохрома а и а3, каждый из которых имеет центр связывания с кислородом.
В комплексе содержатся 2 иона меди.
С комплекса протоны Н+ переносятся в ММП.
IV комплекс транспортирует ē непосредственно на молекулярный кислород, активируя его:

 аа3
½
О2
О
аа3
½
О2
О
У активированного О2 появляются две свободные валентности, к которым присоединяются 2 протона Н+, поступающие из матрикса. Это приводит к образованию Н2О.

V комплекс – АТФ-синтаза
АТФ-синтаза состоит из двух белковых субъединиц.
Гидрофобная - F0 погружена в мембрану.
Функция – каналообразующая, по ней протоны переносятся в матрикс.
Субъединица F1 выступает в матрикс.
Ф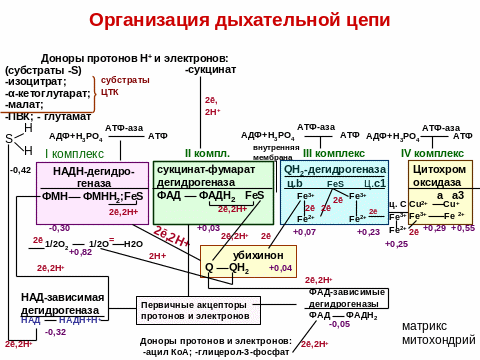 ункция
– каталитическая, используя энергию
протонов, синтезирует АТФ.
ункция
– каталитическая, используя энергию
протонов, синтезирует АТФ.
внутренняя мембрана
Так как электроны всегда стремятся переходить от электроотрицательных систем к электроположительным, их транспорт по ЦПЭ к кислороду сопровождается относительно большим снижением свободной энергии.
В ЦПЭ можно выделить 3 участка, в которых перенос электронов сопровождается относительно большим снижением свободной энергии. Это количество свободной энергии необходимо для синтеза АТФ из АДФ и фосфата (фосфорилирование).
Процесс переноса электронов по ЦПЭ и синтез АТФ энергетически сопряжены.
Синтез АТФ из АДФ и Н3РО4 за счет энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием.
Механизм сопряжения окончательно не выяснен, наиболее обоснованной является хемиосмотическая теория Митчелла, предложенная в 1961г.
Перенос электронов по ЦПЭ от НАДН к кислороду сопровождается выкачиванием протонов из матрикса митохондрий через внутреннюю мембрану в межмембранное пространство.
Протоны, перенесенные из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана не проницаема для протонов.
Т аким
образом, создается протонный градиент,
при котором концентрация протонов в
межмембранном пространстве больше, а
рН меньше, чем в матриксе. Кроме того,
каждый протон несет положительный
заряд, и вследствие этого появляется
разность потенциалов по обе стороны
мембраны: отрицательный заряд – на
внутренней стороне, положительный заряд
– на внешней. В совокупности электрический
и концентрационный градиенты составляют
электрохимический
потенциал ΔμН+
- источник энергии для синтеза АТФ.
аким
образом, создается протонный градиент,
при котором концентрация протонов в
межмембранном пространстве больше, а
рН меньше, чем в матриксе. Кроме того,
каждый протон несет положительный
заряд, и вследствие этого появляется
разность потенциалов по обе стороны
мембраны: отрицательный заряд – на
внутренней стороне, положительный заряд
– на внешней. В совокупности электрический
и концентрационный градиенты составляют
электрохимический
потенциал ΔμН+
- источник энергии для синтеза АТФ.
Энергия электрохимического потенциала (ΔμН+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы (V комплекс).
Наиболее активный транспорт протонов в межмембранное пространство, необходимый для образования ΔμН+ происходит на участках ЦПЭ, соответствующих расположению комплексов I, III, IV. Эти участки называют пунктами сопряжения дыхания и фосфорилирования, где и происходит синтез АТФ.
ВАРИАНТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ.
