
- •ТЕМА I. ВИДЫ КОНЦЕНТРАЦИЙ. ЗАКОН ЭКВИВАЛЕНТОВ
- •1.2. Растворы. Способы выражения концентрации растворов
- •1.3. Закон эквивалентов
- •Ответы к тесту на стр. 193
- •ТЕМА II. ТЕРМОДИНАМИКА
- •2.1. Основные понятия и определения
- •2.2. Первое начало термодинамики
- •2.3. Закон Гесса. следствия из него
- •2.4. Второе начало термодинамики. Энтропия
- •2.5. Энергия Гиббса и направление химических реакций
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ II. ТЕРМОДИНАМИКА
- •Ответы к тесту на стр. 200
- •ТЕМА III. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •3.1. Химическая кинетика. Скорость химической реакции и факторы, на нее влияющие
- •3.2. Химическое равновесие
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ III. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •Ответы к тесту на стр. 207
- •ТЕМА IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •4.1. Понятие об электролитах и неэлектролитах. Электролитическая диссоциация. Степень диссоциации, константа ионизации. Закон разбавления Оствальда
- •4.2. Ионизация воды. Ионное произведение воды. Водородный и гидроксильный показатели (рН и рОН)
- •4.3. Сильные электролиты. Активность ионов
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •Ответы к тесту на стр. 210
- •ТЕМА V. БУФЕРНЫЕ СИСТЕМЫ
- •5.1. Основные понятия и определения
- •5.2. Расчет рН буферных систем I типа
- •5.3. Расчет рН и рОН буферных систем II типа
- •5.4. Механизм буферного действия
- •5.5. Расчет буферной емкости
- •5.6. Оценка буферной емкости и буферное отношение. Факторы, определяющие емкость буфера
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ V. БУФЕРНЫЕ СИСТЕМЫ
- •Ответы к тесту на стр. 224
- •ТЕМА VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •6.1. Осмотические свойства растворов
- •6.2. Закон Рауля и следствия из него
- •Криоскопия. Эбулиоскопия
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •Ответы к тесту на стр. 232
- •ТЕМА VII. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •7.1. Понятие о произведении растворимости
- •7.2. Насыщенные, ненасыщенные, пересыщенные растворы с точки зрения теории произведения растворимости
- •7.3. Практическое применение ПР. Растворимость веществ
- •7.4. Условия растворения осадков
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VII ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •Ответы к тесту на стр. 238
- •8.1. Поверхностное натяжение: физический смысл, факторы, от которых зависит σ
- •8.2. Адсорбция на поверхности жидкости. Правило Дюкло-Траубе
- •8.3. Адсорбция на твердых сорбентах
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
- •Ответы к тесту на стр. 253
- •9.1. Классификация дисперсных систем
- •9.2. Методы получения лиофобных коллоидов
- •9.3. Строение коллоидной мицеллы
- •9.4. Двойной электрический слой и электрокинетические явления
- •9.5. Коагуляция лиофобных коллоидов
- •9.6. Стабилизация золей. Коллоидная защита. Очистка золей. Гели
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ IX. ДИСПЕРСНЫЕ СИСТЕМЫ
- •Ответы к тесту на стр. 261
- •Тема Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •10.1. Понятие о комплексных соединениях. Строение комплексных соединений
- •10.2. Классификация и номенклатура комплексных соединений
- •10.3. Поведение комплексных соединений в растворе
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •Ответы к тесту на стр.268
- •ТЕМА XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •11.1. Степень окисления
- •11.3. Типы окислительно-восстановительных реакций
- •11.4. Методы составления ОВР
- •11.5. Расчет молярной массы эквивалента окислителя и восстановителя
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •Ответы к тесту на стр. 274
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ V. БУФЕРНЫЕ СИСТЕМЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VII ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ IX. ДИСПЕРСНЫЕ СИСТЕМЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •ТЕСТОВЫЕ ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ СТУДЕНТОВ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ СТУДЕНТОВ
- •ПРИЛОЖЕНИЯ
- •РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
камни, в суставной ткани - выпадение солей мочевой кислоты (подагра).
9.2. Методы получения лиофобных коллоидов
Условия образования коллоидных растворов:
1.Наличие лиофобного растворителя.
2.Малая концентрация частиц ДФ (1-2%).
3.Наличие в системе стабилизаторов – веществ, препятствующих процессу самопроизвольного укрупнения коллоидных частиц и поддерживающих устойчивость системы. Роль стабилизаторов выполняют электролиты, ПАВ, ВМС.
Коллоидные системы по степени дисперсности занимают промежуточное положение между истинными растворами (молекулярноили ионно-дисперсными системами)
игрубодисперсными системами. Поэтому коллоидные растворы могут быть получены либо путем ассоциации (конденсации) молекул и ионов истинных растворов, либо дальнейшим раздроблением частиц дисперсной фазы грубодисперсных систем.
Методы получения коллоидных растворов также можно разделить на две группы: методы конденсации и диспер-
гирования.
Дисперсионные методы
Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании, таким образом, коллоидных растворов. Процесс диспергирования осуществляется различными методами. В зависимости от способа измельчения различают:
1.Физическое диспергирование
1.1.Механическое диспергирование - механическое размалывание твердого вещества в т.н. коллоидных мельницах;
1.2.Электрическое диспергирование - электродуговое распыление металлов;
1.3.Ультразвуковое диспергирование - дробление вещества при помощи ультразвука.
2. Химическое диспергирование (пептизация) - химическое разъединение частиц ДФ путем неполного растворения осадка.
142
Конденсационные методы
Конденсационные методы основаны на объединении молекул (ионов) в более крупные коллоидные частицы. Различают физическую и химическую конденсацию.
1. Физическая конденсация
1.1.Пары вещества конденсируются при охлаждении в более крупные частицы жидкого или твердого вещества
1.2.Вещество, находящееся в молекулярно-дисперсном состоянии, можно перевести в коллоидное состояние при замене одного растворителя другим – т.н. методом замены растворителя. Молекулы растворенного вещества, находящегося
всостоянии молекулярной дисперсности в одном растворителе, попадая в условия плохой растворимости при замене растворителя, начинают конденсироваться в более крупные коллоидные частицы. В качестве примера можно привести получение золя канифоли (или йода), которая не растворяется в воде, но хорошо растворима в этаноле. При постепенном добавлении спиртового раствора канифоли (или йода) к воде происходит резкое понижение растворимости канифоли, в результате чего образуется коллоидный раствор канифоли в воде. Аналогичным образом может быть получен гидрозоль серы.
2. Химическая конденсация Коллоидные растворы можно получать методом
химической конденсации, основанном на проведении химических реакций, сопровождающихся образованием нерастворимых или малорастворимых веществ. Для этой цели используются различные типы реакций.
1.1.Рекции ионного обмена, когда два сложных вещества обмениваются составными частями. При этом берется избыток одного из реагирующих веществ, которое выполняет роль стабилизатора
1.2.Реакции гидролиза – взаимодействия соли с водой с образованием слабого электролита. При этом роль стабилизатора выступает соль, подвергающаяся гидролизу
1.3.Окислительно-восстановительные реакции.
9.3. Строение коллоидной мицеллы
143
Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия (метод химической конденсации по реакции обмена):
AgNO3+ KI → AgI + KNO3
Если исходные вещества взяты в эквивалентных отношениях и концентрация их велика, коллоидного раствора не получится. Образуется осадок AgI. Если взять одно из исходных веществ в избытке, оно будет выполнять роль стабилизатора. При этом видимого глазу осадка не образуется, а получается
ультрагетерогенная коллоидная |
система, состоящая из |
микрокристаллов AgI. |
|
Если образование коллоидной частицы происходит в результате реакции обмена, то
1.Чтобы не выпал осадок одно из исходных веществ берется в избытке.
2.То вещество, которое взято в избытке является стабилизатором.
3.То вещество, которое должно выпасть в осадок входит в состав ядра коллоидной частицы.
Например, возьмем в избытке нитрат серебра
AgNO3(избыток) + KI → AgI(микрокристаллы) + KNO3
Запишем уравнение диссоциации стабилизатора. Учтем, что в растворе присутствует n моль AgNO3.
nAgNO3→ nAg+ + nNO3-
Ионы стабилизатора избирательно адсорбируются на поверхности микрокристаллов согласно правилам ПанетаФаянса. Коллоидная мицелла золя иодида серебра (см. рис. 1) образована микрокристаллом иодида серебра, который способен к избирательной адсорбции из окружающей среды катионов Ag+
или йодид-ионов. По первому правилу Панета-Фаянса на поверхности полярного сорбента в первую очередь адсорбируются ионы, входящие в состав кристаллической решетки сорбента. Поскольку реакция проводится в избытке нитрата серебра на поверхности микрокристалла, в первую
144
очередь адсорбируются ионы Ag+. В результате этого микрокристалл приобретает положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими (ПОИ). Они придают поверхности ядра заряд. Далее по второму правилу Панета-Фаянса на заряженной поверхности из раствора адсорбируются ионы с противоположным зарядом – противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на заряженной поверхности ядра, образуя вместе с потенциалопределяющими ионами т.н. адсорбционный слой; ядро вместе с адсорбционным слоем называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
Обозначения, применяемые при схематической записи мицеллы
mAgI – ядро мицеллы(микрокристалл), нерастворимый в воде агрегат
n – число потенциалопределяющих ионов Ag+ стабилизатора AgNO3
nAg+ - слой потенциалопределяющих ионов, определяют знак заряда гранулы
(n-х) – число противоионов NO3-стабилизатора AgNO3 (n-х) NO3- - слой противоионов
х –количество ионов NO3- , которое на ядре не адсорбируется, а располагается в ДС в качестве диффузионного слоя.
хNO3- - диффузный слой. Ионы Ag+ и часть ионов NO3- адсорбируется на ядре, сообщая грануле заряд «х+», что обуславливает агрегативную устойчивость. Заряд гранулы противоположен заряду диффузионной части мицеллы. В целом мицелла электронейтральна.
уН2О - гидратная оболочка Схематически мицелла золя иодида серебра,
полученного в избытке нитрата серебра может быть изображена
145
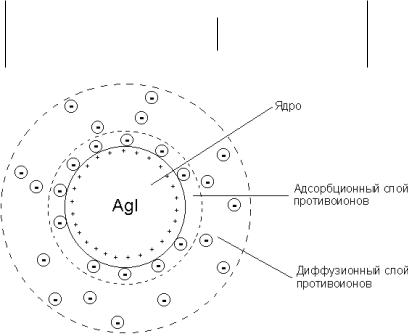
следующим образом, При этом коллоидные частицы (гранулы) будут иметь положительный заряд:
{[mAgI] ∙
ядро
nAg+ (n-x)NO3- |
} x+∙xNO3- ∙ yH2O |
ПОИ противоионы |
диф.слой гидрат.оболочка |
|
|
адсорбционный слоймицеллы |
|
 гранула
гранула 
 мицелла
мицелла 
Рис. 1. Строение коллоидной мицеллы йодида серебра, стабилизатор нитрат серебра
При получении золя иодида серебра с отрицательно
заряженной гранулой в |
реакции образования йодида серебра |
в избытке должен быть взят иодид калия |
|
AgNO3+ KI(избыток) |
→ AgI(микрокристаллы) + KNO3 |
Запишем уравнение диссоциации стабилизатора. Учтем,
что в растворе присутствует n моль KI. n KI → n K + + nI -
В данном случае потенциалопределяющие ионы – анионы I–, противоионы – ионы К+. Мицелла золя йодида серебра, полученного в избытке йодида калия может быть изображена следующим образом:
146
