
- •ТЕМА I. ВИДЫ КОНЦЕНТРАЦИЙ. ЗАКОН ЭКВИВАЛЕНТОВ
- •1.2. Растворы. Способы выражения концентрации растворов
- •1.3. Закон эквивалентов
- •Ответы к тесту на стр. 193
- •ТЕМА II. ТЕРМОДИНАМИКА
- •2.1. Основные понятия и определения
- •2.2. Первое начало термодинамики
- •2.3. Закон Гесса. следствия из него
- •2.4. Второе начало термодинамики. Энтропия
- •2.5. Энергия Гиббса и направление химических реакций
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ II. ТЕРМОДИНАМИКА
- •Ответы к тесту на стр. 200
- •ТЕМА III. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •3.1. Химическая кинетика. Скорость химической реакции и факторы, на нее влияющие
- •3.2. Химическое равновесие
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ III. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •Ответы к тесту на стр. 207
- •ТЕМА IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •4.1. Понятие об электролитах и неэлектролитах. Электролитическая диссоциация. Степень диссоциации, константа ионизации. Закон разбавления Оствальда
- •4.2. Ионизация воды. Ионное произведение воды. Водородный и гидроксильный показатели (рН и рОН)
- •4.3. Сильные электролиты. Активность ионов
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •Ответы к тесту на стр. 210
- •ТЕМА V. БУФЕРНЫЕ СИСТЕМЫ
- •5.1. Основные понятия и определения
- •5.2. Расчет рН буферных систем I типа
- •5.3. Расчет рН и рОН буферных систем II типа
- •5.4. Механизм буферного действия
- •5.5. Расчет буферной емкости
- •5.6. Оценка буферной емкости и буферное отношение. Факторы, определяющие емкость буфера
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ V. БУФЕРНЫЕ СИСТЕМЫ
- •Ответы к тесту на стр. 224
- •ТЕМА VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •6.1. Осмотические свойства растворов
- •6.2. Закон Рауля и следствия из него
- •Криоскопия. Эбулиоскопия
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •Ответы к тесту на стр. 232
- •ТЕМА VII. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •7.1. Понятие о произведении растворимости
- •7.2. Насыщенные, ненасыщенные, пересыщенные растворы с точки зрения теории произведения растворимости
- •7.3. Практическое применение ПР. Растворимость веществ
- •7.4. Условия растворения осадков
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VII ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •Ответы к тесту на стр. 238
- •8.1. Поверхностное натяжение: физический смысл, факторы, от которых зависит σ
- •8.2. Адсорбция на поверхности жидкости. Правило Дюкло-Траубе
- •8.3. Адсорбция на твердых сорбентах
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
- •Ответы к тесту на стр. 253
- •9.1. Классификация дисперсных систем
- •9.2. Методы получения лиофобных коллоидов
- •9.3. Строение коллоидной мицеллы
- •9.4. Двойной электрический слой и электрокинетические явления
- •9.5. Коагуляция лиофобных коллоидов
- •9.6. Стабилизация золей. Коллоидная защита. Очистка золей. Гели
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ IX. ДИСПЕРСНЫЕ СИСТЕМЫ
- •Ответы к тесту на стр. 261
- •Тема Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •10.1. Понятие о комплексных соединениях. Строение комплексных соединений
- •10.2. Классификация и номенклатура комплексных соединений
- •10.3. Поведение комплексных соединений в растворе
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •Ответы к тесту на стр.268
- •ТЕМА XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •11.1. Степень окисления
- •11.3. Типы окислительно-восстановительных реакций
- •11.4. Методы составления ОВР
- •11.5. Расчет молярной массы эквивалента окислителя и восстановителя
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •Ответы к тесту на стр. 274
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ V. БУФЕРНЫЕ СИСТЕМЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VII ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ IX. ДИСПЕРСНЫЕ СИСТЕМЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •ТЕСТОВЫЕ ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ СТУДЕНТОВ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ СТУДЕНТОВ
- •ПРИЛОЖЕНИЯ
- •РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
18.ВЕЛИЧИНА ПР ГИДРОКСИДА ХРОМА (III), ВЫРАЖЕННАЯ ЧЕРЕЗ РАСТВОРИМОСТЬ S (МОЛЬ/Л) ЭТОГО ГИДРОКСИДА
1) |
ПР |
4 |
; |
27S |
2)
ПР
2 |
; |
S |
3)
3 |
; |
ПР 4S |
4)
ПР 108S5.
19. РАСТВОРЕНИЕ |
ОСАДКА ФОСФАТА |
||
|
ВОЗМОЖНО В КИСЛОТЕ |
|
|
1) |
СН3СООН; 2) |
CН3СН2СООН; |
3) HNO3; |
КАЛЬЦИЯ
4) НСООН
20. РАСТВОРЕНИЕ PbJ2 ПРОИЗОЙДЕТ ПРИ ДОБАВЛЕНИИ
1) NaCl 2) Na2CO3; 3) NaJ |
4) Pb(NO3 )2. |
21.РАСТВОРЕНИЕ ОСАДКА ДОБАВЛЕНИИ
CaSO4
НЕ ПРОИЗОЙДЕТ ПРИ
1) K2CO3; 2) Ca(NO3)2;
3) |
Na |
2 |
C O |
; |
|
2 |
4 |
|
|
4) KF.
22. ОСАДОК ГИДРОКСИДА НИКЕЛЯ |
Ni(OH)2 |
|
РИТСЯ ПРИ ДОБАВЛЕНИИ РАСТВОРА |
||
1) NaOH |
2) Ni(NO3)2 |
; |
3) HCl |
4) Na2CO3. |
|
РАСТВО-
23.БУДЕТ ЛИ ОСАДОК ИОДИДА СЕРЕБРА РАСТВОРЯТЬСЯ
ВУКСУСНОЙ КИСЛОТЕ
1) Нет, Кр>1 |
2) |
Нет, Кр <1 |
3) Да, Кр<1 |
4) |
Да, Кр>1 |
Ответы к тесту на стр. 238
Тестовые задания для самоконтроля по теме VII на стр. 303 Ответы к тестовым заданиям для самоконтроля по теме VII на стр. 313
117
ТЕМА VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
8.1. Поверхностное натяжение: физический смысл, факторы, от которых зависит σ
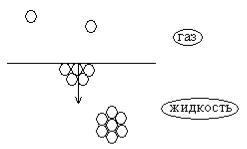
Рассмотрим границу раздела жидкость
– газ. Молекулы, находящиеся на поверхности жидкости, испытывают неодинаковое воздействие со стороны молекул жидкости и газа. Молекулы, находящиеся внутри жидкости,
окружены со всех сторон подобными. Силы, действующие на них со всех сторон, одинаковы, и равнодействующая этих сил равна нулю.
Силы межмолекулярного взаимодействия молекул жидкости, расположенных на поверхности, не скомпенсированы, их равнодействующая не равна нулю и направлена вглубь жидкости. Таким образом, энергия молекул на поверхности раздела фаз выше, чем у молекул внутри фазы. В результате возникает поверхностный слой с избыточной свободной поверхностной энергией F.
Свободная поверхностная энергия зависит от числа частиц на границе раздела и поэтому прямопропорциональна площади поверхности раздела фаз и удельной свободной поверхностной энергии (σ): F = σ·S,
S – площадь поверхности раздела фаз, м2, см2;
σ– удельная свободная поверхностная энергия
(поверхностное натяжение) – это избыточная энергия молекул единицы площади поверхности, Эрг/см2, Дж/м2.
Удельная свободная поверхностная энергия или поверхностное натяжение σ зависит от:
природы вещества;температуры;
природы граничащих фаз;
118
наличия примесей.
Поверхностное натяжение существенно зависит:
1) от природы вещества и, в первую очередь, от полярности молекул – чем выше степень полярности молекул, тем активнее они взаимодействуют друг с другом, тем выше поверхностное натяжение.
|
|
|
2 |
; |
|
|
22, 75 Эрг/см |
2 |
; |
Н |
О |
72, 75 Эрг / см |
этанола |
|
|||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
2 |
. |
|
|
|
|
|
С Н |
18, 01 Эрг / см |
|
|
|
|
|
|||
|
6 |
14 |
|
|
|
|
|
|
|
2) от температуры : |
с |
повышением температуры σ |
|||||||
снижается, т.к. при увеличении температуры жидкость переходит в пар, а при температуре кипения исчезает различие между паром и жидкостью, выравнивается энергия межмолекулярного взаимодействия, σ становится равным нулю.
3) от природы молекул пограничных фаз: σж-г ≠ σж-ж. 4) от наличия примесей.
Все вещества в зависимости от их влияния на поверхностное натяжение жидкости принято делить на три группы:
ПАВ – поверхностно-активные вещества – вещества, понижающие поверхностное натяжение на границе раздела фаз; ПИАВ – поверхностно-инактивные вещества – вещества,
повышающие поверхностное натяжение; ПНВ – поверхностно-неактивные вещества, не
изменяющие поверхностное натяжение (глицерин, сахароза). Т.о. избыточную поверхностную энергию и σ можно
снизить двумя путями:
1)уменьшить площадь поверхности раздела фаз за счет: а) слияния более мелких частиц в более крупные; б) жидкость при отсутствии внешних сил всегда стремится принять форму шара, т.к. поверхность шара это наименьшая поверхность, ограничивающая объем;
2)уменьшить величину σ за счет дополнительного поглощения молекул постороннего вещества – адсорбции.
Факторы, от которых не зависит поверхностное натя-
жение:
площадь поверхности раздела. Т.к. σ – удельная свободная поверхностная энергия, т.е. свободная поверхностная
119

энергия единицы площади поверхности, она относится к единице площади и от самой площади не зависит;
массы жидкости;
объема жидкости;
количества вещества жидкости.
8.2. Адсорбция на поверхности жидкости. Правило Дюкло-Траубе
Адсорбция – явление самопроизвольного накопления одного вещества на поверхности другого. Вещество, которое адсорбируется называется адсорбтивом; вещество, на поверхности которого происходит адсорбция – адсорбентом.
Адсорбция на поверхности жидкостей На поверхности жидкостей могут адсорбироваться
частицы веществ, растворенных в жидкостях. Адсорбция сопровождает процесс растворения, влияя на распределение частичек растворенного вещества между поверхностными слоями растворителя и его внутренним объемом.
Адсорбцию на поверхности жидкости можно рассчитать по уравнению Гиббса:
Г |
dσ |
|
C |
, |
|
|
|
|||
|
|
|
|
|
|
|||||
|
|
|
dC |
RT |
|
|
|
|
||
Г |
- величина удельной адсорбции, моль/м2; |
|
||||||||
С |
- молярная концентрация, моль/м3; |
|
|
|||||||
dσ - |
|
|
изменение |
поверхностного |
натяжения, |
|||||
соответствующее изменению концентрации |
С; |
|
||||||||
|
dσ |
|
|
- поверхностная активность. |
|
|
||||
dC |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
Если |
|
с |
|
увеличением |
концентрации |
вещества |
||||
поверхностное |
|
натяжение уменьшается |
σ < |
0, то его |
||||||
адсорбция Г считается положительной (Г > 0). Это означает, что концентрация вещества в поверхностном слое больше, чем в объеме раствора.
Если с увеличением концентрации вещества поверхностное натяжение на границе раздела фаз увеличивается σ > 0, то адсорбция считается отрицательной Г < 0, это
120

означает, что концентрация вещества в объеме раствора больше, чем в поверхностном слое.
Адсорбция ПАВ ПАВ – дифильные по природе вещества, имеют
полярную (гидрофильную) и неполярную (гидрофобную) части. Например, мыло: С17Н35COONa
символ неполярной |
символ полярной |
части |
части |
ПАВ – это положительно адсорбирующиеся вещества, к ним относятся: жиры, жирные кислоты, кетоны, спирты, холестерин, мыла и другие органические соединения. При растворении таких веществ в воде происходит положительная адсорбция, сопровождающаяся накоплением вещества в поверхностном слое. Процесс выхода молекул этих веществ на поверхность очень выгоден, т.к. приводит к понижению поверхностного натяжения на границе раздела фаз. Схема адсорбции ПАВ:
Способность вещества понижать поверхностное натяжение на границе раздела фаз называется поверхностной
активностью
dσ dC
.
Правило Дюкло-Траубе
Величина поверхностной активности ПАВ – членов одного гомологического ряда органических соединений зависит от длины углеводородного радикала: удлинение ПАВ на одну группу –СН2– увеличивает поверхностную активность вещества в 3-3,5 раза.
121

Рассмотрим правило Дюкло-Траубе на примере четырех представителей гомологического ряда спиртов.
Изотерма поверхностного натяжения:
Адсорбция ПИАВ По отношению к полярной воде такими веществами
являются электролиты: неорганические кислоты, соли, щелочи. Растворение этих веществ увеличивает поверхностное натяжение, поэтому ПИАВ будут выталкиваться из поверхностного слоя внутрь адсорбента. Такую адсорбцию называют отрицательной. Например: растворение КС1 в воде сопровождается диссоциацией соли с последующей гидратацией образующихся ионов.
Схема адсорбции ПИАВ:
Выход ионов электролита в поверхностный слой приводит к повышению поверхностного натяжения на границе жидкость – воздух. Поэтому вещества, повышающие поверхностное натяжение не содержатся в поверхностном слое.
122
