
- •ТЕМА I. ВИДЫ КОНЦЕНТРАЦИЙ. ЗАКОН ЭКВИВАЛЕНТОВ
- •1.2. Растворы. Способы выражения концентрации растворов
- •1.3. Закон эквивалентов
- •Ответы к тесту на стр. 193
- •ТЕМА II. ТЕРМОДИНАМИКА
- •2.1. Основные понятия и определения
- •2.2. Первое начало термодинамики
- •2.3. Закон Гесса. следствия из него
- •2.4. Второе начало термодинамики. Энтропия
- •2.5. Энергия Гиббса и направление химических реакций
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ II. ТЕРМОДИНАМИКА
- •Ответы к тесту на стр. 200
- •ТЕМА III. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •3.1. Химическая кинетика. Скорость химической реакции и факторы, на нее влияющие
- •3.2. Химическое равновесие
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ III. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •Ответы к тесту на стр. 207
- •ТЕМА IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •4.1. Понятие об электролитах и неэлектролитах. Электролитическая диссоциация. Степень диссоциации, константа ионизации. Закон разбавления Оствальда
- •4.2. Ионизация воды. Ионное произведение воды. Водородный и гидроксильный показатели (рН и рОН)
- •4.3. Сильные электролиты. Активность ионов
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •Ответы к тесту на стр. 210
- •ТЕМА V. БУФЕРНЫЕ СИСТЕМЫ
- •5.1. Основные понятия и определения
- •5.2. Расчет рН буферных систем I типа
- •5.3. Расчет рН и рОН буферных систем II типа
- •5.4. Механизм буферного действия
- •5.5. Расчет буферной емкости
- •5.6. Оценка буферной емкости и буферное отношение. Факторы, определяющие емкость буфера
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ V. БУФЕРНЫЕ СИСТЕМЫ
- •Ответы к тесту на стр. 224
- •ТЕМА VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •6.1. Осмотические свойства растворов
- •6.2. Закон Рауля и следствия из него
- •Криоскопия. Эбулиоскопия
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •Ответы к тесту на стр. 232
- •ТЕМА VII. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •7.1. Понятие о произведении растворимости
- •7.2. Насыщенные, ненасыщенные, пересыщенные растворы с точки зрения теории произведения растворимости
- •7.3. Практическое применение ПР. Растворимость веществ
- •7.4. Условия растворения осадков
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VII ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •Ответы к тесту на стр. 238
- •8.1. Поверхностное натяжение: физический смысл, факторы, от которых зависит σ
- •8.2. Адсорбция на поверхности жидкости. Правило Дюкло-Траубе
- •8.3. Адсорбция на твердых сорбентах
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
- •Ответы к тесту на стр. 253
- •9.1. Классификация дисперсных систем
- •9.2. Методы получения лиофобных коллоидов
- •9.3. Строение коллоидной мицеллы
- •9.4. Двойной электрический слой и электрокинетические явления
- •9.5. Коагуляция лиофобных коллоидов
- •9.6. Стабилизация золей. Коллоидная защита. Очистка золей. Гели
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ IX. ДИСПЕРСНЫЕ СИСТЕМЫ
- •Ответы к тесту на стр. 261
- •Тема Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •10.1. Понятие о комплексных соединениях. Строение комплексных соединений
- •10.2. Классификация и номенклатура комплексных соединений
- •10.3. Поведение комплексных соединений в растворе
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •Ответы к тесту на стр.268
- •ТЕМА XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •11.1. Степень окисления
- •11.3. Типы окислительно-восстановительных реакций
- •11.4. Методы составления ОВР
- •11.5. Расчет молярной массы эквивалента окислителя и восстановителя
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •Ответы к тесту на стр. 274
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ V. БУФЕРНЫЕ СИСТЕМЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VII ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ IX. ДИСПЕРСНЫЕ СИСТЕМЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •ТЕСТОВЫЕ ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ СТУДЕНТОВ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ СТУДЕНТОВ
- •ПРИЛОЖЕНИЯ
- •РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
Выберите один правильный ответ
1. НАИБОЛЬШЕЕ ЗНАЧЕНИЕ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ σ НА ГРАНИЦЕ С ВОЗДУХОМ ИМЕЕТ ЖИДКОСТЬ
1) |
С2Н5ОН |
2) |
Н2О |
3) раствор КСl |
|
4) |
С3Н7ОН |
2. ПОВЕРХНОСТНОЕ |
НАТЯЖЕНИЕ ЖИДКОСТИ НЕ |
||
ЗАВИСИТ ОТ |
|
|
|
1) |
наличия примеси |
2) |
объема жидкости |
3) |
температуры |
4) |
природы жидкости |
3. ПАВ ПО ОТНОШЕНИЮ К ВОДЕ ЯВЛЯЕТСЯ
1) |
Na |
3 |
PO |
4 |
|
2) |
K |
2 |
CO |
3 |
3) |
C17H35COONa |
4) |
NH |
4
NO3
4. В СОСТАВЕ МОЧИ ПАВ ЯВЛЯЕТСЯ
1) соли желчных кислот |
2) NH4Cl |
3) Na3PO4 |
4) (NH4 )2 HPO4 |
5. ПРИ ДОБАВЛЕНИИ ПИАВ К ВОДЕ:
1) |
σр ра |
σH |
O |
2) |
σр ра |
σH |
O |
|
|
|
|
|
|
|
|
6. ФИЗИЧЕСКИЙ |
|
|
СМЫСЛ |
|
|||
НАТЯЖЕНИЯ
3) |
р ра |
H |
O |
|
|
2 |
|
ПОВЕРХНОСТНОГО
1)энергия, приходящаяся на единицу поверхности жидкой фазы
2)сила, приходящаяся на единицу поверхности жидкой фазы
3)энергия одного моля жидкости
130
4)число моль адсорбтива в 1 литре жидкой фазы
7.АКТИВНОСТЬ ПАВ ПРИ УВЕЛИЧЕНИИ УГЛЕВОДОРОДНОГО РАДИКАЛА НА ГРУППУ ( СН2 )
1)увеличивается примерно в 3 раза
2)не изменяется
3)уменьшается примерно в 3 раза
4)уменьшается примерно в 6 раз
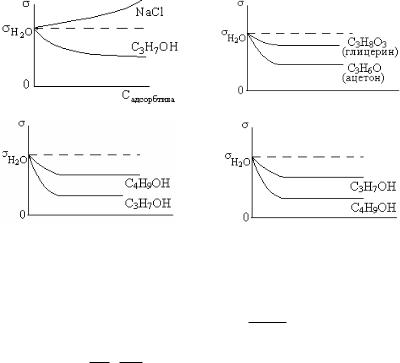
8.ПРАВИЛО ДЮКЛО-ТРАУБЕ ИЛЛЮСТРИРУЕТ ИЗОТЕРМА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ
1) |
2) |
3) |
4) |
9.УРАВНЕНИЕ ДЛЯ РАСЧЕТА ВЕЛИЧИНЫ АДСОРБЦИИ НА ПОВЕРХНОСТИ ЖИДКОЙ ФАЗЫ
1) mg = σ·2πr;
3) Г d C ; dC RT
2) |
Г |
4) Г
Г |
|
|
С |
||
|
С В |
||||
|
|
||||
|
|
|
|||
Г |
Р |
||||
|
. |
||||
Р В |
|||||
;
131
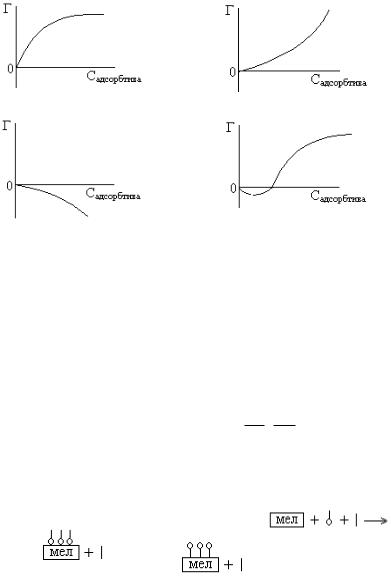
10.АДСОРБЦИИ ПАВ НА ПОВЕРХНОСТИ ЖИДКОЙ ФАЗЫ СООТВЕТСТВУЕТ ИЗОТЕРМА АДСОРБЦИИ
1) |
2) |
3) |
4) |
11.ПОВЫШЕННОМУ СОДЕРЖАНИЮ В МОЧЕ СОЛЕЙ ЖЕЛЧНОЙ КИСЛОТЫ (σ МОЧИ В НОРМЕ 57-68
Эрг / см |
2 |
) СООТВЕТСТВУЕТ ЗНАЧЕНИЕ σ |
|
|
|||
1) 78 |
|
2) 71 |
3) 63 |
(Эрг / см |
2 |
) |
|
||
4) 53 |
|
|
12.ВЕЛИЧИНА АДСОРБЦИИ НА ПОВЕРХНОСТИ ТВЕРДОГО СОРБЕНТА
1) рассчитывается по формуле Г Г |
Р |
|
|
||
Р В |
||
|
2)рассчитывается по формуле Г dCd RTC
3)определяется по изменению поверхностного натяжения
4)берется в справочных таблицах
13.ПРАВАЯ ЧАСТЬ СХЕМЫ АДСОРБЦИИ:
1) |
2) |
132

3) |
4) |
14. ПРАВАЯ ЧАСТЬ СХЕМЫ АДСОРБЦИИ
1) |
2) |
3)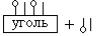 4)
4)
15. ПРАВАЯ ЧАСТЬ СХЕМЫ АДСОРБЦИИ 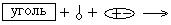
1) |
2) |
3) |
4) |
16. ПРАВАЯ ЧАСТЬ СХЕМЫ АДСОРБЦИИ
1) |
2) |
3) |
4) |
17. ПРАВАЯ ЧАСТЬ СХЕМЫ АДСОРБЦИИ 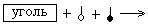
1) |
2) |
3) |
4) |
18.ПАРА «РАСТВОРИТЕЛЬ + АДСОРБЕНТ», НЕОБХОДИ-
МЫЕ ДЛЯ ПОЛНОГО РАЗДЕЛЕНИЯ СМЕСИ ТВЕРДЫХ ДИФИЛЬНОГО ( 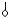 ) И НЕПОЛЯРНОГО (|) ВЕЩЕСТВ (РАСТВОРИТЕЛЬ РАСТВОРЯЕТ ОБА ВЕЩЕСТВА, А НА ТВЕРДОМ АДСОРБЕНТЕ ПОЛНОСТЬЮ АДСОРБИРУЕТСЯ ТОЛЬКО ОДНО ИЗ НИХ)
) И НЕПОЛЯРНОГО (|) ВЕЩЕСТВ (РАСТВОРИТЕЛЬ РАСТВОРЯЕТ ОБА ВЕЩЕСТВА, А НА ТВЕРДОМ АДСОРБЕНТЕ ПОЛНОСТЬЮ АДСОРБИРУЕТСЯ ТОЛЬКО ОДНО ИЗ НИХ)
133
