
- •ТЕМА I. ВИДЫ КОНЦЕНТРАЦИЙ. ЗАКОН ЭКВИВАЛЕНТОВ
- •1.2. Растворы. Способы выражения концентрации растворов
- •1.3. Закон эквивалентов
- •Ответы к тесту на стр. 193
- •ТЕМА II. ТЕРМОДИНАМИКА
- •2.1. Основные понятия и определения
- •2.2. Первое начало термодинамики
- •2.3. Закон Гесса. следствия из него
- •2.4. Второе начало термодинамики. Энтропия
- •2.5. Энергия Гиббса и направление химических реакций
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ II. ТЕРМОДИНАМИКА
- •Ответы к тесту на стр. 200
- •ТЕМА III. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •3.1. Химическая кинетика. Скорость химической реакции и факторы, на нее влияющие
- •3.2. Химическое равновесие
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ III. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •Ответы к тесту на стр. 207
- •ТЕМА IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •4.1. Понятие об электролитах и неэлектролитах. Электролитическая диссоциация. Степень диссоциации, константа ионизации. Закон разбавления Оствальда
- •4.2. Ионизация воды. Ионное произведение воды. Водородный и гидроксильный показатели (рН и рОН)
- •4.3. Сильные электролиты. Активность ионов
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •Ответы к тесту на стр. 210
- •ТЕМА V. БУФЕРНЫЕ СИСТЕМЫ
- •5.1. Основные понятия и определения
- •5.2. Расчет рН буферных систем I типа
- •5.3. Расчет рН и рОН буферных систем II типа
- •5.4. Механизм буферного действия
- •5.5. Расчет буферной емкости
- •5.6. Оценка буферной емкости и буферное отношение. Факторы, определяющие емкость буфера
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ V. БУФЕРНЫЕ СИСТЕМЫ
- •Ответы к тесту на стр. 224
- •ТЕМА VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •6.1. Осмотические свойства растворов
- •6.2. Закон Рауля и следствия из него
- •Криоскопия. Эбулиоскопия
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •Ответы к тесту на стр. 232
- •ТЕМА VII. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •7.1. Понятие о произведении растворимости
- •7.2. Насыщенные, ненасыщенные, пересыщенные растворы с точки зрения теории произведения растворимости
- •7.3. Практическое применение ПР. Растворимость веществ
- •7.4. Условия растворения осадков
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VII ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •Ответы к тесту на стр. 238
- •8.1. Поверхностное натяжение: физический смысл, факторы, от которых зависит σ
- •8.2. Адсорбция на поверхности жидкости. Правило Дюкло-Траубе
- •8.3. Адсорбция на твердых сорбентах
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
- •Ответы к тесту на стр. 253
- •9.1. Классификация дисперсных систем
- •9.2. Методы получения лиофобных коллоидов
- •9.3. Строение коллоидной мицеллы
- •9.4. Двойной электрический слой и электрокинетические явления
- •9.5. Коагуляция лиофобных коллоидов
- •9.6. Стабилизация золей. Коллоидная защита. Очистка золей. Гели
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ IX. ДИСПЕРСНЫЕ СИСТЕМЫ
- •Ответы к тесту на стр. 261
- •Тема Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •10.1. Понятие о комплексных соединениях. Строение комплексных соединений
- •10.2. Классификация и номенклатура комплексных соединений
- •10.3. Поведение комплексных соединений в растворе
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •Ответы к тесту на стр.268
- •ТЕМА XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •11.1. Степень окисления
- •11.3. Типы окислительно-восстановительных реакций
- •11.4. Методы составления ОВР
- •11.5. Расчет молярной массы эквивалента окислителя и восстановителя
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •Ответы к тесту на стр. 274
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ V. БУФЕРНЫЕ СИСТЕМЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VII ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ IX. ДИСПЕРСНЫЕ СИСТЕМЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •ТЕСТОВЫЕ ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ СТУДЕНТОВ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ СТУДЕНТОВ
- •ПРИЛОЖЕНИЯ
- •РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
3. Запишем общую константу совмещенного равновесия для реакции исходя из определения. Учтем, что уксусная кислота в уравнение входит с коэффициентом 2. Значит, ее константу нужно возвести в квадрат
Кравн= ПР(CaC2O4)∙К2(CH3COOH ) / K1(H2C2O4) ∙ K2(H2C2O4) =
2,3·10–9∙(1,74 ∙ 10-5)2 / 5,4 ∙10-2 ∙ 5,4 ∙10-5=2,4 ∙ 10-13
Kравн < 1 и Kравн < 1·10–5 оксалат кальция в уксусной кислоте не растворяется, равновесие невозможно протекает только обратная реакция.
В примерах 1 и 2 совмещаются протолитические и гетерогенные равновесия; объектом конкуренции является
оксалат-ион C2O42–; конкурирующие частицы ионы кальция Ca2+ и H+
ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VII ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
Выберите один правильный ответ
1. ГЕТЕРОГЕННОЕ РАВНОВЕСИЕ ТРУДНО РАСТВОРИМОЙ СОЛИ Ва3(РО4)2 ХАРАКТЕРИЗУЕТ УРАВНЕНИЕ
1)
2)
3)
Ва |
3 |
(РО |
|
|
) |
|
|
|
3Ва |
|
2 |
2РО |
3 |
; |
|
|
|||||
|
|
2 |
|
|
4 |
|
|
|
|||||||||||||
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Ва |
|
(РО |
|
|
) |
|
Ва |
2 |
РО |
3 |
; |
|
|
||||||||
3 |
4 |
2 |
|
4 |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Ва |
|
(РО |
|
|
) |
|
|
|
3Ва |
2 |
2РО |
3 |
; |
||||||||
3 |
4 |
2(к) |
|
4 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
насыщ.р - р |
|
|
|||||||
4) |
Ва |
|
(РО |
|
) |
|
3Ва |
2 |
2РО |
3 |
. |
3 |
4 |
2 |
|
4 |
|||||
|
|
|
|
|
|
2. ТЕОРИЯ ПР НЕ ПРИМЕНИМА ДЛЯ СОЕДИНЕНИЯ
1) AgJ 2) AgF 3) AgCl 4) AgBr
3.ПР А1(ОН)3 РАССЧИТЫВАЕТСЯ ПО УРАВНЕНИЮ:
1)ПР = [Al3+] [OH-]3
2)ПР = [Al3+] 3[OH-]
3)ПР = [Al]3+ + 3[OH]-
4)ПР = [Al3+] + [OH-]3
4.ТЕОРИЯ ПР СПРАВЕДЛИВА ДЛЯ
1) Ва(ОН)2 |
2) Ba(NO3)2 3) BaCl2 |
4) BaSO4 |
114
5. ПР СОЛИ Hg3(PO4)2 МОЖНО РАССЧИТАТЬ ПО ВЫРАЖЕНИЮ
1) |
ПР |
[Hg |
2 3 |
3 2 |
; |
|
] |
[PO |
] |
||
|
|
4 |
|
|
2) |
ПР |
[3Hg |
2 |
3 |
]; |
|
|
] [2PO |
4 |
||
|
|
|
|
|
3) |
ПР |
4) |
ПР |
3[Hg |
2 |
|
|
|
3 |
]; |
||
|
] 2[PO |
|
||||||
|
|
|
|
|
|
4 |
|
|
[Hg |
2 3 |
3 |
2 |
|||||
|
] |
|
[PO |
4 |
] . |
|||
|
|
|
|
|
|
|
|
|
6. ОБРАЗОВАНИЕ ОСАДКА |
СaSO4 ВОЗМОЖНО ПРИ |
||
ЗНАЧЕНИИ ПК |
|
|
|
1) 6 10-7 |
2) 5 10-3 |
3) 5,5 10-8 |
4) 3,2 10-6 |
7. РАСТВОР, В КОТОРОМ ПК < ПР ЯВЛЯЕТСЯ: 1) насыщенным 2) ненасыщенным 3) пересыщенным
4) концентрированным
8. РАСТВОР ИОДИДА СВИНЦА ЯВЛЯЕТСЯ ПРИ
С |
|
|
|
1,5 10 |
3 |
; |
C |
|
|
310 |
3 |
моль ион/ л. |
ПР |
|
|
8 |
Pb |
2 |
|
|
J |
|
|
PbJ |
2 |
1,4 10 . |
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1) насыщенным
2) ненасыщенным
3) пересыщенным
4) концентрированным
9. ПК РАСТВОРА ФОСФАТА СВИНЦА ИМЕЕТ ЗНАЧЕНИЕ, ЕСЛИ
С |
|
2 |
10 |
7 |
моль ион / л; |
С |
3 |
10 |
9 |
моль |
ион / л? |
|
Pb |
|
|
||||||||||
|
|
|
|
|
|
РО |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1) 10-16 2) 10-30 |
|
3) |
|
10-25 |
|
4) |
10-39 |
||
10. СМЕШАНЫ РАВНЫЕ ОБЪЕМЫ
РАСТВОРА И 0,02 МОЛЬ/Л ЗНАЧЕНИЕ ПК РАВНО
СаС12 0,001 МОЛЬ/Л
Na2SO4 РАСТВОРА.
1) 5 10 6 |
2) 2 10 4 |
3) 2 10 5 |
4) 1 10 5 |
115
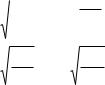
11. ПК ТРУДНОРАСТВОРИМОЙ СОЛИ AgCl ПРИ СМЕШЕ-
НИИ 10 МЛ 0,01 МОЛЬ/Л РАСТВОРА AgNO3 |
И 5 МЛ 0,1 |
МОЛЬ/Л РАСТВОРА КСl РАВНО |
|
1) 1 10 3
2) |
2,5 |
10 |
4 |
|
3) |
2,2 |
10 4
4) |
1,5 |
10 3
12. КОНЦЕНТРАЦИЯ ИОНОВ
Ag |
|
|
(МОЛЬ-ИОН/Л) В НАСЫ-
ЩЕННОМ
РАВНА
ВОДНОМ РАСТВОРЕ СОЛИ
ПР |
|
|
|
12 |
Ag |
CrO |
4 |
1,9 10 |
|
|
2 |
|
|
Ag CrO |
|
2 |
4 |
1) |
1,4 |
10 |
6 |
|
2) |
7,4 |
10 5
3) |
1,9 |
10 6
4) |
1,5 |
10 4
13. КОНЦЕНТРАЦИЯ ИОНОВ
Fe |
2 |
|
В НАСЫЩЕННОМ
РАСТВОРЕ НИЕ ПР
1) 1,2 10 9
FeS РАВНА |
6 10 |
10 |
моль ион/ л . |
ЗНАЧЕ- |
|||
|
|||||||
|
5 |
3) |
6 10 |
20 |
4) |
19 |
|
2) 2,4 10 |
|
3,6 10 |
|||||
14. КОНЦЕНТРАЦИЯ ИОНОВ Са2+ ВЫШЕ НАД ОСАДКОМ
1) CaF2 2) CaC2O4 3) CaCO3 4) CaSO4
15.РАСТВОРИМОСТЬ CdS МОЖНО РАССЧИТАТЬ ПО ВЫРАЖЕНИЮ
1) |
3 |
|
ПР |
|
2) |
|
|||||
|
4 |
|
|
||

 ПР
ПР
3) |
4 |
ПР |
4) |
5 |
ПР |
|
|
||||
|
27 |
|
108 |
||
|
|
|
|
16. МЕНЕЕ РАСТВОРИМО СОЕДИНЕНИЕ
1) |
BaCO3; |
2) |
CoCO3; |
3) |
MgCO3; |
4) PbCO
3
.
17. РАСТВОРИМОСТЬ |
Ag2S |
В |
ВОДЕ |
СОСТАВЛЯЕТ |
|
1,08 10 7 моль / л. ЗНАЧЕНИЕ ПР СУЛЬФИДА СЕРЕБРА |
|||||
РАВНО |
|
|
|
|
|
1) 1,16 10 34 ; |
2) 1,25 10 17 ; |
3) |
5 10 21; |
4) 3,3 10 9. |
|
116
