
- •ТЕМА I. ВИДЫ КОНЦЕНТРАЦИЙ. ЗАКОН ЭКВИВАЛЕНТОВ
- •1.2. Растворы. Способы выражения концентрации растворов
- •1.3. Закон эквивалентов
- •Ответы к тесту на стр. 193
- •ТЕМА II. ТЕРМОДИНАМИКА
- •2.1. Основные понятия и определения
- •2.2. Первое начало термодинамики
- •2.3. Закон Гесса. следствия из него
- •2.4. Второе начало термодинамики. Энтропия
- •2.5. Энергия Гиббса и направление химических реакций
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ II. ТЕРМОДИНАМИКА
- •Ответы к тесту на стр. 200
- •ТЕМА III. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •3.1. Химическая кинетика. Скорость химической реакции и факторы, на нее влияющие
- •3.2. Химическое равновесие
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ III. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •Ответы к тесту на стр. 207
- •ТЕМА IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •4.1. Понятие об электролитах и неэлектролитах. Электролитическая диссоциация. Степень диссоциации, константа ионизации. Закон разбавления Оствальда
- •4.2. Ионизация воды. Ионное произведение воды. Водородный и гидроксильный показатели (рН и рОН)
- •4.3. Сильные электролиты. Активность ионов
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •Ответы к тесту на стр. 210
- •ТЕМА V. БУФЕРНЫЕ СИСТЕМЫ
- •5.1. Основные понятия и определения
- •5.2. Расчет рН буферных систем I типа
- •5.3. Расчет рН и рОН буферных систем II типа
- •5.4. Механизм буферного действия
- •5.5. Расчет буферной емкости
- •5.6. Оценка буферной емкости и буферное отношение. Факторы, определяющие емкость буфера
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ V. БУФЕРНЫЕ СИСТЕМЫ
- •Ответы к тесту на стр. 224
- •ТЕМА VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •6.1. Осмотические свойства растворов
- •6.2. Закон Рауля и следствия из него
- •Криоскопия. Эбулиоскопия
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •Ответы к тесту на стр. 232
- •ТЕМА VII. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •7.1. Понятие о произведении растворимости
- •7.2. Насыщенные, ненасыщенные, пересыщенные растворы с точки зрения теории произведения растворимости
- •7.3. Практическое применение ПР. Растворимость веществ
- •7.4. Условия растворения осадков
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VII ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •Ответы к тесту на стр. 238
- •8.1. Поверхностное натяжение: физический смысл, факторы, от которых зависит σ
- •8.2. Адсорбция на поверхности жидкости. Правило Дюкло-Траубе
- •8.3. Адсорбция на твердых сорбентах
- •ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
- •Ответы к тесту на стр. 253
- •9.1. Классификация дисперсных систем
- •9.2. Методы получения лиофобных коллоидов
- •9.3. Строение коллоидной мицеллы
- •9.4. Двойной электрический слой и электрокинетические явления
- •9.5. Коагуляция лиофобных коллоидов
- •9.6. Стабилизация золей. Коллоидная защита. Очистка золей. Гели
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ IX. ДИСПЕРСНЫЕ СИСТЕМЫ
- •Ответы к тесту на стр. 261
- •Тема Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •10.1. Понятие о комплексных соединениях. Строение комплексных соединений
- •10.2. Классификация и номенклатура комплексных соединений
- •10.3. Поведение комплексных соединений в растворе
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •Ответы к тесту на стр.268
- •ТЕМА XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •11.1. Степень окисления
- •11.3. Типы окислительно-восстановительных реакций
- •11.4. Методы составления ОВР
- •11.5. Расчет молярной массы эквивалента окислителя и восстановителя
- •ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ К ТЕМЕ XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •Ответы к тесту на стр. 274
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ IV. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ. ПОВЕДЕНИЕ СЛАБЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ V. БУФЕРНЫЕ СИСТЕМЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VI. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VII ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ IX. ДИСПЕРСНЫЕ СИСТЕМЫ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- •ТЕСТОВЫЕ ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ СТУДЕНТОВ
- •ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ ЗНАНИЙ СТУДЕНТОВ
- •ПРИЛОЖЕНИЯ
- •РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА

|
|
|
С С |
|
2 |
С |
|
|
|
|
2 |
С |
||
К |
|
|
|
|
; |
К |
|
|
|
|||||
ион. |
С(1 |
) |
1 |
ион. |
1- |
|||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||||
или, если учесть, что → 0, то Кион. = 2С, откуда
,
2 = Кион./С;
|
К |
|
|
|
ион. |
. |
|
С |
|||
|
|
Полученное выражение называют законом разведения Оствальда. Он связывает константу ионизации и степень диссоциации. Физический смысл закона: с разбавлением раствора (уменьшением его концентрации) степень диссоциации увеличивается. Чем сильнее разбавляют слабый электролит, тем больше его степень диссоциации ( ).
4.2. Ионизация воды. Ионное произведение воды. Водородный и гидроксильный показатели (рН и рОН)
Вода – очень слабый электролит. Запишем уравнение ионизации воды: Н2О + Н2О ↔ Н3О+ + ОН-
Или упрощенно: Н2О ↔ Н+ + ОН-
[H ][OH ]
Кион. [H2O]
.
Известно, что при температуре 22-25оС в 1 л на ионы распадается 10-7 моль молекул Н2О. Следовательно, [H+] = [OH-] = 10-7 моль/л. Концентрацию молекул воды можно считать величиной постоянной, равной: [H2O] = 1000/18 = 55,56моль/л. Следовательно, константа ионизации воды при 2225оС будет равна Ки= 1,82·10-16.
Произведение равновесных концентраций ионов Н+ и
ОН- называется ионным произведением воды:
КW = [H+][OH-]
КW = 10-7∙10-7 = 10-14 . КW = 10-14 при Т = 22-25оС.
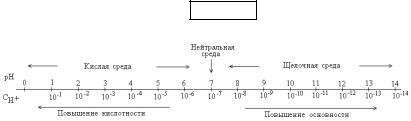
Характер среды в водном растворе любого вещества определяется тем ионом Н+ или ОН-, концентрация которого преобладает.
[H+] = [OH-], т.е. [H+] = 10-7 |
моль/л |
- |
среда |
нейтральная; |
|
|
|
[H+] > [OH-], т.е. [H+] > 10-7 |
моль/л |
- среда кислая; |
|
60

[H+] < [OH-], т.е [H+] < 10-7 моль/л - среда щелочная. Важно отметить, что в любом водном растворе –
нейтральном, кислотном, щелочном имеются водородные и гидроксильные ионы. При этом произведение концентрации этих ионов величина постоянная, равная ионному произведению воды.
Зная ионное произведение воды и концентрацию одного из ионов, можно вычислить концентрацию другого:
[H ] |
K |
w |
; |
|
|
||||
|
[OH |
|
] |
|
|
|
|||
- |
] |
K |
w |
|
[OH |
[H |
|
] |
|
|
|
|||
|
|
|
.
Водородный показатель
На практике принято оценивать ионное равновесие в водных растворах значением водородного показателя рН.
Водородным показателем рН называют отрицательный десятичный логарифм концентрации ионов водорода в водном
растворе. |
рН = -lgСН+. |
|
|
|
Гидроксильным |
показателем |
рОН |
называют |
|
отрицательный десятичный логарифм концентрации ионов ОН- в водном растворе. рОН = -lg СОН-.
Ранее было показано, что в любом водном растворе при
22-25оС: СН+∙СОН- = 10-14.
Логарифмируя это выражение, получаем:
-lg (CH+∙COH-) = -lg10-14.
Десятичный логарифм – это показатель степени, в
которую нужно возвести 10: |
|
|
1g10x = х, |
lg10-x = -х. |
|
Логарифм произведения равен сумме логарифмов: |
||
-lgCH+ -lgCOH- = 14 |
|
|
рН + рОН = 14 |
Т = 22-25оС |
|
рН + рОН = 13,6 |
при 37оС |
|
рОН = 14 – рН или |
рН = 14 – рОН при 22-25оС |
|
Выразим рН слабого электролита, если даны Кион., , Ск-ты или Сосн. или отрицательные логарифмы этих величин.
Для слабой кислоты: СН+ = Ск
61
-lgСН+ = -lg - lgСк
рН = р + рСк-ты, где р = -lg, следовательно р = -lg ; рСк = - lgСк
или через константу ионизации:
СН+ = Ск-ты.
По закону разведения Оствальда:
Подставим : |
С |
|
|
К |
С |
|
|
Н |
С |
к |
|||||
|
|
|
|
||||
|
|
|
|
|
|
||
|
|
|
|
к ты |
|
|
Внесем Ск-ты под корень:
|
K |
. |
||
C |
||||
|
|
|
||
|
|
к ты |
|
|
ты |
. |
|
|
|
|
|
|
||
|
|
|
|
|
К С |
2 |
к ты |
|
|
|
|
|
С |
|
|
|
|
|
К С |
к ты |
. |
||
|
Н |
|
С |
|
|
||||||
|
|
|
|
ты |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
к |
|
|
|
|
||
|
Возьмем отрицательный логарифм этого выражения. |
||||||||||
Получим для слабой кислоты: |
|
|
|
||||||||
|
|
|
|
|
|
|
|||||
|
рН = ½ (рК + рСк-ты), |
|
|
|
|||||||
|
где |
|
|
рК = -lgК; |
|
рСк-ты = -lgСк-ты. |
|||||
Для сильной кислоты:
= 1 и уравнение рН = р + рСк-ты , т.к. р = -lg = - lg1 = 0 преобразуется к виду:
рН = рСк-ты Для слабого основания
СОН- = Сосн.
-lgCOH- = -lg – lgСосн.
рОН = р + рС , где р = -lg ; рСосн. = - lgСосн. или через константу ионизации:
СОН- = Сосн.
|
К |
|
|
|
|
К |
|
|
|
|
|
, |
С |
ОН |
- |
Сосн. |
|
К Сосн. |
|||
|
|
|||||||||
Сосн. |
Сосн. |
|||||||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
Логарифмируя это выражение, получим: |
|
|
|
|||||||
рОН = ½ (рК + рСосн.) |
- для слабого основания, |
|
|
|||||||
где |
рОН = -lgCOH- |
|
|
|
|
|
|
|
||
62
рК = -lgК
рСосн. = -lgСосн.
Для сильного основания
= 1, значит lg = 0, рОН = рСо .
Для наглядности приведем шкалу значений рН и СН+ при 22оС.
Водородный показатель широко используется для характеристики кислотно-основных свойств различных биологических жидкостей. Значение рН среды оказывает влияние на физико-химические свойства и биологическую активность белков, ферментов, нуклеиновых кислот.
Значение рН некоторых биологических жидкостей организма при 37оС
Биологическая |
Кровь |
Желудочн |
Кишечный |
Слюна |
Желчь |
|
жидкость |
ый сок |
сок |
||||
|
|
|
||||
Значение рН |
7,36 ± 0,05 |
1,0 ± 0,1 |
6,4 ± 0,4 |
6,6 ± 0,3 |
6,9 ± 0,4 |
Как видно из таблицы рН различных жидкостей изменяется в довольно широких пределах в зависимости от их природы.
При патологических процессах наблюдается нарушение кислотно-щелочного равновесия: смещение рН биологической жидкости в кислую область, получило название ацидоз, а в щелочную область – алкалоз.
4.3. Сильные электролиты. Активность ионов
В водных растворах сильные электролиты обычно полностью диссоциированы на ионы. В концентрированных растворах расстояние между ионами сравнительно мало. При этом силы межионного притяжения и отталкивания достаточно
63

велики. В таких растворах ионы не вполне свободны, движение их стеснено притяжением друг к другу. Для оценки межионного взаимодействия ввели формальное представление об эффективной концентрации – активности (а). Активность связана с истинной концентрацией растворенного вещества соотношением:
|
a = fC, |
где |
а – активность, моль/л; |
|
С – молярная концентрация, моль/л; |
|
f – коэффициент активности. Это безразмерная |
величина, меньше единицы. Он характеризует степень отклонения свойств данного раствора от свойств идеального раствора.
Для бесконечно разбавленных растворов электролитов, где практически отсутствует взаимодействие ионов, активность становится равной концентрации а = С, и коэффициент активности равен единице f = 1.
Коэффициенты активности различных ионов различны. В разбавленных растворах природа ионов мало влияет на значения их коэффициентов активности. Приближенно можно считать, что коэффициент активности данного иона зависит только от его заряда и от ионной силы раствора (I), под которой понимают полусумму произведений всех концентраций, находящихся в растворе ионов на квадрат их заряда.
I |
1 |
(C Z2 |
C |
|
Z2 |
... C |
|
Z2 ) |
|
|
2 |
n |
|||||||
|
2 |
1 |
1 |
|
2 |
|
n |
||
|
|
|
|
|
|
|
|
|
|
Коэффициент активности иона в разбавленном растворе можно вычислить по формуле или воспользоваться таблицей.
lg f 0,5Z2 
 I 1
I 1 
 I
I
Пользуясь таблицей 8 (см. приложения) нетрудно установить, что в растворах с одинаковой ионной силой коэффициенты активности ионов с одинаковым по модулю зарядом одинаковы. Например, при I = 0,001:
f |
Na |
|
f |
Cl |
|
0,96; |
f |
2 |
f |
2- 0,87 . |
|
|
|
|
|
|
M g |
|
SO4 |
64
При одинаковой однозарядного иона
трехзарядного: f |
K |
|
f |
Ba |
|
|
|
ионной силе коэффициент активности больше, чем двухзарядного или
2 f |
3 . |
|
Fe |
65
