
Задачи Крюкова / Кинетика 14
.docxЗадача №1. Изучая кинетику некоторой реакции А → продукты, обнаружено, что при начальной концентрации реагента А, равной 4.86·10-3 моль/л, 50%-ная конверсия достигалась через 399 сек, при начальной концентрации, равной 2.28·10-3 моль/л, – через 696 сек. Определите порядок реакции и константу скорости реакции.
Дано:

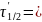 399
сек
399
сек
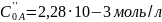
 696
сек
696
сек
Найти:
1)Порядок реакции n
2)Константа скорости реакции k
Решение:
1)Расчет порядка реакции:
Так как нам известны две начальные концентрации вещества А и два времени полураспада соответственно, используем уравнение для расчета порядка реакции по методу Оствальда-Нойесса:
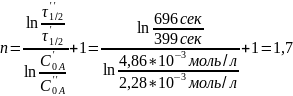
Данная реакция имеет порядок 1,7.
2)Расчет константы скорости реакции:
Для реакции n-порядка константа скорости рассчитывается по формуле:
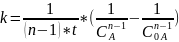
В момент полураспада концентрация
вещества А равна (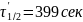 ):
):
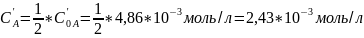
Подставляем известные величины в уравнение и находим константу скорости реакции:

Ответ: n=1,7; k=0,0906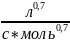 .
.
Задача №2. Образование этилового эфира муравьиной кислоты при 303 К протекает по уравнению обратимой реакции первого порядка
НСООН + С2Н5ОН![]() НСООС2Н5
+ Н2О.
НСООС2Н5
+ Н2О.
При изучении кинетики этой реакции были получены следующие результаты (концентрацию кислоты определяли титрованием):
Таблица №1
t, мин |
0 |
1700 |
10000 |
14000 |
20000 |
40000 |
Объём кислоты, мл |
29.44 |
28.59 |
24.77 |
23.05 |
21.28 |
16.80 |
Константа скорости обратной реакции k-1 = 1.15·10-5 мин-1. Концентрация продукта прямой реакции в начальный момент равна 0. Определите константу скорости прямой реакции и константу равновесия.
Дано:
k-1 = 1.15·10-5 мин-1

T=303 К
n=1
Найти:
1)Константа скорости прямой реакции
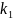
2)Константа равновесия
Решение:
1)Сумма констант скоростей вычисляется по следующему уравнению, так как данная реакция первого порядка:
 ,
где
,
где

Исходя из того, что с течением реакции
концентрация и объём исходных веществ
уменьшаются пропорционально увеличению
концентрации и объёму продуктов реакции,
заменим
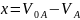 ,
,
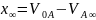
Вычислим
 :
:

2) Константу равновесия можно вычислить
из соотношения равновесных концентраций
реагента и продукта ( :
:
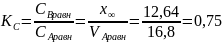
3)Константу скорости прямой реакции получаем, зная значение константы скорости обратной реакции и константы равновесия:

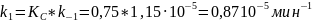
Ответ:
=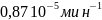 ,
,

Задача №3. В растворе содержится 0.1 моль этилацетата и 0.1 моль NaOH. При 283 К в течение 15 минут омыляется 10% эфира, а при 298 К за тот же промежуток времени – 20%. Вычислите количество эфира, которое омыляется в течение 5 мин при 313 К.
Дано:

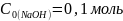
 =900c
=900c
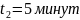 =300c
=300c
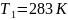
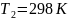

Найти:
x- количество
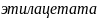 ,
которое эфира, которое омыляется в
течение 5 мин при 313 К.
,
которое эфира, которое омыляется в
течение 5 мин при 313 К.
Решение:
Так как исходные концентрации веществ в растворе равны, используем уравнение для нахождения констант скорости реакции первого порядка:
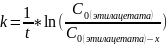
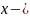 количество
,
которое вступило в реакцию.
количество
,
которое вступило в реакцию.
Рассчитаем
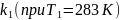 и
и
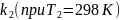 :
:
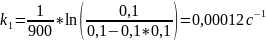
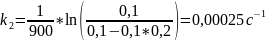
Рассчитаем энергию активации:

3)Рассчитаем константу скорости
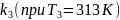 :
:
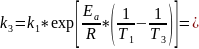

4)Выразим из уравнения для нахождения констант скорости реакции первого порядка x:
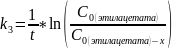
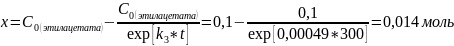
Ответ:

