
Задачи Крюкова / Кинетика 1
.docx1. При взаимодействии эквивалентных количеств моноксида углерода и хлора по уравнению:
СО + Cl2 → COCl2
при 300 К в присутствии катализатора наблюдалось следующее уменьшение общего давления системы:
t, мин |
0 |
5 |
10 |
15 |
21 |
р·10-5, Па |
0.965 |
0.900 |
0.829 |
0.779 |
0.735 |
Определите порядок реакции (V = const).
Решение:
Давления, приведенные в условии задачи (за исключением первого), — это суммарные давления всех газов, а для вычисления константы скорости необходимо знать давление исходного вещества pA в различные моменты времени. Рассчитаем это давление.
СО + Cl2 → COCl2
t = 0, p0/2 p0/2 0
t 0, (p0/2)-x (p0/2)-x x
Общее давление p в любой момент времени t равно:
P= p0-2x+x=p0-x
Откуда x=p0-P
PА= (p0/2)-x=(p0/2)-p0+P=P-(p0/2)
t, мин |
0 |
5 |
10 |
15 |
21 |
р·10-5, Па |
0,4825 |
0,4175 |
0,3465 |
0,2965 |
0,2525 |
Предположим, что реакция протекает, как реакция 1 порядка.
Воспользуемся аналитическим вариантом метода подбора:
Рассчитаем константы скорости реакции по уравнению (в случае равных концентраций):
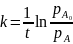
Константа реакции, вычисленная по уравнению, для любого момента времени должна оставаться постоянной.
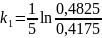 =0,0289
мин-1
=0,0289
мин-1
 =0,0331
мин-1
=0,0331
мин-1
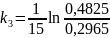 =0,0325
мин-1
=0,0325
мин-1
 =0,0308
мин-1
=0,0308
мин-1
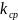 =0,0313
мин-1
=0,0313
мин-1
Так как в пределах ошибки опыта константа скорости постоянная, следовательно, эта реакция является реакцией первого порядка.
Воспользуемся графическим методом подбора:
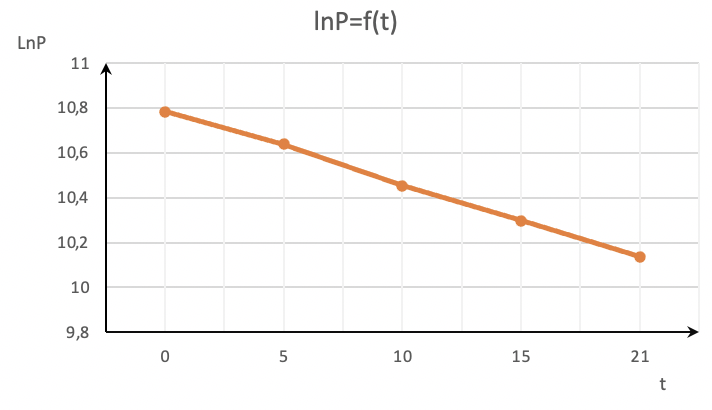
Для реакции первого
порядка уравнение прямой:
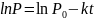
Т.к. опытные точки расположились прямолинейно на графике в координатах lnP–t, а на других графиках получались кривые, то это указывает на то, что рассматриваемая реакция имеет первый порядок.
Ответ: данная реакция 1 порядка.
2. Реакция С6Н5N(CH3)2 + CH3I → С6Н5N(CH3)3+ + I–
характеризуется
единичными частными порядками по каждому
из реагентов. При проведении реакции в
нитробензоле (растворитель) при 24.8 оС
константа скорости составляет 8.39·10-5
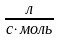 .
Рассчитайте время, через которое
израсходуется 75% С6Н5N(CH3)2,
если начальные концентрации реагентов
были равны и составляли 0.1 моль/л.
.
Рассчитайте время, через которое
израсходуется 75% С6Н5N(CH3)2,
если начальные концентрации реагентов
были равны и составляли 0.1 моль/л.
Решение:
Реакция С6Н5N(CH3)2 + CH3I → С6Н5N(CH3)3+ + I– является реакцией второго порядка, когда начальные концентрации равны.
Рассчитаем время, через которое израсходуется 75% С6Н5N(CH3)2 :
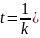 )
)
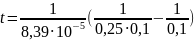 =357568,5
c
= 99,3 ч
=357568,5
c
= 99,3 ч
Ответ:
через 99,3 часов 100
часов.
100
часов.
3. Две реакции одинакового порядка имеют равные предэкспоненциальные множители, но их энергии активации различаются на 41.9 кДж/моль. Рассчитайте соотношение скоростей этих реакций при 600 К.
Решение:
Используя уравнение
Аррениуса:
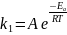
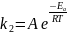
Т.к. данные о величине константы скорости неизвестны, то вместо константы скорости в уравнении Аррениуса можно подставить другие, связанные с ней величины. Например, начальные скорости реакции при разных температурах или время, за которое выход продукта реакции составит заданную величину при разных температурах.
Если (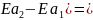 41,9
кДж/моль
41,9
кДж/моль
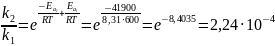
Если ( )=41,9
кДж/моль
)=41,9
кДж/моль
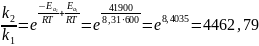
Ответ:
 ;
4462,79
;
4462,79
