
- •Процессы алкилирования
- •С-алкилирование аренов
- •3. Катализаторы в процессах алкилирования:
- •4. Механизм взаимодействия катализатора с алкилирующим агентом
- •2. С-алкилирование алифатических субстратов.
- •N-алкилирование
- •О-алкилирование (получение простых эфиров)
- •Оксиметилирование
- •Галогенметилирование
- •Аминометилирование (аминоалкилирование)
- •Стадия «ОКСИМЕТИЛИРОВАНИЕ»

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
ПРОЦЕССЫ АЛКИЛИРОВАНИЯ
Алкилирование - процесс замещения атома водорода или металла в молекуле субстрата на алкил. Различают С-, N- и О-алкилирование. Если в молекулу вводится арил, реакция называется арилированием.
В качестве алкилирующих агентов используют главным образом, галогенпроизводные, непредельные соединения, спирты и эфиры серной и сульфокислот.
Алкилирование используется для построения углеродного скелета молекулы, а также защиты функциональных групп (гидроксильной или аминогруппы).
С-алкилирование аренов
С-Алкилирование аренов можно проводить по Вюрцу-Фиттигу, Вюрцу-Гриньяру и т.д., но в промышленности чаще всего используется
реакция Фриделя –Крафтса:
ArH + RX (RCH=CH , ROH) |
кат. |
Ar-R + HX (H O) |
|
||
2 |
|
2 |
В качестве алкилирующих агентов применяют в основном алкилгалогениды, алкены и спирты.
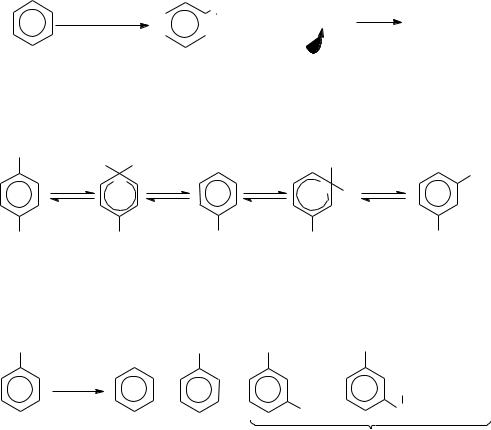
1.Механизм реакции - обратимое электрофильное замещение (SE). Скорость реакции определяется устойчивостью -комплекса а также
концентрацией реагирующих веществ и катализатором.
Направление реакции в связи с её обратимостью зависит от условий её проведения: 1) в мягких условиях определяется устойчивостью
-комплекса (кинетический контроль) и выполняются правила ориентации. 2) в жестких условиях (значительные температура, длительность процесса, количества катализатора) - определяется
устойчивостью конечных продуктов (термодинамический контроль
реакции) и правила ориентации не выполняются. Например, при метилировании толуола метилхлоридом при 0°С образуется 27% м-ксилола,
при 55° - 87%, а при 106°С – 98%.
CH |
|
CH |
CH |
CH |
|
o |
|
|
|
3 |
|
3 |
3 |
|
0 C |
- |
|
27% |
|
|
|
|
3 |
|
|
||||
|
|
CH |
|
|
|
|
|
|
|
|
CH Cl |
3 |
|
|
|
o |
|
|
|
|
3 |
|
|
|
|
- |
87% |
||
|
|
+ |
|
+ |
+ ..... |
55 C |
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
CH |
o |
|
|
|
|
|
|
|
|
3 |
|
- |
98% |
|
|
|
|
|
|
|
106 C |
|||
|
|
|
CH |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
2. Основные недостатки реакции Фриделя-Крафтса:
1) Полиалкилирование, что объясняется большей реакционной способностью продуктов алкилирования, чем исходного субстрата.
RX, кат. |
R |
RX, кат. |
R RX, кат. |
R |
|
||||
< |
|
< |
< |
R |
|
|
R |
R |
Реакци о н н ая сп о со бн о сть со еди н ен и й увели чи вается
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
2
2) Изомеризация радикала, которая вызвана превращением
образующегося карбкатиона в более стабильный. Например:
CH3CH2CH2X, кат. |
|
CHCH3 |
+ |
+ |
||
|
|
|||||
|
CH3 |
; CH3 |
|
CHCH2 |
CH3CH CH3 |
|
|
|
|
||||
|
|
|
||||
3) Изомеризация продукта реакции, которая вызвана обратимостью реакции. Например: При нагревании п-ксилола с хлористым водородом и AlCl3, большая часть углеводорода превращается в термодинамически более устойчивый м-ксилол:
CH3 |
H |
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
CH3 |
||||
|
[AlCl4]-H+ |
|
|
|
|
CH + |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
+ |
|
|
|
3 |
+ |
H |
|
|
|
CH |
+ |
|
|
[AlCl ]-H+ |
|||
|
|
|
|
|
|
|
|||
|
|
|
3 |
|
|
|
|
|
4 |
CH3 |
|
CH3 |
|
|
CH3 |
|
CH3 |
|
CH3 |
При этом в ряде случаев добавление веществ, связывающих галогеноводород, предотвращает обратимость реакции.
4) Диспропорционирование алкиларенов. Одновременно может происходить и изомеризация перемещающейся группы:
CH CH CH |
|
Pr |
Pr |
Pr |
|
||
2 |
2 |
3 |
|
|
|
|
|
|
HF,BF |
|
|
|
CH |
|
|
|
|
3 |
+ |
+ |
+ |
+ ... |
|
|
|
|
3 |
||||
|
|
|
|
|
Pr |
CHCH |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
äî 50% |
|
Изомеризация и диспропорционирование конечного продукта в кислой среде может служить доказательством обратимости процесса
алкилирования.
3.Катализаторы в процессах алкилирования:
1.Протонные кислоты - их активность как катализаторов не зависит от Кдис. и падает в ряду HF > H2SO4 > H3PO4.
2.Апротонные кислоты (кислоты Льюиса) - по активности их
можно расположить в следующий ряд: AlBr3 > AlCl3 > FeCl3 > ZnCl2
3.Оксиды металлов и бора (B2O3). Наиболее активными оказались амфотерные оксиды (Al2O3, Cr2O3 и др.), модифицированные BF3.
4.Цеолиты, общей формулы M2/nО.Al2O3.xSiO2.yH2O, где М – металл; n – его валентность.
5.Катиониты, представляющие собой полимеры (чаще всего
полистирольные), содержащие –SO3H, -COOH, -PO3H2 и другие группы. Активность катализатора зависит также и от 1) строения субстрата;
2)природы алкилирующего агента; 3) условий реакции (температура,
давление и т.д.). Например, BF3 является активным катализатором при алкилировании спиртами, алкенами, фторпроизводными, но при
алкилировании другими алкилгалогенидами его активность мала.
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
3
4. Механизм взаимодействия катализатора с алкилирующим агентом
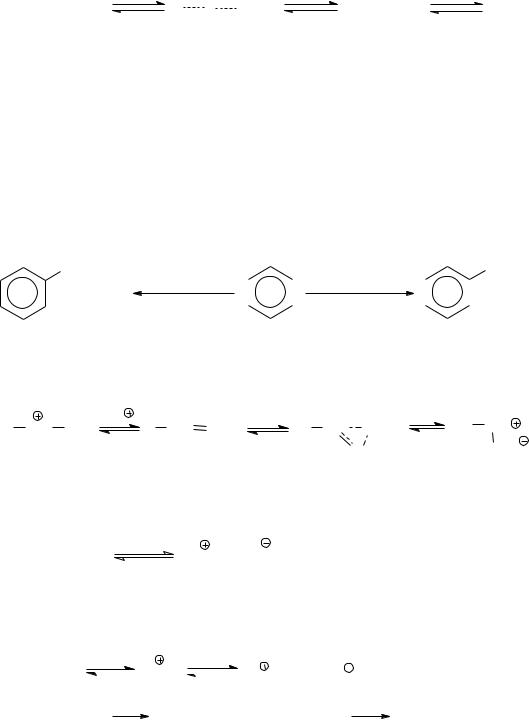
А) В случае алкилирования алкилгалогенидами в качестве катализатора используется в основном кислота Льюиса, которая, взаимодействуя с алкилгалогенидом, образует поляризованный комплекс, ионную пару или карбокатион, активность которых в этом ряду увеличивается:
|
|
|
|
|
|
|
||
|
|
|
+ |
- |
+ |
- |
||
RCl + AlCl3 |
R |
Cl |
AlCl3 |
|||||
R |
|| AlCl4 |
R |
+ AlCl4 |
|||||
В связи с этим, кислота Льюиса, определяет скорость реакции алкилгалогенида с ареном, состав продуктов реакции и возможность
изомеризации радикала.
- Активный катализатор в большей степени образует карбкатион, который до взаимодействия с ареном успевает изомеризоваться в более стабильный. В случае малоактивного катализатора основной атакующей частицей является поляризованный комплекс, и изомеризация алкила не наблюдается. Например, при алкилировании бензола неопентилхлоридом в
присутствии AlCl3 образуется трет.пентилбензол, а в случае FeCl3, - неопентилбензол:
CH |
|
|
|
|
|
|
|
|
CH |
|
||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH CCH |
|
|
|
|
|
|
|
CCH CH |
||||||
2 |
|
|
3 |
|
|
|
(CH ) CH Cl,AlCl |
|
|
|
2 |
3 |
||
|
|
|
|
|
|
|
||||||||
|
|
|
(CH ) CH Cl,FeCl |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
3 3 |
2 |
3 |
|
|
|
|
|
|||
CH |
3 3 |
2 |
3 |
|
|
|
|
|
CH |
|
||||
|
|
|
|
|
|
|
|
|
||||||
3 |
|
|
|
|
|
|
|
|
3 |
|
||||
Б) При алкилировании аренов алкенами используются протонные и апротонные кислоты.
Образование электрофильных частиц проходит по схеме:
H |
R CH |
+ AlCl3 |
+ |
|
R CH |
R CH CH3 |
CH2 |
R CH |
AlCl3 |
||
|
|
|
+ CH2 |
CH2AlCl3 |
|
Однако вполне вероятно, что кислота Льюиса в присутствии следов воды, спирта и др. сначала превращается в протонную кислоту, которая и катализирует процесс:
HCl + AlCl |
3 |
H + AlCl |
|
4 |
В) Алкилирование аренов спиртами применяют сравнительно редко,
и ведут в присутствии сильных протонных кислот (серная и фосфорная кислоты), а также хлорида алюминия, алюмосиликата и др.
Электрофильные частицы образуются по следующим схемам:
|
|
|
|
|
|
|
|
|
|
||
ROH + HX |
|
ROH2 |
|
|
R |
|
+ H2O + X |
|
или |
||
|
|
||||||||||
|
|
|
|||||||||
|
|
|
|
|
|||||||
|
|
+ H |
- |
|
|
|
|
|
|||
R-OH + AlCl3 |
|
|
... |
|
AlCl3 + H2O |
Al(OH)3 + HCl |
|||||
|
|||||||||||
|
|||||||||||
R-O AlCl3 |
|||||||||||
